單孔加一孔腹腔鏡胃癌根治術的近期療效觀察
陳志永,賈東亞,王垚,姜庭榮
(馬鞍山市人民醫院普外四科,安徽 馬鞍山 243000)
胃癌是全球第四大惡性腫瘤,也是腫瘤相關死亡的第三大原因[1]。手術是早期胃癌最有效的治療手段。隨著微創外科技術的快速發展,腹腔鏡遠端胃癌根治術日趨成熟,能夠獲得與開腹手術相當的根治效果,且創傷小、恢復快,已成為臨床指南推薦的早期胃癌標準治療方式[2]。隨著傳統五孔腹腔鏡技術應用的增多,其存在的不足也日益凸顯并引起關注,如Trocar孔多、手術切口大、切口疼痛明顯、切口欠美觀等。近年來,單孔腹腔鏡技術(single incision laparoscopic surgery,SILS)逐漸興起并成為熱點[3-4],但操作難度大,臨床應用受限[5]。單孔加一(single-port plus one-port,SILS+1)是由SILS進一步發展而來的新型改良腹腔鏡手術,其通過形成倒三角平面,使手術難度降低,操作易于完成。本研究通過對比SILS+1腹腔鏡技術與傳統五孔腹腔鏡手術圍手術期基本情況、術后并發癥及胃腸激素、炎癥因子的差異,以探討SILS+1腹腔鏡手術的近期療效,為臨床提供參考。
1 資料與方法
1.1 一般資料
選取2018年1月至2020年12月馬鞍山市人民醫院96例行胃癌根治術的患者為研究對象,依據手術方式不同分為SILS+1組(n=45)傳統組(n=51)。SILS+1組中,男性30例,女性15例;平均年齡(56.78±9.45)歲;平均體質指數(22.56±2.69)kg/m2;平均腫瘤直徑(2.58±0.83)cm;侵犯淋巴血管4例;分化程度:低分化18例,低中分化19例,中分化8例;合并癥:高血壓5例,糖尿病3例,冠心病2例。傳統組中,男性32例,女性19例;平均年齡(557.12±9.74)歲;平均體質指數(22.71±3.14)kg/m2;平均腫瘤直徑(2.55±0.74)cm;侵犯淋巴血管5例;分化程度:低分化25例,低中分化17例,中分化9例;合并癥:高血壓9例,糖尿病4例,冠心病2例。兩組患者一般資料比較,差異無統計學意義(P>0.05)。
納入標準:(1)術后病理證實為I期胃癌;(2)無遠處轉移;(3)行遠端胃切除術;(4)術前未行放化療等治療;(5)年齡20~80歲。排除標準:(1)既往有上腹部手術史者;(2)行腫瘤姑息性切除者;(3)合并其他腫瘤者;(4)伴嚴重基礎疾病,無法耐受手術者;(5)臨床資料不完整者。
1.2 方法
患者采取平臥分腿位,予全身麻醉。SILS+1組實施SILS+1腹腔鏡手術:于患者臍周皺褶處,做一3~4 cm切口,然后置入穿刺套管,建立氣腹(維持氣腹壓力為1.3~1.6 kpa),置入腹腔鏡及手術器械,于左腋前線肋緣下約2 cm位置做1.5 cm切口,置入12 cm Trocar,為主操作孔,并放置好超聲刀。先行遠端胃根治性切除,然后在與Treitz韌帶相距約30 cm位置的空腸打開系膜緣形成一小孔,放置60 mm直線切割器,一頭推送至肛側,另外一頭插進殘胃,進行殘胃空腸側側吻合,縫合關閉開口。并于上述吻合口以下約25 cm的空腸實施布朗吻合術。在左上腹的Trocar孔位置留置引流管,關閉氣腹,留取遠端胃標本,依次縫合關腹,術畢。傳統組實施五孔腹腔鏡手術[6]:置入穿刺套管,建立氣腹,行標準D2遠端胃切除及淋巴結清掃。
1.3 觀察指標
(1)圍手術期基本情況:包括手術切口長度、手術時間、術中出血量、排氣時間、胃管拔除時間、引流管拔除時間、首次進食半流食時間、術后住院時間、淋巴結清掃數目及術后并發癥情況。(2)胃腸激素及炎癥因子:術前1 d及術后3 d采用酶聯免疫吸附法檢測,試劑盒購于上海康朗生物科技有限公司,操作按說明書進行。胃腸激素包括胃泌素(gastrin,GAS)、胃動素(motilin ,MTL)、抑胃肽(gastric inhibitory peptide ,GIP);炎癥因子包括C反應蛋白(c-reactive protein,CRP)、腫瘤壞死因子-α(tumor necrosis factor- α,TNF-α)、白細胞介素-6(interleukin-6,IL-6)。
1.4 統計學分析

2 結果
2.1 兩組患者圍手術期基本情況比較
SILS+1組患者切口長度、術中出血量小于傳統組(P<0.05),排氣時間、首次進食半流食時間、術后住院時間較傳統組提前(P<0.05);兩組患者手術時間、胃管拔除時間、引流管拔除時間及淋巴結清掃數目比較,差異無統計學意義(P>0.05)。見表1。
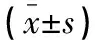
表1 兩組患者圍手術期基本情況比較
2.2 兩組患者術后并發癥比較
SILS+1組患者術后并發癥發生率低于傳統組,差異無統計學意義(P>0.05)。見表2。

表2 兩組患者術后并發癥情況比較[n(%)]
2.3 兩組患者血清胃腸激素水平比較
術前,兩組患者血清GAS、MTL、GIP水平比較,差異無統計學意義(P>0.05);術后,兩組患者血清GAS、MTL、GIP水平均降低(P<0.05),且傳統組低于SILS+1組(P<0.05)。見表3。
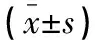
表3 兩組患者血清胃腸激素水平比較
2.4 兩組患者血清炎癥因子水平比較
術前,兩組患者血清CRP、TNF-α、IL-6水平比較,差異無統計學意義(P>0.05);術后,兩組患者血清CRP、TNF-α、IL-6水平均升高(P<0.05),且傳統組高于 SILS+1組(P<0.05)。見表4。
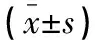
表4 兩組患者血清炎癥因子水平比較
3 討論
腹腔鏡技術作為早期胃癌的主要手術方式,可獲得較好的近期療效,遠期療效與開腹手術相當[7]。單孔腹腔鏡技術通過單一小切口完成手術操作,具有腹壁破壞小、疼痛輕、切口美觀、術后恢復快等優點[8],但由于缺乏操作三角,手術難度大,對術者要求高;而SILS+1腹腔鏡技術在單孔基礎上增加一個操作孔,使操作由小三角為大三角,大大降低了手術操作的難度[9]。
Omori等[10]首次報道了SILS+1腹腔鏡技術在胃癌患者治療中的應用,發現其療效可靠,且微創美觀;Liu等[11]研究也發現,SILS+1腹腔鏡手術具有切口小、術后恢復快、更加微創的優勢;江恩來等[12]報道還顯示,SILS+1腹腔鏡手術相比傳統腹腔鏡手術雖手術時間稍長,但近期療效好,應激反應輕微,術后恢復快。本研究結果顯示,相比傳統組,SILS+1組患者切口長度較短,術中出血量較少,排氣時間、首次進食半流食時間、術后住院時間均提前(P<0.05),而兩組患者手術時間、淋巴結清掃數目及術后并發癥發生率比較,差異無統計學意義(P>0.05),與魏丞等[13]的報道類似,表明SILS+1腹腔鏡手術可獲得更好的近期療效,可能與手術切口小、軀體疼痛輕微等有關。
胃癌切除術會影響胃腸功能,檢測胃腸激素的變化對于評估手術創傷及術后恢復有著重要意義。GAS、MTL、GIP均是機體重要的胃腸激素,有調控消化道運動、營養機體及參與代謝的多重作用[14-15]。本研究中,兩組患者術后GAS、MTL、GIP水平均低于術前(P<0.05),且傳統組低于SILS+1組(P<0.05),提示SILS+1腹腔鏡技術可減輕對胃腸功能的影響,改善患者術后胃腸激素的表達。
手術創傷應激激活炎癥反應,不僅會影響切口愈合,還會造成免疫抑制,進而延長術后恢復時間[16-17]。CRP、TNF-α、IL-6均是重要的炎癥因子,能夠反映機體的炎癥應激反應。本研究結果顯示,兩組患者術后血清CRP、TNF-α、IL-6水平均升高(P<0.05),且傳統組高于SILS+1組(P<0.05),與既往報道[18]一致,表明手術創傷會產生明顯炎癥反應,而SILS+1腹腔鏡手術炎癥應激反應較輕,有利于促進術后恢復,可能與手術切口更小、術中出血更少有關。
綜上,SILS+1腹腔鏡手術很好地融合了單孔與全腹腔鏡手術的優勢,在降低手術難度與追求美觀之間找到一個合理的平衡點,兼具微創美觀及可操作性,有望成為胃癌外科手術方式的新選擇,但其遠期療效仍需進一步研究。

