檳榔籽提取物抗炎作用及化學成分研究
唐敏敏 宋菲 陳華 李瑞


摘? 要:檳榔是我國四大南藥之首,然而目前關于海南檳榔抗炎活性的研究甚少。本文制備了海南檳榔籽75%乙醇提取物(EA-ANE),并依次得到石油醚部位(PE-ANE)、乙酸乙酯部位(EAC-ANE)、正丁醇部位(BU-ANE)和水相(W-ANE),考察了不同萃取部位對脂多糖(LPS)誘導的小鼠巨噬細胞(RAW264.7)產生一氧化氮(NO)、細胞因子和活性氧(ROS)的抑制作用,且測定了不同萃取部位的總多酚、總黃酮和原花青素含量,并采用超高效液相色譜-串聯四極桿飛行時間質譜技術(UHPLC-QTOF-MS/MS)對抗炎活性較好的萃取部位進行了類黃酮組分的定性鑒定。結果表明,在濃度為0~200 μg/mL,EAC-ANE對LPS誘導RAW264.7細胞分泌NO、小鼠腫瘤壞死因子(TNF-α)、白細胞介素-6(IL-6)、白細胞介素-1β(IL-1β)、前列腺素2(PGE2)和ROS具有抑制作用,且具有濃度依賴性;EAC-ANE中,總多酚、總黃酮和原花青素的含量分別為(517.18±21.81)、(406.40±8.16)、(91.23±5.01)mg/g;從EAC-ANE中鑒定出76種類黃酮化合物,其中,兒茶素的相對含量最高(58.35%),其次為L-表兒茶素、原花青素B1、原花青素B2、原兒茶酸、桔皮素、原兒茶醛等。
關鍵詞:檳榔;抗炎;總多酚;原花青素;類黃酮
中圖分類號:S792.91; R284.1????? 文獻標識碼:A
Anti-inflammatory Effects and Chemical Constituent Analysis of the Ethanol Extract of Areca catechu Seeds
TANG Minmin1,2, SONG Fei1,2, CHEN Hua1,2, LI Rui3
1. Coconut Research Institute, Chinese Academy of Tropical Agricultural Sciences, Wenchang, Hainan 571339, China; 2. Hainan Engineering Research Center of Arecanut Industry, Wenchang, Hainan 571339, China; 3. College of Food Science and Technology, Guangdong Ocean University, Zhanjiang, Guangdong 524088, China
Abstract: Areca catechu nut is the first of the four southern medicines in China. However, there are few studies on the anti-inflammatory activities of the material produced in Hainan. In this paper, 75% ethanol extract (EA-ANE) from Hainan areca nut seeds was prepared, and four fractions extracted by petroleum ether (PE-ANE), ethyl acetate (EAC-ANE), n-butanol (BU-ANE) and water (W-ANE) were obtained in turn. The inhibitory effects of different fractions on the production of nitric oxide (NO), cell cytokines and reactive oxygen species (ROS) were determined in lipopolysaccharide (LPS) induced macrophages (RAW264.7). Contents of total phenols, total flavonoids and proanthocyanidins in different fractions of ANE were determined, and 86 flavonoids were identified by ultra performance liquid chromatography tandem quadrupole time of flight mass spectrometry (UHPLC-QTOF-MS/MS). The results showed that EAC-ANE could significantly inhibit the secretion of NO, TNF-α, IL-6, IL-1β, PGE2 and ROS induced by LPS in RAW264.7 cells with a concentration-dependent manner. Contents of total polyphenols, flavonoids and procyanidins EAC-ANE was (517.18±21.81), (406.40±8.16), and (91.23±5.01) mg/g, respectively. 76 kinds of flavonoids were identified from the fraction. Among them, the relative content of catechin was the highest (58.35%), followed by L-epicatechin, procyanidin B1, procyanidin B2, protocatechuic acid, hesperidin, protocatechuic aldehyde.
Keywords: Areca catechu nut; anti-inflammatory; total polyphenols; proanthocyanidins; flavonoids
DOI: 10.3969/j.issn.1000-2561.2021.07.030
檳榔為棕櫚科植物檳榔(Areca catechu Linn)的果實,是我國四大南藥(檳榔、砂仁、益智、巴戟天)之首,在我國中醫藥中的應用已有將近2000年的歷史。傳統中醫認為,檳榔具有驅蟲破積、降氣行滯、行水化濕的功效,曾被用于治療多種寄生蟲感染疾病。現代研究表明,檳榔含有生物堿、黃酮類、單寧類、酚酸、原花青素[1-2]以及多糖[3]等多種生理活性物質,具有抗氧化、緩解疲勞[4]、改善腸胃功能[5-6]、抗抑郁[7]、調節血糖水平[8]、抗動脈粥樣硬化[9]、抗炎鎮痛和抗過敏[10-11]等作用。2020年1月22日,國家衛生健康委員會辦公廳發布了《新型冠狀病毒診療方案(試行第三版)》,檳榔被正式納入中醫診療方案的藥方。經過辯證討論與臨床實踐,《新型冠狀病毒診療方案》試行第四版至試行第七版的4個版本中繼續保留了上述藥方,明確了藥量,并且新增了針對濕熱蘊肺證的包含檳榔的新藥方。不僅如此,廣東省的新型冠狀病毒肺炎中醫藥治療方案中也出現了包含檳榔的藥方。因此,檳榔具有重要的藥用價值潛力,需要深度挖掘。
項目組前期預實驗結果表明,檳榔籽75%乙醇提取物較水提物具有更好的抗炎潛力。因此,本文制備了檳榔籽75%乙醇提取物,并分別分離萃取出石油醚、乙酸乙酯、正丁醇和水相部位,篩選出對LPS誘導的RAW264.7 細胞產生一氧化氮(NO)具有較好抑制作用的部位,并研究了活性部位對細胞因子和胞內ROS產生的影響,還測定了不同萃取部位總多酚、總黃酮和原花青素的含量,并對類黃酮成分組成進行了初步定性分析,為科學合理開發檳榔資源,全面評價檳榔的化學成分和藥理活性提供基礎數據支撐。
1? 材料與方法
1.1? 材料
1.1.1? 材料與試劑? 成熟的檳榔果實采自中國熱帶農業科學院椰子研究所科研試驗基地,去殼取籽,冷凍干燥后粉碎,過60目篩,備用。
小鼠單核巨噬細胞(RAW264.7),北京北納創聯生物技術研究院;DMEM培養基、胎牛血清、青霉素-鏈霉素雙抗等細胞培養試劑和IL-1β檢測試劑盒,賽默飛世爾科技公司;TNF-α和IL-6檢測試劑盒,法國DIACLONE公司;PGE2檢測試劑盒,艾克索生物科技股份有限公司;噻唑藍(thiazolyl blue,MTT)、脂多糖(lipopolysaccharide,LPS)、地塞米松(dexamethasone,DEX)、Griesss試劑、H2DCF-DA熒光探針、乙腈(色譜純)、甲醇(色譜純)、沒食子酸、蘆丁和兒茶素等標準品,西格瑪奧德里奇(上海)貿易有限公司;其他試劑均為分析純,國藥集團化學試劑有限公司。
1.1.2? 儀器與設備? SB-800DT 超聲波清洗機,寧波新芝生物科技股份有限公司;MS-TS分析天平,梅特勒-托利多儀器(上海)有限公司;HH-1-5L 數顯恒溫水浴鍋,金壇市科析儀器有限公司;Varioskan Flash 全波長多功能酶標儀,美國 Thermo Scientific公司;PHS-3E pH計,上海儀電科學儀器股份有限公司;RE-5210AA 旋轉蒸發儀,上海亞榮生化儀器廠;QP-80S 二氧化碳培養箱,山東博科科學儀器有限公司;752N 紫外分光度光度計,上海擔鼎國際貿易有限公司;ExionLC AD超高效液相,美國應用生物系統公司;QTrap 6500高靈敏度質譜,美國應用生物系統公司。
1.2? 方法
1.2.1? 不同提取部位的制備? 檳榔籽75%乙醇提取物的制備參照項目組前期報道[12]。得到乙醇提取物粉末稱重后,復溶于蒸餾水,并轉移到分液漏斗中,依次分別加入等體積石油醚、乙酸乙酯、正丁醇萃取3次,合并萃取液后,旋轉濃縮至干,分別獲得檳榔籽75%乙醇提取物(EA-ANE)的石油醚部位(PE-ANE)、乙酸乙酯部位(EAC- ANE)、正丁醇部位(BU-ANE)和水相(W-ANE),稱重并計算得率(以檳榔粉干物質計,%)。取以上部位少量溶于二甲基亞砜(DMSO),配制成200 mg/mL的儲備液,以0.20 μm微孔濾膜過濾后保存于–20 ℃用于后續實驗。
1.2.2? 抗炎活性篩選? (1)RAW264.7細胞培養。RAW264.7細胞復蘇后,采用含10%胎牛血清、1%的青霉素-鏈霉素雙抗的DMEM培養液,置于37 ℃、5% CO2的培養箱中培養。換液后待細胞生長融合度達到80%~90%即可進行傳代。根據不同實驗要求,配制不同濃度的細胞懸液接種至96孔板中,或分裝到培養皿中繼續培養傳代。
(2)實驗分組及處理。實驗分為正常組、LPS組、LPS+地塞米松組(DEX)、LPS+不同濃度的ANE處理組,每組均設6個復孔。正常對照組,不做任何處理,正常培養24 h;LPS組,每孔加入終濃度為1 μg/mL的LPS;LPS+DEX(100 μg/mL)組,每孔先加入終濃度為100 μg/mL的DEX對細胞預處理1 h,再加入終濃度為1 ?g/mL的LPS刺激細胞;LPS+不同濃度的ANE處理組,每孔先加入不同濃度(0~200 μg/mL)的ANE對細胞預處理1 h,再加入終濃度為1 ?g/mL的LPS刺激細胞。
(3)MTT法檢測細胞存活率。將RAW264.7細胞以5 000個/孔的密度接種于96孔板,培養過夜后,按照實驗分組(不包括LPS組),不加LPS處理細胞。孵育24 h后,取出96孔板,每孔加入5 mg/mL的MTT溶液20 μL,繼續孵育2 h后,取出96孔板。吸出上清,每孔加入200 μL DMSO,待反應產物甲臜結晶充分溶解后,用酶標儀于波長495 nm測量吸光度。
存活率=實驗組或陰性對照組 OD值/正常組OD值×100%
(4)Griess試劑法檢測LPS誘導RAW264.7細胞產生NO水平。以50 000個/孔的密度將RAW264.7細胞接種于96孔板,培養過夜后,按照實驗分組進行處理。孵育24 h后,取出96孔板。從96孔板各孔中分別取出各組細胞上清液50 μL,轉移至新的96孔板并向所有孔中分別加入50 μL濃度為25 g/L的Griess試劑,室溫下反應10 min,用酶標儀于570 nm波長測量吸光度。
NO產生率=實驗組OD值或正常組OD值/LPS組OD值×100%
(5)ELISA法檢測LPS誘導RAW264.7細胞產生的細胞因子水平。將RAW264.7細胞以120 000個/孔的密度接種于24孔板,培養過夜后,按照實驗分組進行處理。孵育24 h后,取出24孔板。培養 24 h,于4 ℃ 3000 r/min離心10 min,收集細胞上清液,每組均設6個復孔,按照 ELISA 檢測試劑盒操作用酶標儀于570 nm波長測量吸光度并計算細胞因子TNF-α、IL-6和IL-1β的含量。測定PGE2的含量時,RAW264.7細胞以200 000個/孔的密度接種于96孔板,其余操作同上。
(6)H2DCF-DA熒光探針法測定LPS誘導RAW264.7細胞產生ROS水平。細胞接種和藥物濃度按照1.2.2(2)的方法。處理24 h后,用HBSS溶液洗滌細胞,添加20 μmol/L H2DCF-DA,3 ℃避光孵育45 min后,去除H2DCF-DA,用HBSS洗滌細胞。使用酶標儀通過測量二氯熒光素(激發波長480 nm,發射波長530 nm)的熒光測定ROS水平。
細胞內ROS的相對含量=正常組或實驗組熒光強度/LPS組熒光強度×100%
1.2.3? 總多酚含量測定? 不同提取物中總多酚含量采用福林酚氧化法[13]進行測定。波長765 nm處測其吸光度,以甲醇作為空白,根據吸光度與濃度對應關系繪制標準曲線。沒食子酸標準曲線為:沒食子酸濃度C=83.59×A765–1.2427,R2=0.9997。檳榔籽提取物溶解后,按照同樣方法反應后測定吸光度,總多酚含量以每克提取物中的沒食子酸當量計。
1.2.4? 總黃酮含量測定? 不同提取物中總黃酮含量采用亞硝酸鈉-硝酸鋁法[13]進行測定。反應結束后,在波長510 nm處測其吸光度,根據吸光度與蘆丁濃度對應關系繪制標準曲線。蘆丁的標準曲線為:蘆丁濃度C=201.82×A510–7.8036,R2= 0.9992。檳榔籽提取物溶解后,按照同樣方法反應后測定吸光度,總黃酮含量以每克提取物中的蘆丁當量計。
1.2.5? 原花青素含量測定? 不同提取物中原花青素含量采用香草醛-鹽酸法[14]進行測定。反應結束后,在波長510 nm處測定吸光度,根據吸光度與兒茶素濃度對應關系繪制標準曲線。兒茶素標準曲線為:兒茶素濃度C=182.83×A510–6.9417,R2=0.9967。檳榔籽提取物溶解后,按照同樣方法反應后測定吸光度,原花青素含量以每克提取物中的兒茶素當量計。
1.2.6? 類黃酮組分定性測定[15]? (1)EAC-ANE類黃酮提取。取10 mg EAC-ANE加入5 mL離心管,加入2000 μL提取液A(75%甲醇含1%乙酸)渦旋30 s后冰水浴超聲60 min后,12 000 r/min離心15 min;取1500 μL上清液氮氣吹干,加入1500 μL提取液B(50%甲醇含0.1%甲酸)復溶;渦旋30 s后冰水浴超聲15 min,12 000 r/min離心15 min;取上清于2 mL進樣瓶上機檢測。
(2)色譜條件。色譜柱為ACQUITY ULC BEH C18色譜柱(1.7 μm×21 mm×150 mm);柱溫箱溫度設為40 ℃,自動進樣器溫度設為8 ℃,進樣體積為2 μL。流動相A為0.1%甲酸水溶液,流動相B為100%乙腈;總流速為300 μL/min。流動相B梯度洗脫程序為:0~0.5 min,10%;0.5~15 min,60%;15.01~18.00 min,98%;18.01~ 20.00 min,10%。
(3)質譜參數。數據采集時,以多反應監測(MRM)模式進行質譜分析。離子源參數如下:離子噴霧電壓為+5000/–4500 V;氣簾氣壓力為35 psi;溫度為500 ℃;離子源氣體壓力1為55 psi;離子源氣體壓力2為60 psi。
1.3? 數據處理
使用SPSS 16.0軟件進行統計分析,化學實驗重復3次,細胞相關實驗至少重復5次,數據結果以平均值±標準偏差表示。組內比較采用單因素方差分析,組間比較采用t檢驗。
2? 結果與分析
2.1? 檳榔提取物的抗炎作用
2.1.1? 不同ANE提取部位對RAW264.7細胞活力的影響? 炎癥抑制作用篩選實驗之前,首先要篩選出對細胞沒有毒性作用的活性部位以及安全濃度。在前期預實驗基礎上,選取了0~200 μg/mL為不同提取物的實驗濃度范圍。不同質量濃度的ANE萃取部位或100 μg/mL的DEX作用RAW264.7細胞24 h后,檢測各細胞存活率,結果見圖1。與正常組相比,PE-ANE、EAC-ANE和BU-ANE在實驗濃度范圍內,對RAW264.7細胞存活率沒有顯著影響。在50~150 μg/mL時,W-ANE則可以顯著提高RAW264.7細胞存活率,這可能是由于水相中含有大量的水溶性營養物質,可以顯著促進細胞生長。
2.1.2? EAC-ANE對LPS誘導RAW264.7細胞產生NO的抑制作用? NO是免疫調節和炎癥介導中的關鍵因子,可以在多種參與免疫和炎癥的細胞中合成。小鼠巨噬細胞經過LPS刺激后,能夠表達一氧化氮合酶(NOS),促使細胞生成大量NO,進一步加劇炎癥反應[16]。設LPS組細胞產生的NO含量為100%,由圖2可知,正常的RAW264.7細胞可以產生一定的NO,經過LPS刺激后,繼續產生大量的NO。分別加入不同濃度的檳榔籽提取物萃取部位時,LPS誘導的巨噬細胞內NO含量分別隨PE-ANE、EAC-ANE和BU-ANE濃度的增加而逐漸減少,且具有濃度依賴性,其中EAC-ANE的抑制效果最好。當EAC- ANE濃度為200 μg/mL時,細胞內NO相對含量為LPS組的(59.93±1.13)%,而正常組產生的NO相對含量為(43.89±0.96)%。PE-ANE也具有一定的NO抑制能力,這可能是由于該部位具有一定的不飽和脂肪酸[17]和脂溶性活性物質。BU-ANE在測定濃度范圍內,也可以顯著降低NO的含量。W-ANE在50、100 μg/mL濃度時,可減少細胞分泌NO,但與LPS組相比,并無顯著性差異;當濃度繼續升高時,NO含量卻顯著升高,這可能是W-ANE同時含有抑制和促進NO生成的物質,
而當濃度升高時,對NO生成的促進作用更強一些。當DEX處理濃度為100 μg/mL時,LPS誘導的巨噬細胞產生NO的相對含量為(65.08±3.21)%。在濃度為0~200 μg/mL時,EAC- ANE具有更好的抗炎作用且安全,因此,選用該提取部位繼續進行實驗。
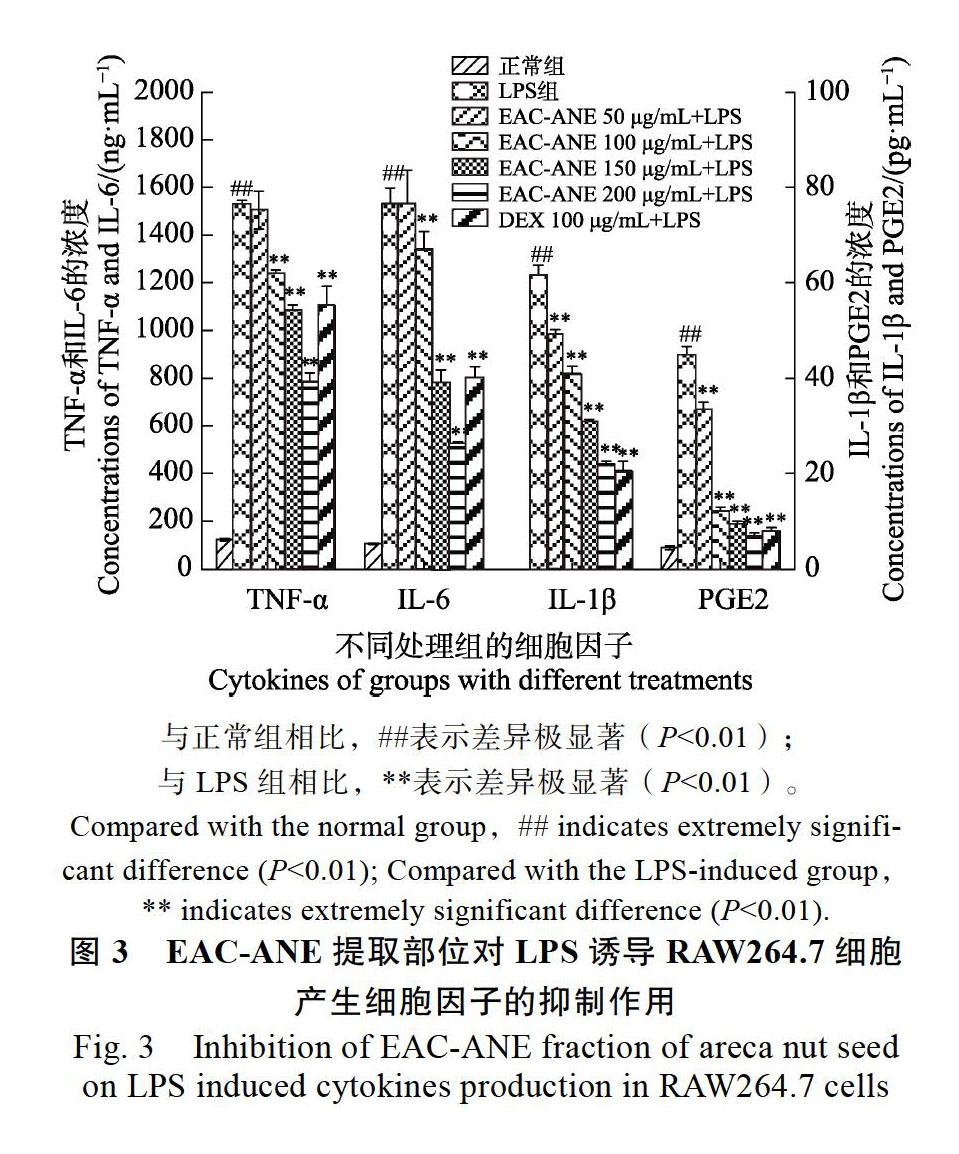
2.1.3? EAC-ANE對LPS誘導RAW264.7細胞產生細胞因子的抑制作用? RAW264.7細胞在LPS誘導下,釋放大量的促炎因子,如TNF-α、IL-1β和IL-6等,而這些促炎因子是引起炎癥發生發展的重要誘導劑和增強劑[18]。PGE2也是一種經典的炎性介質分子,廣泛分布于人體內的組織與器官,是一種具有生物學活性的重要的前列腺素物質,具有阻止血小板聚集、保護胃粘膜、擴張血管、參與全身的炎癥反應等功能。由圖3可以看出,EAC-ANE對LPS誘導RAW264.7細胞產生TNF-α、IL-1β、IL-6和PGE2具有抑制作用,且具有濃度依賴性。當濃度為50 μg/mL時,EAC-ANE對TNF-α和IL-6的抑制作用不顯著,隨著濃度增加,抑制作用越來越強,且顯著低于LPS組;當EAC-ANE濃度為50 μg/mL時,細胞分泌的IL-1β和PGE2已顯著低于LPS對照組。這說明,在實驗濃度范圍內,EAC-ANE可以抑制以上細胞因子,進而起到抗炎的作用。
2.1.4? EAC-ANE對LPS誘導RAW264.7細胞產生ROS的抑制作用? ROS是生物有氧代謝過程中的一種副產品,在細胞信號傳導和保持機體穩定性方面起著重要作用。研究表明,當炎癥發生時,隨著免疫細胞遷移并富集于感染部位,細胞吞噬作用的增強會導致呼吸爆發,經過一系列的反應,ROS大量積累,致使炎癥進一步惡化[19]。因此,細胞內ROS水平是評價炎癥進程的一個重要指標。由圖4可知,正常組細胞會產生一定量的ROS,但是當加入LPS刺激后,細胞的ROS產量顯著升高,當添加濃度為50 μg/mL時,EAC-ANE對ROS產生的抑制作用不顯著,隨著濃度增加,抑制作用越來越強,當添加濃度為100、150、200 μg/mL時,細胞的ROS相對含量均極顯著低于LPS組。EAC-ANE可以抑制LPS誘導RAW264.7細胞產生ROS,這可能與EAC-ANE具有良好的抗氧化活性有關。
2.2? 檳榔提取物活性物質測定
2.2.1? 不同檳榔提取部位的得率及總多酚、總黃酮和原花青素含量? 檳榔中含有多種酚類物質,包括縮合單寧、水解單寧、黃酮烷、類黃酮和簡單酚酸類物質。檳榔籽烘干后,測定其水分含量為(6.00±0.51)%。采用75%乙醇溶液制備提取物,得率為(23.60±0.15)%(表1)。PE-ANE、EAC-ANE、BU-ANE和W-ANE的得率分別為(18.82±0.14)%、(13.27±0.09)%、(36.06±0.20)%和(31.85±0.18)%,其中BU-ANE的得率最高,這可能是由于正丁醇極性適中,既能部分溶解小極性的物質,也能部分溶解極性稍大的物質。
各提取物中的總多酚含量由大至小順序為BU-ANE>EAC-ANE>W-ANE>EA-ANE>PE-ANE,其中BU-ANE中總多酚含量最大。各提取物中總黃酮含量大小順序為EAC-ANE>W-ANE> BU- ANE>EA-ANE>PE-ANE。但這與張丹等[20]報道的70%乙醇提取物乙酸乙酯萃取部位的總多酚和總黃酮含量均顯著高于正丁醇部位的研究結果有所不同。不同提取物中原花青素含量大小順序與總黃酮含量一致。另外,由于多酚、黃酮和原花青素3種活性物質的定量均采用化學方法,在反應過程中,一些化學物質的顯色效價要高于方法中采用的標準物質,這可能是BU-ANE和EAC-ANE中3種活性物質計算總和超過提取物總質量的原因之一。
2.2.2? EAC-ANE中類黃酮的相對含量? 液相色譜串聯質譜(LC-MS)技術具有高效靈敏、選擇性強且碎片離子重現性好等諸多優點,廣泛用于中藥和食品化學成分的定性和定量分析[21-23]。本實驗結合檳榔中已報道的特征化學物質,篩選了86種類黃酮作為標準品,對EAC-ANE中的類黃酮物質進行靶向定性鑒定。結果表明,從EAC- ANE中共鑒定出了76種類黃酮成分,表2列出了23種相對含量大于0.10%的類黃酮物質,其中兒茶素的含量最高,為58.35%,其次為L-表兒茶素、原花青素B1、原花青素B2、原兒茶酸、紅橘素、原兒茶醛等,這些物質均具有良好的體內外抗炎活性[24-28]。
3? 討論
炎癥是糖尿病、腫瘤、動脈粥樣硬化、類風濕關節炎等眾多疾病的病理過程,安全有效地抑制炎癥反應對于治療各種重大疾病具有積極意義。在一些東南亞國家的民間醫學中,檳榔常用于治療多種炎癥,如牙齦炎、結膜炎和水腫等[29]。目前,國內外研究者主要研究了檳榔不同提取物對體內炎癥的抑制作用。Khan等[10]制備了檳榔果70%甲醇提取物的三氯甲烷、正丁醇、二氯甲烷、乙酸乙酯和水相5個萃取部位,發現該檳榔水相部位和二氯甲烷部位均可以不同程度地抑制多種炎癥誘導劑(卡拉膠、花生四烯酸、5-羥色胺和PGE2)導致的足腫脹。Huang等[30]提取的臺灣檳榔籽原花青素可以抑制角叉菜膠誘導的氣囊炎大鼠體內環氧合酶-2(COX-2)蛋白的表達和PGE2的分泌,具有一定的抗炎作用。Bhandare等[31]的研究也證明了這一點。另外,檳榔籽多糖對LPS誘導的小鼠巨噬細胞產生NO具有一定的抑制作用[3]。
本研究結果表明,海南檳榔籽75%乙醇提取物的不同萃取部位都含有多酚、黃酮和原花青素,除了水相(W-ANE)以外,均可以一定程度上抑制LPS誘導RAW264.7細胞產生NO,其中以乙酸乙酯萃取部位(EAC-ANE)的作用最好。EAC-ANE中總多酚、總黃酮和原花青素的含量分別為(517.18±21.81)、(406.40±8.16)、(91.23±5.01) mg/g;BU-ANE中也含有大量的多酚類物質,但其中的總黃酮含量和原花青素含量卻比EAC-ANE低,這可能是造成二者抗炎作用差異的主要原因,也說明黃酮和原花青素可能是發揮抗炎作用的主要物質。Ho等[32]的研究也報道了這一點,他們發現龍眼花提取物對LPS誘導RAW264.7細胞炎癥的抑制作用是由黃酮類和原花青素類等共同作用的結果,活性優于單一的沒食子酸等酚類物質。EAC-ANE可以抑制LPS誘導RAW264.7細胞分泌炎癥因子(TNF-α、IL-6和IL-1β)和PGE2,同時可以顯著減少炎癥模型細胞中活性氧的含量。對于檳榔籽乙酸乙酯萃取部位抗炎作用的機制方面,還需要進一步研究,進而為檳榔藥用價值的綜合利用提供基礎數據。
參考文獻
[1]? Gupta A K, Tulsyan S, Thakur, et al. Chemistry, metabolism and pharmacology of carcinogenic alkaloids present in areca nut and factors affecting their concentration[J]. Regulatory Toxicology and Pharmacology, 2020, 110: 1-10.
[2]? Nonaka G, Hsu F, Ninshioka I. Structures of dimeric, trimeric, and tetrameric procyanidins from Areca catechu L.[J]. Journal of the Chemical Society Chemical Communications, 1981, 15: 781-783.
[3] 唐敏敏, 陳? 華, 李? 瑞. 響應面法優化超聲波提取檳榔多糖工藝及其抗炎活性[J]. 安徽農學通報, 2019, 25(9): 21-24, 74.
[4]? Tang M M, Chen H, Wang H, et al. Anti-fatigue effects of polyphenols extracted from Areca catechu L. husk and determination of the main components by high performance capillary electrophoresis[J]. Bangladesh Journal of Botany, 2016, 45: 783-790.
[5]? 李? 晨, 范堯夫, 呂? 濤, 等. 檳榔有效組分的提取分離及其對大鼠胃平滑肌收縮作用影響的研究[J]. 中醫學報, 2013, 28(5): 683-685.
[6]? 袁列江, 李忠海, 鄭錦星. 檳榔提取物對大白鼠血脂調節作用的研究[J]. 食品科技, 2009, 34(2): 188-192.
[7]? Khan S, Abbas G, Ahmed F, et al. Effect of dichloromethane fraction of Areca catechu nut on monoamines associated behaviors and tyramine pressor sensitivity in rodents[J]. Pakistan Journal of Pharmaceutical Sciences, 2014, 27: 303- 307.
[8]? Huang P L, Chi C W, Liu T Y. Areca nut procyanidins ameliorate streptozocin-induced hyperglycemia by regulating gluconeogenesis[J]. Food and Chemical Toxicology, 2013, 55: 137-143.
[9]? 石翠格, 胡? 剛, 汪? 海. 天然藥物檳榔堿對氧化低密度脂蛋白致血管內皮細胞損傷的保護作用研究[J]. 科學技術與工程, 2007, 7(12): 2780-2783.
[10]????? Khan S, Mehmood M H, Ali A N A, et al. Studies on anti- inflammatory and analgesic activities of betel nut in rodents[J]. Journal of Ethnopharmacology, 2011, 135(3): 654-661.
[11]????? Wang C C, Lin Y R, Liao M H, et al. Oral supplementation with areca-derived polyphenols attenuates food allergic responses in ovalbumin-sensitized mice[J]. BMC Complementary and Alternative Medicine, 2013, 13: 154.
[12]????? 宋? 菲, 張玉鋒, 郭玉如, 等. 檳榔提取物對α-葡萄糖苷酶的抑制作用研究[J]. 食品研究與開發, 2019, 40(13): 78-83.
[13]????? Kang W, Li C, Liu Y. Antioxidant phenolic compounds and flavonoids of Mitragyna rotundifolia (Roxb.) Kuntze in vitro[J]. Medicinal Chemistry Research, 2010, 19(9): 1222- 1232.
[14]????? 房一明, 初? 眾, 谷風林, 等. 響應面法優化海南可可豆中原花青素的提取工藝[J]. 熱帶作物學報, 2020, 41(4): 779-786.
[15]????? Lei Z, Sumner B W, Bhatia A, et al. UHPLC-MS analyses of plant flavonoids[J]. Current Protocols in Plant Biology, 2019, 4(1): e20085.
[16]????? Coleman J W. Nitric oxide in immunity and inflammation[J]. International Immunopharmacology, 2001, 1(8): 1397-1406.
[17]????? 辛曉晨, 裴志勝, 袁臘梅, 等. 響應面法優化超聲-微波協同萃取檳榔籽油及其脂肪酸組成分析[J]. 食品科學, 2012, 33(2): 67-71.
[18]????? Nguyen P H, Bingtian Z, Lee J, et al. Isolation of benzoic and cinnamic acid derivatives from the grains of Sorghum bicolor and their inhibition of lipopolysaccharide-induced nitric oxide production in RAW264.7 cells[J]. Food Chemistry, 2015, 168: 512-519.
[19]????? Ren J, Su D, Li L, et al. Anti-inflammatory effects of Aureusidin in LPS-stimulated RAW264. 7 macrophages via suppressing NF-κB and activating ROS- and MAPKs- dependent Nrf2/HO-1 signaling pathways[J]. Toxicology and Applied Pharmacology, 2020, 387: 114846.
[20]????? 張? 丹, 李? 丹, 許啟泰, 等. 檳榔提取物不同部位的抗氧化性比較及成分研究[J]. 食品工業科技, 2015, 36(2): 102-104, 109.
[21]????? Huo J H, Du X W, Sun G D, et al. Identification and characterization of major constituents in Juglans mandshurica using ultra performance liquid chromatography coupled with time-of-flight mass spectrometry (UPLC-ESI-Q-TOF/ MS)[J]. Chinese Journal of Natural Medicines, 2018, 16(7): 525-545.
[22]????? Chen L L, Chen C H, Zhang X X, et al. Identification of constituents in Gui-Zhi-Jia-Ge-Gen-Tang by LC-IT-MS combined with LC-Q-TOF-MS and elucidation of their metabolic networks in rat plasma after oral administration[J]. Chinese Journal of Natural Medicines, 2019, 17(11): 803- 821.
[23]????? Ekpo D E, Joshua P E, Ogidigo J O, et al. High resolution UPLC-PDA-QTOF-ESI-MS/MS analysis of the flavonoid-rich fraction of Lasianthera africana leaves, and in vivo evaluation of its renal and cardiac function effects[J]. Heliyon, 2020, 6(7): e04154.
[24]????? Bak M J, Truong V L, Kang H S, et al. Anti-inflammatory effect of procyanidins from wild grape (Vitis amurensis) seeds in LPS-induced RAW 264.7 cells[J]. Oxidative Medicine and Cellular Longevity, 2013, 2013: 409321.
[25]????? Trekli M, Buttle D, Guedon F. Anti-inflammatory actions of green tea catechins and ligands of peroxisome proliferator-activated receptors[J]. International Journal of Experimental Pathology, 2004, 85(4): A75-A75.
[26]????? Lende A B, Kshirsagar A D, Deshpande A D, et al. Anti-inflammatory and analgesic activity of protocatechuic acid in rats and mice[J]. Inflammopharmacology, 2011, 19(5): 255-263.
[27]????? Lee Y Y, Lee E, Park J, et al. Anti-inflammatory and antioxidant mechanism of tangeretin in activated microglia [J]. Journal of Neuroimmune Pharmacology, 2016, 11(2): 294-305.
[28]????? Chang Z, Gebru E, Lee S, et al. In vitro antioxidant and anti-inflammatory activities of protocatechualdehyde isolated from Phellinus gilvus[J]. Journal of Nutritional Science and Vitaminology, 2011, 57(1): 118-22.
[29]????? Nadkarni K M, Nadkarni A K. Indian materia medica[M]. Bombay: Popular prakashan, 1976.
[30]????? Huang P L, Chi C W, Liu Y. Effects of Areca catechu L. containing procyanidins on cyclooxygenase-2 expression in vitro and in vivo[J]. Food and Chemical Toxicology, 2009, 48: 306-313.
[31]????? Bhandare A M, Kshirsagar A D, Vyawahare N S, et al. Potential analgesic, anti-inflammatory and antioxidant activities of hydroalcoholic extract of Areca catechu L. nut[J]. Food and Chemical Toxicology, 2010, 48(12): 3412- 3417.
[32]????? Ho S C, Hwang L S, Shen Y J, et al. Suppressive effect of a proanthocyanidin-rich extract from longan (Dimocarpus longan Lour.) flowers on nitric oxide production in LPS-stimulated macrophage cells[J]. Journal of Agricultural and Food Chemistry, 2007, 55(26): 10664-10670.
責任編輯:崔麗虹

