中國急性胰腺炎臨床研究注冊的現狀分析
姜嬌 蔣鑫 曾馨儀 夏慧芳 彭燕 呂沐瀚 湯小偉
西南醫科大學附屬醫院消化內科,瀘州 646000
臨床試驗是解決AP臨床問題的有力研究工具,其中隨機對照試驗(randomized controlled trial, RCT)更是能為臨床決策提供最高質量的證據[1]。臨床試驗注冊是臨床試驗透明、規范的重要措施[2]。國際醫學期刊編輯委員會(International Committee of Medical Journal Editors,ICMJE)宣布從2005年7月1日起,其成員期刊只發表已在公共臨床試驗注冊機構注冊的臨床試驗結果報告[3]。2006年5月正式啟動的國際臨床試驗注冊平臺(International Clinical Trials Registry Platform,ICTRP)是實現臨床試驗透明化和提高臨床試驗質量的全球性舉措[4]。早在1997年由美國國立衛生研究院(National Institutes of Health, NIH)聯合美國食品藥品監督管理局建立的ClinicalTrials.gov平臺符合ICMJE標準,是目前全球最大的臨床試驗注冊平臺[5-6]。2007年7月25日,中國臨床試驗注冊中心(Chinese Clinical Trial Registry,ChiCTR)成為第二批WHO ICTRP認證的一級注冊機構。基于ChiCTR或ClinicalTrials.gov數據庫的臨床試驗注冊狀況的調查已頗多,如關于糖尿病、高血壓和放射治療等臨床試驗注冊狀況分析[7-8],但尚無關于AP臨床研究注冊狀況的相關報道。本研究基于ChiCTR和ClinicalTrials.gov數據庫,對AP相關臨床研究的注冊內容進行分析,以探討中國AP相關臨床研究注冊的現狀和發展趨勢。
資料與方法
一、納入標準
收集所有注冊于ChiCTR數據庫內與AP相關且已獲得倫理委員會批準并已上傳倫理審批文件、不論采用何種設計或是否已完成的臨床研究;收集所有注冊于ClinicalTrials.gov數據庫內與AP相關且研究實施地在中國的臨床研究。
二、檢索方法
在“注冊題目”欄輸入“急性胰腺炎”檢索ChiCTR數據庫,“獲倫理委員會批準”一欄選擇“是或yes”,注冊狀態不限;在“疾病或狀態”欄輸入“acute pancreatitis”檢索ClinicalTrials.gov數據庫,其余選項不設限制。臨床研究的注冊時間均為建庫至2020年12月31日。
三、資料提取
由2名研究者獨立檢索數據庫、提取資料并交叉核對。如有分歧,則通過討論或與第三方協商解決。資料提取內容包括(1)注冊研究的基本信息:研究題目、注冊時間、注冊狀態、注冊人或組長所在單位及地區;(2)注冊研究的設計信息:研究類型、研究設計、所處階段、樣本量、國內或國外以及單中心或多中心數量、征募研究對象情況、盲法和隨機方法;(3)其他:經費來源和有無數據管理委員會。
四、統計學處理
采用Excel軟件收集和整理資料,采用SPSS20.0軟件進行統計分析。計數資料采用頻數、構成比或百分率(%)表示。采用χ2檢驗比較分類變量,根據不同χ2檢驗的應用條件,選擇對應的統計量和概率P值。P<0.05為差異有統計學意義。
結 果
一、篩選流程及資料基本特征
檢索ChiCTR和ClinicalTrials.gov數據庫后分別獲取105項和236項中國AP相關臨床研究。逐條查看注冊時間及內容后,ChiCTR數據庫刪除5項注冊時間不符合納入標準、1項未上傳倫理批件,最終納入99項研究;ClinicalTrials.gov數據庫刪除2項非AP相關研究、176項不在中國實施的研究,最終納入58項研究。兩個數據庫共納入157項注冊的臨床研究,其中預注冊113項,補注冊44項。
ChiCTR數據庫中單中心86項,多中心13項;ClinicalTrials.gov數據庫中單中心48項,多中心10項。ChiCTR數據庫中征募研究對象情況尚未開始的有28項,正在進行42項,已結束29項;ClinicalTrials.gov數據庫正在招募4項,已完成16項,未知狀態33項,其他招募情況5項。157項注冊臨床研究中有數據管理委員會67項,暫未確定73項,無數據管理委員會17項。
二、歷年注冊試驗數量分布
ChiCTR自2007年建庫后,于2009年出現首個AP注冊臨床研究,到2013年達到13項,2018年進入上升期,到2020年達18項,注冊數量整體呈上升趨勢。在ClinicalTrials.gov數據庫上注冊的中國AP臨床研究數量在2017年前的增長趨勢與ChiCTR相似,自2017年后,ClinicalTrials.gov數據庫中的注冊研究數量明顯少于ChiCTR(圖1)。
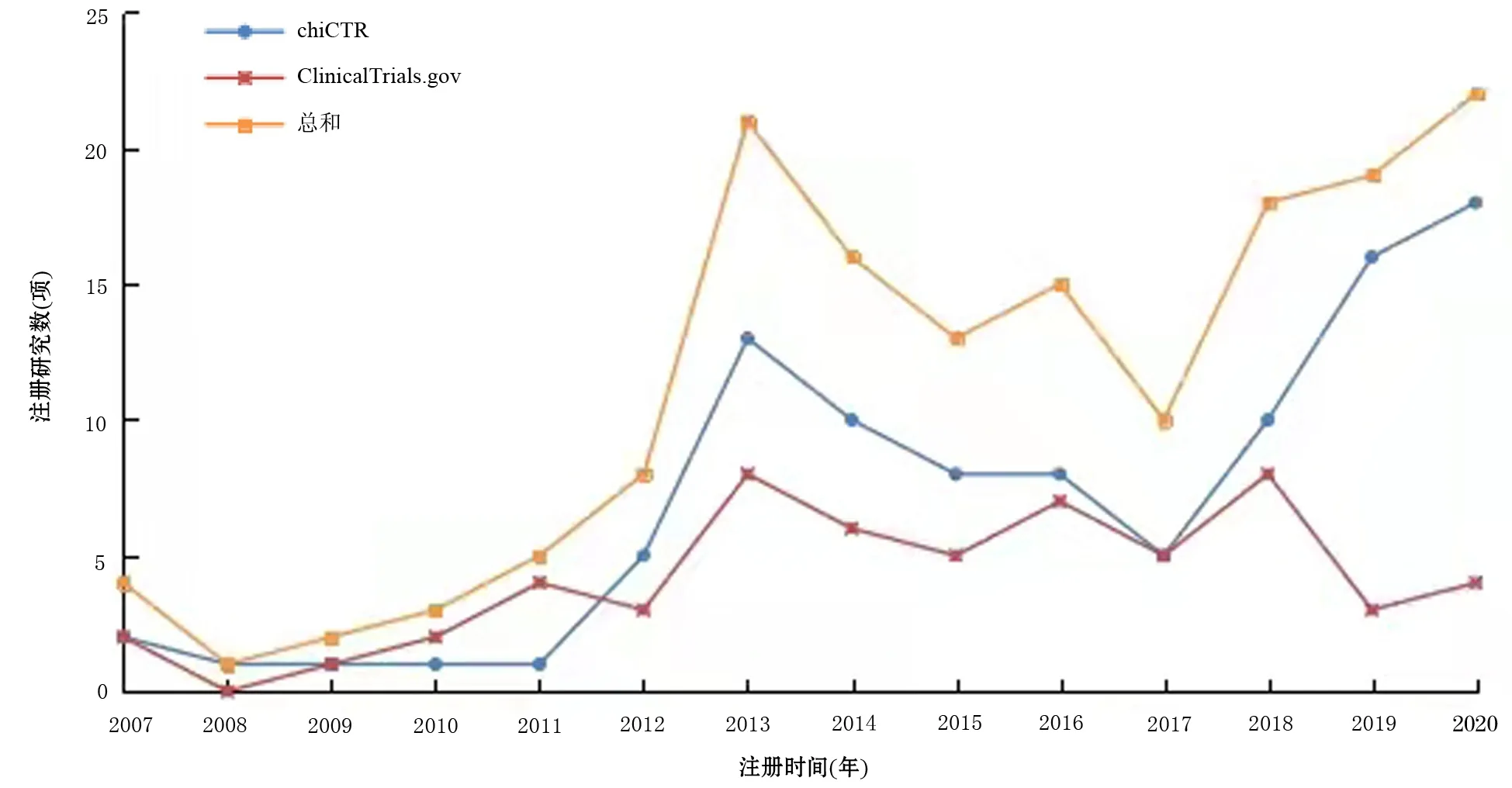
圖1 中國急性胰腺炎臨床試驗注冊數量
三、注冊地區及主要負責單位
157項注冊的AP臨床研究分布在全國20個省、直轄市、自治區。注冊項目數≥10項的地區分別是四川省(44項)、上海市(23項)、江蘇省(19項)、江西省(14項)和浙江省(10項),其中前3位地區共占注冊研究總數量的54.8%(圖2)。研究實施負責(組長)單位共45家,注冊項目數≥10項的研究單位共4個,分別是四川大學華西醫院、南昌大學第一附屬醫院、東部戰區總醫院、海軍軍醫大學第一附屬醫院,四川大學華西醫院注冊數量最多,占20.4%(表1)。
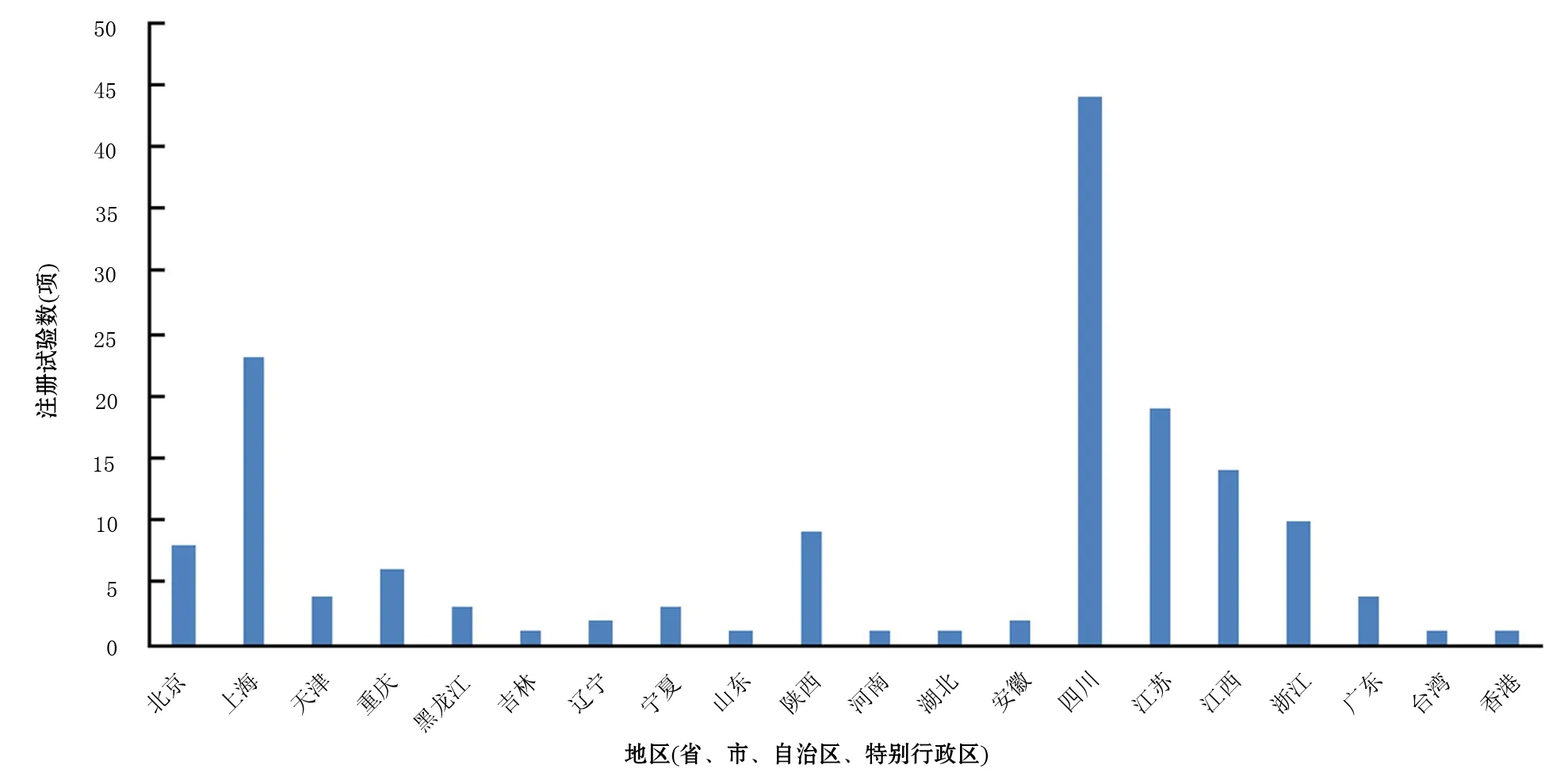
圖2 中國急性胰腺炎臨床試驗地區分布
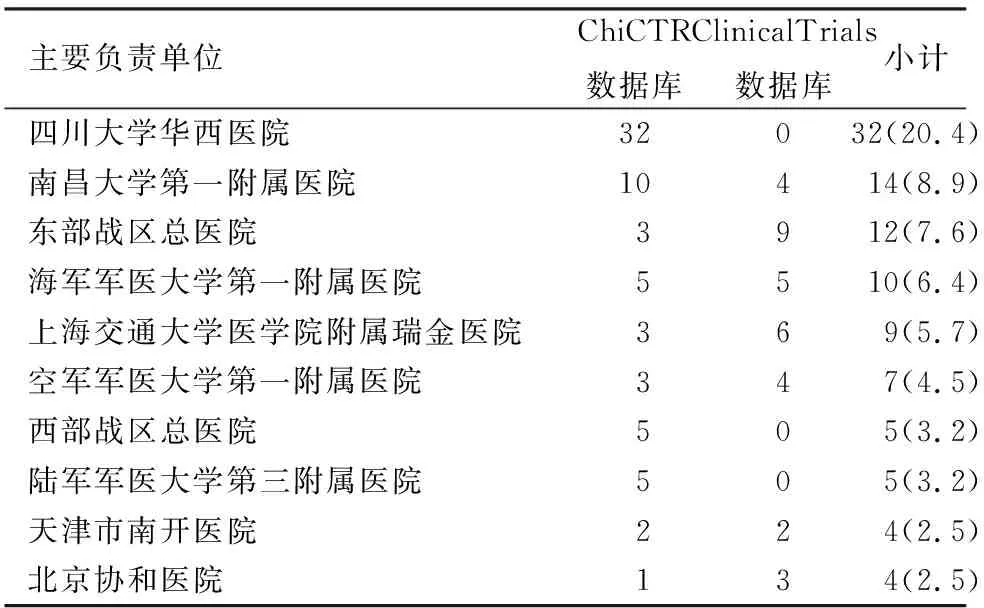
表1 中國急性胰腺炎臨床試驗的主要負責單位與注冊試驗數量[項(%)]
四、研究設計情況
157項注冊的AP臨床研究中干預性研究91項,觀察性研究41項,其他類型25項,包括病因學或相關因素研究、診斷試驗、基礎科學研究、流行病學研究、預防性研究和治療研究(表2)。研究類型以RCT為主,共84項(53.5%),其次為隊列研究,共17項(10.8%)。
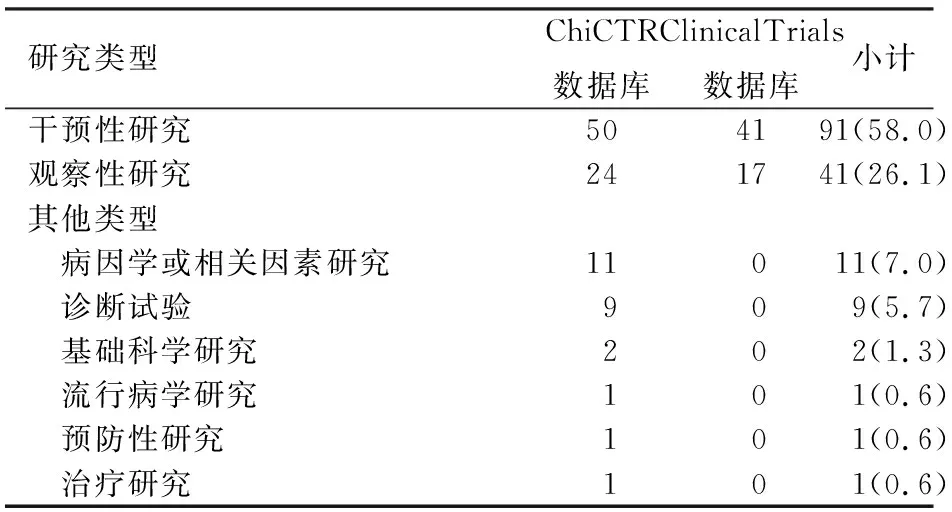
表2 157項中國急性胰腺炎注冊臨床試驗的研究類型[項(%)]
ChiCTR數據庫獲得的50項干預性研究中49項(98%)為RCT,1項本屬于觀察性研究類型的橫斷面研究被錯選填為干預性研究。盲法使用情況:未使用盲法5項,未說明34項,使用盲法11項(22%),其中6項提到了對何者使用盲法。50項(100%)均采用隨機分組,多數隨機序列產生方法僅簡單描述為“隨機數字表”,僅4項提及分配序列隱藏。ClinicalTrials.gov數據庫獲得的41項干預性研究中35項(85.4%)為RCT,單臂4項,交叉對照1項,非RCT 1項。盲法使用情況:未使用盲法18項,使用盲法23項(56.1%),均說明了對何者采取盲法。38項(92.7%)采用隨機分組,未對隨機分配序列的產生及隱藏方法進行描述。
ChiCTR數據庫獲得的24項觀察性研究中隊列研究7項(29.2%),連續入組6項,11項(45.8%)本屬于干預性研究的設計類型(析因分組5項、單臂4項、非RCT 2項)被錯選填為觀察性研究。ClinicalTrials.gov數據庫獲得的17項觀察性研究中病例對照研究8項,隊列研究6項,單純病例研究1項、信息丟失1項、其他1項。
ChiCTR數據庫中臨床研究所處的階段分別為預試驗17項(10.8%),Ⅰ期臨床試驗6項(3.8%),Ⅳ期18項(11.5%),其他或未知58項(36.9%),無Ⅱ、Ⅲ期臨床試驗注冊。ClinicalTrials.gov數據庫中Ⅳ期12項(7.6%),其他或未知36項(22.9%),另有少數Ⅰ期(3項)、Ⅰ或Ⅱ期(2項)、Ⅱ期(1項)、Ⅱ或Ⅲ期(2項)、Ⅲ期(2項)。兩數據庫所注冊的臨床研究以Ⅳ期臨床試驗(30項,19.1%)、其他或未知(94項,59.9%)為主。
納入的157項注冊臨床研究中3項未說明樣本量,18項樣本量1~50,39項樣本量51~100,42項樣本量101~200,31項樣本量201~500,24項樣本量>500。樣本量>100的注冊研究共97項,占總注冊試驗數的61.8%。
五、經費來源情況
ChiCTR數據庫中獲得經費資助的注冊臨床研究92項(92.9%),根據經費來源分為自籌(48項)、企業資助(制藥公司或企業5項)、公共經費(國家財政20項、地方財政16項、社會公益基金2項)、其他(1項)。ClinicalTrials.gov數據庫中將經費來源分為美國國立衛生研究院、美國聯邦機構、公司或企業以及其他,檢索到的58項注冊臨床研究中1項被標注為由公司或企業資助,其余研究資助來源被標注為其他。
六、分組比較
根據注冊時間將注冊臨床研究分為2007-2014年組、2015-2020年組。2007-2014年組注冊試驗60項,傾向于采用隨機平行對照試驗設計(68.3%比45.4%,P=0.005)和隨機化分組(76.7%比47.4%,P=0.001),2015-2020年組97項,傾向于較大樣本量(72.6%比47.4%,P=0.002)和有數據管理委員會(53.6%至25.0%,P=0.001),兩組間差異均有統計學意義,而是否多中心、盲法和注冊狀態等方面的差異均無統計學意義(表3)。
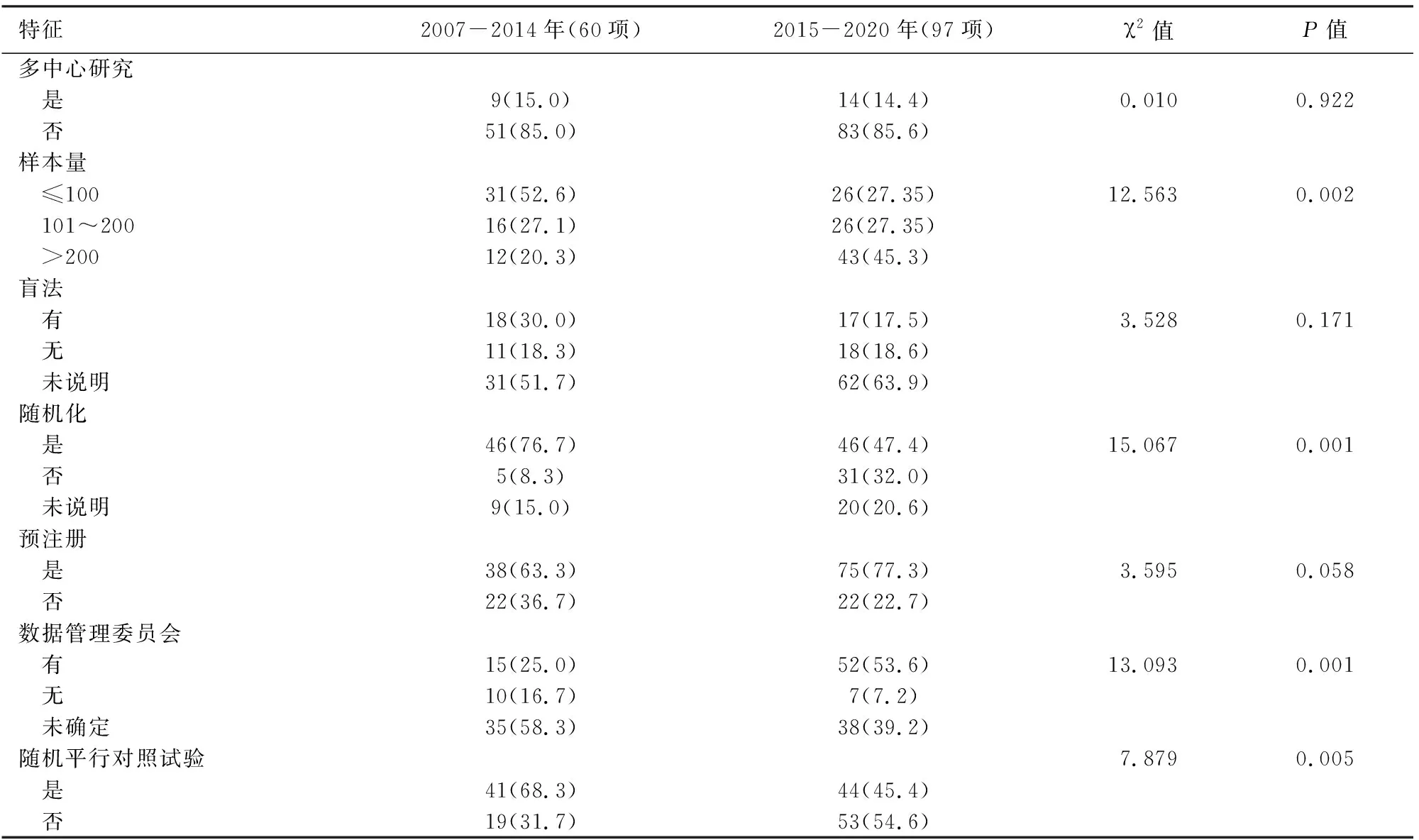
表3 不同注冊年份的中國急性胰腺炎臨床試驗特征比較[項(%)]
ChiCTR數據庫中自籌、企業、公共3組經費來源的注冊研究在是否多中心、樣本量、盲法和隨機化方面的差異均無統計學意義(表4)。由于Clinical-Trials.gov數據庫中無法獲得中國AP注冊臨床研究的經費確切來源,故未能對其進行分組比較。
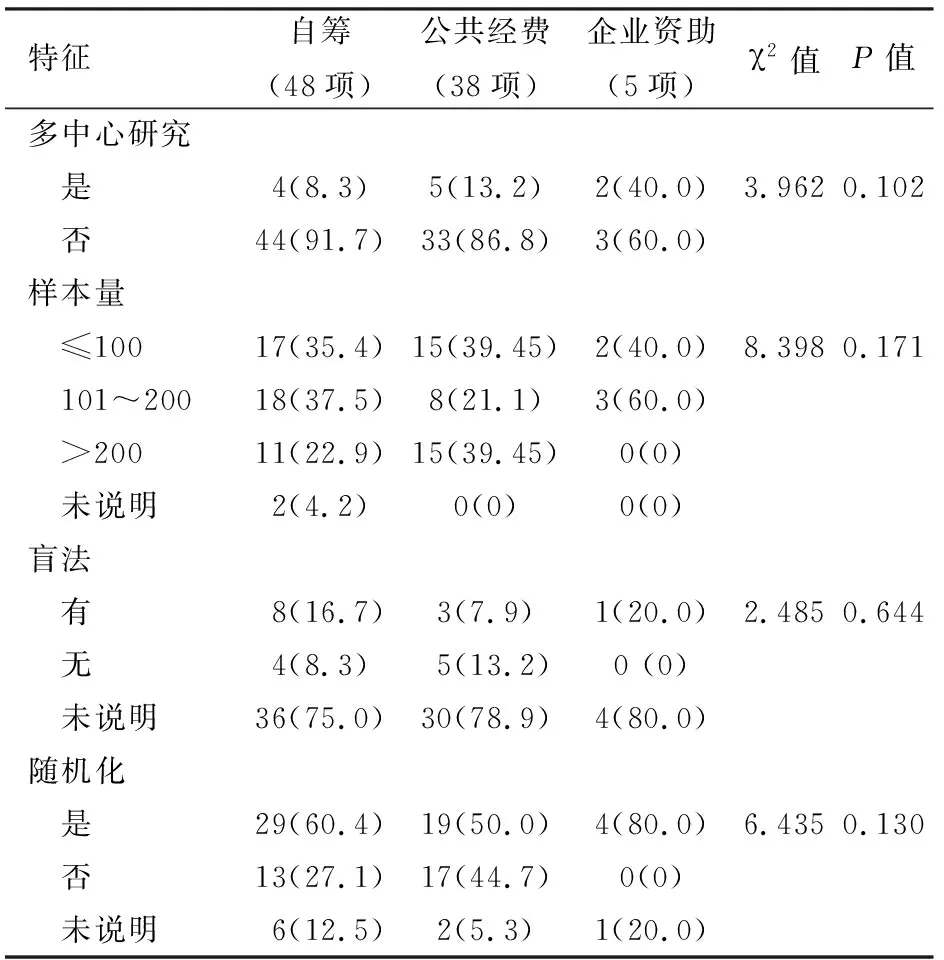
表4 不同經費來源的中國急性胰腺炎臨床試驗特征比較[項(%)]
討 論
近幾年我國臨床試驗注冊數量雖出現大幅度增長,但總體的臨床試驗注冊率仍遠低于發達國家。截止2020年12月31日,共有157項AP相關臨床研究在ChiCTR與ClinicalTrials.gov數據庫上注冊,遠低于已收錄在中國知網、萬方等數據庫中的AP臨床研究數量,主要原因是目前我國中文醫學期刊未實行“不發表未經注冊的臨床研究結果”這一政策[9]。
本研究結果顯示,中國AP臨床研究注冊數量整體隨時間呈增長趨勢,ChiCTR與ClinicalTrials.gov數據庫中注冊的研究數量變化趨勢較為一致,不同之處在于ChiCTR數據庫中的AP臨床研究注冊數量在2017年之后快速增長,而ClinicalTrials.gov數據庫中的中國AP臨床研究注冊數量在2017年之后維持在較低水平甚至略有下降。原因一方面是由于研究數量的增加和注冊意識的提高,另一方面可能是根據實施地注冊原則,美國ClinicalTrials.gov在2017年時回復了多封來自中國學者的申請注冊郵件,告知其根據實施地注冊原則,應考慮在ChiCTR上注冊[10-14]。ICMJE要求臨床試驗應在招募受試者之前完成注冊,但注冊的AP臨床研究中,仍有44項(28.0%)臨床研究為補注冊,可能原因是一些研究者錯誤理解臨床研究注冊的目的,認為注冊只是為了順利發表文章,在向國際醫學期刊投稿后才知道需要進行臨床試驗注冊,最終導致補注冊[3,14]。數據質量既能反映臨床試驗的設計水平,也能反映臨床試驗的管理水平[11]。有學者認為,研究者對數據管理缺乏了解是導致臨床試驗質量較低的主要原因之一[12]。從2016年3月14日起,ChiCTR要求注冊時必須提供數據管理信息,其中包括是否建立完備的數據管理委員會,這可以解釋在2015年至2020年注冊的臨床研究中具備數據管理委員會的占比更多,但總注冊研究中具備數據管理委員會的仍然較少,僅有67項(42.7%)。
我國AP相關臨床研究的注冊情況存在較大的地區不均衡性,注冊數量位于前5位的地區多為經濟發達的省(市)。注冊數量較多的單位包括四川大學華西醫院、南昌大學第一附屬醫院、東部戰區總醫院、海軍軍醫大學第一附屬醫院、上海交通大學醫學院附屬瑞金醫院、空軍軍醫大學第一附屬醫院。可能的原因應考慮到上述醫院的綜合實力較強,屬于國內大型的AP診治中心,AP診療的水平較高。
在循證醫學領域中,RCT提供的證據質量等級最高,但現實實踐中的RCT常常是不規范注冊和實施的。就盲法和隨機化而言,本研究納入的157項注冊的AP臨床試驗中研究設計以RCT為主,共84項,其中使用盲法的僅34項(40.5%)。ChiCTR數據庫中有5項模糊地將盲法使用情況描述為“單盲”、“雙盲”等,未提及對何者采用盲法。ChiCTR數據庫中雖然有50項注冊的RCT全部說明是隨機化分組,但存在假隨機、隨機序列產生和分配序列隱藏方法說明不充分的情況。多數隨機序列產生方法僅簡單描述為“隨機數字表”,僅4項提及分配序列隱藏方法。有研究表明,對盲法、隨機序列產生、分配序列隱藏的說明不清晰或不充分會夸大干預效果,比值比分別為0.87、0.89、0.93[13-14]。在注冊項目時,部分研究者對概念理解有偏差,ChiCTR數據庫注冊的99項臨床試驗中有12項關于研究設計選填錯誤,例如橫斷面研究本屬于觀察性研究設計類型,注冊者卻認為其屬于干預性研究設計類型;析因分組、單臂、非隨機對照試驗本屬于干預性研究設計類型,注冊者卻認為其屬于觀察性研究設計類型[15]。在ClinicalTrials.gov數據庫中有2項注冊的臨床研究的研究設計是單臂,注冊者卻標明了采取隨機化。中國正在經歷著從無注冊觀念到觀念建立,再到規范、嚴謹的注冊之中[16]。
本研究納入的注冊試驗中絕大多數由非營利性機構資助,由制藥企業資助的注冊試驗僅6項。雖然不同經費來源的試驗都有可能出現誤差,但經費來源于制藥企業的試驗有更大的發表偏倚,因為利益關聯普遍存在于研究者、學術機構和企業之間[17]。因此全面收集基金資助的完整信息利于反映試驗的真實信息、鑒別發表偏倚[18]。研究者在注冊時應完整規范地填寫基金項目名稱或經費確切來源。在2015年至2020年注冊的隨機對照試驗數多于2007年至2014年,但占比較少,可能是由于越來越多的非干預性研究在ChiCTR和ClinicalTrials.gov數據庫上注冊。樣本量越大,檢驗效能越高,試驗結果的可靠程度越高。2015年至2020年時間段的隨機對照試驗數占比較前一時間段減少,因此傾向于更大樣本量,以提高試驗結果的真實性。
本研究僅納入在ChiCTR和ClinicalTrials.gov數據庫上注冊的AP臨床研究,未考慮在其他注冊平臺注冊的在我國開展的AP臨床研究和未注冊的臨床研究,不能代表我國AP臨床研究的整體水平。
綜上所述,注冊的中國AP臨床研究數量整體隨時間呈上升趨勢,研究的經費來源以自籌和公共財政為主,Ⅱ、Ⅲ期臨床試驗仍較為缺乏。
利益沖突所有作者均聲明不存在利益沖突

