海德堡三角清掃在腹腔鏡胰十二指腸切除術(shù)治療胰腺癌中的近期療效
王振勇 孟宇 李金超 張雷 石亮 劉汝海 李鳳山
河北省滄州市中心醫(yī)院肝膽胰外一科,滄州 061000
胰腺癌是惡性程度極高的消化道惡性腫瘤,發(fā)病率呈快速上升趨勢(shì)[1]。目前手術(shù)切除仍然是胰腺癌患者唯一可能治愈的手段。隨著微創(chuàng)技術(shù)的發(fā)展和手術(shù)技術(shù)的提高,腹腔鏡胰十二指腸切除術(shù)(laparoscopic pancreaticoduodenectomy, LPD)治療胰腺癌的有效性和安全性得到廣泛認(rèn)可[2-3]。胰腺癌術(shù)后復(fù)發(fā)嚴(yán)重影響患者長(zhǎng)期預(yù)后,而海德堡三角區(qū)域是局部復(fù)發(fā)的主要部位[4]。目前腹腔鏡清掃海德堡三角能否使患者獲益有待進(jìn)一步研究。本研究通過比較LPD術(shù)中分別行海德堡三角清掃和常規(guī)淋巴結(jié)清掃的臨床療效,探討LPD術(shù)中清掃海德堡三角的近期療效及意義。
資料與方法
一、一般資料
回顧性分析2015年7月至2020年9月間滄州市中心醫(yī)院肝膽胰外科84例行胰頭癌LPD患者的臨床資料,其中男性54例,女性30歲;年齡38~76(59±9)歲。根據(jù)手術(shù)情況分為海德堡組(39例)和對(duì)照組(45例)。對(duì)照組為常規(guī)淋巴結(jié)清掃,范圍為幽門上下淋巴結(jié)、肝總動(dòng)脈前方淋巴結(jié)、肝十二指腸韌帶淋巴結(jié)、胰十二指腸背側(cè)上下緣淋巴結(jié)、腸系膜上動(dòng)脈右側(cè)淋巴結(jié)、胰十二指腸腹側(cè)上下緣淋巴結(jié)。海德堡組在常規(guī)淋巴結(jié)清掃基礎(chǔ)上清掃海德堡三角區(qū)域內(nèi)的所有淋巴結(jié)、血管及神經(jīng)組織。記錄患者的性別,年齡,體重指數(shù),術(shù)前血膽紅素、白蛋白、CA19-9水平,國際標(biāo)準(zhǔn)化比值(international normalized ratio, INR),美國麻醉醫(yī)師協(xié)會(huì)(American Society of Anesthesiologists, ASA)分級(jí)。本研究通過醫(yī)院倫理委員會(huì)批準(zhǔn),患者及家屬均簽署知情同意書。
二、納入標(biāo)準(zhǔn)和排除標(biāo)準(zhǔn)
納入標(biāo)準(zhǔn):(1)依據(jù)術(shù)前癥狀、體征及相關(guān)輔助檢查診斷為胰頭癌;(2)術(shù)后病理明確診斷為胰頭導(dǎo)管腺癌;(3)無腸系膜上血管、門靜脈、下腔靜脈等侵犯,無需聯(lián)合血管和(或)器官切除;(4)無腫瘤遠(yuǎn)處轉(zhuǎn)移征象;(5)采用Child消化道重建吻合;(6)圍手術(shù)期資料完整,數(shù)據(jù)有效。
排除標(biāo)準(zhǔn):(1)術(shù)中探查見腸系膜上靜脈、門靜脈或其他重要血管及臟器受侵犯;(2)術(shù)中探查見遠(yuǎn)處轉(zhuǎn)移,僅行姑息性手術(shù);(3)LPD中轉(zhuǎn)開腹;(4)術(shù)后康復(fù)前轉(zhuǎn)院。
三、手術(shù)方法
患者取仰臥分腿位,氣管插管靜脈復(fù)合麻醉。建立人工氣腹,維持12 mmHg(1 mmHg=0.133 Kpa)氣腹壓。臍下穿刺孔留置10 mm Trocar作為觀察孔并置入腹腔鏡,右側(cè)鎖骨中線臍上水平及右側(cè)肋緣下腋前線交匯點(diǎn)分別置入12、5 mm Trocar 作為術(shù)者主操作孔、輔助操作孔,左側(cè)鎖骨中線臍上水平及左側(cè)肋緣下腋前線交匯點(diǎn)分別置入5、12 mm Trocar,均作為助手操作孔。首先進(jìn)行全面探查,確認(rèn)腫瘤可切除性。以超聲刀打開胃結(jié)腸韌帶,探查腫瘤粘連范圍及血管和鄰近臟器侵犯情況,明確腫瘤可切除后行根治性LPD。切除范圍包括遠(yuǎn)端胃的1/3~1/2、膽總管全段和膽囊、胰頭、十二指腸全部、近段15 cm的空腸。對(duì)照組淋巴結(jié)清掃范圍參照中華人民共和國國家衛(wèi)生健康委員會(huì)制定的《胰腺癌診療規(guī)范(2018年版)》[5]。海德堡三角組清掃范圍為在對(duì)照組清掃范圍的基礎(chǔ)上,清掃腸系膜上動(dòng)脈、肝總動(dòng)脈與腸系膜上靜脈、門靜脈組成的三角形區(qū)域內(nèi)的所有血管、淋巴組織及神經(jīng)組織(圖1)。

圖1 海德堡三角示意圖(1A)及腹腔鏡胰十二指腸切除術(shù)中海德堡三角區(qū)域清掃范圍(1B)
消化道重建順序均采用Child法。胰腸吻合采用改良雙針胰腸吻合法[6]:胰管插入粗細(xì)合適的支撐管,使用4-0可吸收線固定;于空腸袢對(duì)系膜緣處打孔,孔徑以可置入支撐管即可;應(yīng)用4-0 prolene線連續(xù)縫合空腸漿肌層與胰腺背側(cè)3針;空腸孔周圍縫以4-0可吸收線縫荷包,置入胰管支撐管遠(yuǎn)端,收緊荷包縫線并打結(jié);使用原雙針于空腸孔周圍各縫合2針,其中1針于胰腺腹側(cè)穿出,收緊兩線并打結(jié);應(yīng)用4-0 prolene線于胰腺上下緣分別行“8”字或間斷縫合,以加固吻合口。膽腸吻合口前壁及后壁采用連續(xù)縫合。
四、觀察指標(biāo)和診斷標(biāo)準(zhǔn)
觀察指標(biāo)包括手術(shù)相關(guān)指標(biāo)(手術(shù)時(shí)間、術(shù)中出血量、術(shù)中是否輸血、術(shù)后進(jìn)食時(shí)間及住院時(shí)間)、術(shù)后并發(fā)癥(胰瘺、膽瘺、淋巴瘺、出血及胃排空障礙)及術(shù)后病理學(xué)檢查結(jié)果(手術(shù)切緣、分化程度、腫瘤大小、神經(jīng)侵犯、淋巴結(jié)清掃數(shù)目、淋巴結(jié)轉(zhuǎn)移及TNM分期)。切除標(biāo)本經(jīng)甲醛液固定后測(cè)量胰腺切緣,切緣距離標(biāo)準(zhǔn)參照文獻(xiàn)[7],并常規(guī)行病理組織學(xué)檢查。
胰瘺的診斷采用國際胰瘺研究組2016年標(biāo)準(zhǔn)[8]。術(shù)后膽瘺、淋巴瘺、出血及胃排空障礙的診斷采用中華醫(yī)學(xué)會(huì)外科學(xué)分會(huì)胰腺外科學(xué)組的胰腺術(shù)后外科常見并發(fā)癥診治及預(yù)防的專家共識(shí)[9]。
五、統(tǒng)計(jì)學(xué)處理
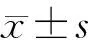
結(jié) 果
一、患者一般情況
海德堡組和對(duì)照組患者的性別、年齡、體重指數(shù)及術(shù)前血膽紅素、白蛋白、CA19-9水平和INR、ASA分級(jí)的差異均無統(tǒng)計(jì)學(xué)意義(P值均>0.05),具有可比性(表1)。

表1 海德堡組和對(duì)照組患者術(shù)前臨床資料的比較
二、手術(shù)相關(guān)指標(biāo)比較
海德堡組患者手術(shù)時(shí)間顯著長(zhǎng)于對(duì)照組,差異有統(tǒng)計(jì)學(xué)意義,但兩組術(shù)中出血量、術(shù)中輸血例數(shù)及術(shù)后進(jìn)食時(shí)間、住院時(shí)間的差異均無統(tǒng)計(jì)學(xué)意義(表2)。

表2 海德堡組和對(duì)照組患者手術(shù)相關(guān)指標(biāo)比較
三、術(shù)后并發(fā)癥比較
海德堡組中14例患者出現(xiàn)術(shù)后并發(fā)癥,對(duì)照組中11例出現(xiàn)術(shù)后并發(fā)癥,總并發(fā)癥發(fā)生率的差異無統(tǒng)計(jì)學(xué)意義。其中兩組胰瘺、膽瘺、出血及胃排空障礙發(fā)生率的差異無統(tǒng)計(jì)學(xué)意義,而海德堡組淋巴瘺發(fā)生率顯著高于對(duì)照組,差異有統(tǒng)計(jì)學(xué)意義(15.4%比2.2%,P<0.05,表3)。所有淋巴瘺患者均通過腹腔引流、營養(yǎng)支持、應(yīng)用生長(zhǎng)抑素等非手術(shù)治療后痊愈。海德堡組1例術(shù)后發(fā)生C級(jí)胰瘺,導(dǎo)致胃十二指腸動(dòng)脈殘端出血,再次手術(shù)縫合胃十二指腸動(dòng)脈殘端,切除殘胰;其余胰瘺患者均經(jīng)腹腔引流、抗感染等治療措施后痊愈。海德堡組2例發(fā)生腹腔出血、1例消化道出血,對(duì)照組2例發(fā)生消化道出血。除上述再次手術(shù)患者,其他患者均經(jīng)非手術(shù)治療后痊愈。所有膽瘺患者經(jīng)加強(qiáng)抗感染、保持腹腔引流或穿刺置管引流等治療后痊愈。胃排空障礙患者經(jīng)過禁食水、胃腸減壓、促胃動(dòng)力等治療后痊愈。

表3 海德堡組和對(duì)照組患者術(shù)后并發(fā)癥發(fā)生率比較(例,%)
四、術(shù)后病理學(xué)參數(shù)比較
海德堡組和對(duì)照組手術(shù)切緣>1 mm的患者分別為30例(76.9%)和24例(53.3%),淋巴結(jié)清掃總數(shù)分別為(11.31±2.46)枚和(9.49±2.28)枚,兩組差異均有統(tǒng)計(jì)學(xué)意義(P值均<0.05)。但兩組腫瘤分化程度、腫瘤大小、神經(jīng)侵犯、淋巴結(jié)轉(zhuǎn)移及TNM分期等參數(shù)的差異均無統(tǒng)計(jì)學(xué)意義(表4)。

表4 海德堡組和對(duì)照組患者術(shù)后病理學(xué)參數(shù)比較
討 論
盡管胰腺癌的治療理念和手術(shù)方式不斷更新,但患者的預(yù)后大多沒有得到明顯的改善,其診治現(xiàn)狀仍不樂觀。術(shù)后復(fù)發(fā)轉(zhuǎn)移是影響手術(shù)治療效果的關(guān)鍵因素。即使是接受了根治性手術(shù)的患者,術(shù)后復(fù)發(fā)轉(zhuǎn)移的概率仍然達(dá)到50%~90%[4,10]。雖然有研究認(rèn)為局部復(fù)發(fā)的患者相對(duì)于遠(yuǎn)處轉(zhuǎn)移有較好的預(yù)后,但其仍會(huì)繼發(fā)疼痛、出血、消化道梗阻等一系列問題,并最終出現(xiàn)遠(yuǎn)處轉(zhuǎn)移,進(jìn)而影響患者生存[11]。
與遠(yuǎn)處轉(zhuǎn)移不同,外科手術(shù)在預(yù)防局部復(fù)發(fā)中起著非常重要的作用。目前對(duì)于根治性手術(shù)的清掃范圍有一定爭(zhēng)議,且多數(shù)學(xué)者認(rèn)為擴(kuò)大區(qū)域淋巴結(jié)清掃不能改善患者的預(yù)后,但已明確殘余胰腺、肝總動(dòng)脈、腹腔干、主動(dòng)脈旁區(qū)、腸系膜上動(dòng)脈以及門靜脈是胰頭癌常見的局部復(fù)發(fā)部位[4]。德國海德堡大學(xué)提出海德堡三角手術(shù)理念,與擴(kuò)大區(qū)域淋巴結(jié)清掃不同,其更強(qiáng)調(diào)清掃腸系膜上動(dòng)脈、肝總動(dòng)脈與腸系膜上靜脈、門靜脈組成的三角形區(qū)域內(nèi)的所有淋巴組織、血管及神經(jīng)組織,可以最大程度降低局部復(fù)發(fā)率,改善患者預(yù)后[12]。
本研究中海德堡組均順利應(yīng)用腹腔鏡技術(shù)清掃海德堡三角區(qū)域,平均手術(shù)時(shí)間較清掃常規(guī)淋巴結(jié)的對(duì)照組有所延長(zhǎng),但在術(shù)中出血量、術(shù)后進(jìn)食時(shí)間及住院時(shí)間等方面與對(duì)照組差異無統(tǒng)計(jì)學(xué)意義。海德堡組患者手術(shù)時(shí)間均較對(duì)照組長(zhǎng),考慮可能與外科醫(yī)師的學(xué)習(xí)曲線以及重要血管裸化有關(guān)。在并發(fā)癥發(fā)生方面,海德堡組淋巴瘺的發(fā)生率明顯升高,但其他重要并發(fā)癥如胰瘺、膽瘺及出血等較對(duì)照組發(fā)生率無增加。完全清掃海德堡三角的過程中涉及到淋巴管主干和較粗的淋巴管,本研究多數(shù)情況下使用能量刀,除重要血管以外,極少采取冷分離或生物夾夾閉。這可能是淋巴瘺發(fā)生率增加的主要原因,今后可以通過物理結(jié)扎或縫扎有效預(yù)防淋巴瘺的發(fā)生。
目前關(guān)于胰腺癌根治術(shù)中切緣的論述存在較多爭(zhēng)議,R0/R1尚缺乏統(tǒng)一的標(biāo)準(zhǔn)。我國多采用歐洲標(biāo)準(zhǔn),以切緣內(nèi)1 mm無腫瘤細(xì)胞浸潤為R0。胰頭癌根治性切除標(biāo)本的病理研究顯示,70%~80%以上的胰頭癌患者并未獲得>1 mm的陰性切緣[13]。本研究中海德堡組76.9%患者組織標(biāo)本的陰性切緣>1 mm,且高于對(duì)照組,提示腹腔鏡技術(shù)清掃海德堡三角可以明顯提高胰頭癌根治術(shù)的R0切除率,降低局部復(fù)發(fā)可能。如何進(jìn)行合理的淋巴結(jié)清掃,目前缺乏大樣本、多中心的隨機(jī)對(duì)照試驗(yàn)研究,規(guī)范的淋巴結(jié)清掃范圍同樣存在爭(zhēng)議。但術(shù)中清掃淋巴結(jié)數(shù)目與胰腺癌患者的長(zhǎng)期預(yù)后有一定相關(guān)性[14]。本研究提示LPD術(shù)中清掃海德堡三角可以清除更多的淋巴結(jié),有利于患者長(zhǎng)期預(yù)后的改善。
綜上所述,LPD治療胰腺癌時(shí)聯(lián)合清掃海德堡三角區(qū)域具有一定的可行性和安全性,并且可以提高手術(shù)的R0切除率,清掃更多淋巴結(jié)。但其遠(yuǎn)期臨床療效仍需大樣本、多中心的前瞻性隨機(jī)臨床試驗(yàn)進(jìn)一步驗(yàn)證。
利益沖突所有作者均聲明不存在利益沖突

