番鴨細小病毒非結構蛋白NS1與水禽真核翻譯延伸因子1A1的體外互作分析
于天飛,謝鵬宇,孫婉姝,李 靜,尹海暢,黎 明,于志丹
(1.齊齊哈爾大學 生命科學與農林學院,黑龍江 齊齊哈爾 161006;2.黑龍江省抗性基因工程與寒地生物多樣性保護重點實驗室,黑龍江 齊齊哈爾 161006;3.齊齊哈爾大學 計算機與控制工程學院,黑龍江 齊齊哈爾 161006)
番鴨細小病毒病是由番鴨細小病毒(Muscovyduckparvovirus,MDPV)引起的主要發生在3周內的雛番鴨的一種急性傳染病,俗稱番鴨“三周病”[1-3]。患病番鴨表現以腹瀉、軟腳和喘氣為主要特征,發病率40%~50%,死亡率在50%~80%,對番鴨飼養業的危害極大[4-6]。MDPV為細小病毒科細小病毒亞科依賴細小病毒屬成員,根據最新版ICTV病毒分類,MDPV 和與其親緣關系密切的鵝細小病毒(Gooseparvovirus,GPV)[7]被列為單一種,即雁形目依賴細小病毒1[8]。MDPV 基因組為約5.1 kb的單鏈DNA,基因組兩端為末端倒置重復序列(ITR)[9]。基因組包含2 個開放閱讀框(ORF),左側ORF編碼非結構蛋白NS,受P9啟動子調控,通過對mRNA的選擇性剪切可生成NS1以及NS2蛋白[10-11];右側ORF 編碼結構蛋白VP,受P41啟動子調控,通過對mRNA選擇性剪切以及起始密碼子的選擇性使用可編碼VP1、VP2 和VP3 3個結構蛋白[12-13]。有研究表明,鴨真核翻譯延伸因子1(Eukaryotic translation elongation factor 1A1,eEF1A1)可與鵝細小病毒VP1蛋白產生相互作用,并參與了GPV的增殖過程[14]。NS蛋白作為調節蛋白與MDPV的復制增殖有關,推測其可能與宿主eEF1A1產生互作。本研究通過大腸桿菌表達MDPV YL08株NS1蛋白、北京鴨eEF1A1蛋白和浙東白鵝eEF1A1蛋白,并通過GST pull-down 進行了體外驗證重組蛋白NS1與水禽eEF1A1的相互作用試驗,旨在為MDPV與宿主細胞蛋白互作及其復制機制的研究奠定一定的理論和物質基礎。
1 材料和方法
1.1 試驗材料
1.1.1 菌種、質粒和抗體 質粒pET-32a、pGEX-6P-1,E.coli菌種DH5α和Rosetta(DE3)由齊齊哈爾大學動物免疫學研究室保存。MDPV YL08株感染番鴨血清、HRP標記兔抗鴨IgG由齊齊哈爾大學動物免疫學研究室制備保存。辣根過氧化物酶(HRP)標記GST、His標簽單克隆抗體購自Thermo Fisher公司。PierceTMGST Protein Interaction Pull-Down Kit購自Thermo Fisher公司。
1.1.2 主要試劑 T4DNA連接酶、BamH Ⅰ和XhoⅠ限制性核酸內切酶購自TaKaRa公司。高保真KOFTaq酶、dNTP mix和4氯-1-奈酚(4-CN)購自哈爾濱超峰生物科技發展有限公司。異丙基硫代半乳糖苷(IPTG)、氨芐青霉素(Amp)購自北京索萊寶科技有限公司。質粒小提試劑盒、膠回收小提試劑盒購自Omega 公司。蛋白預染Marker購自Thermo Fisher公司。
1.2 試驗方法
1.2.1 原核表達載體構建 參照GenBank中收錄的北京鴨eEF1A1和浙東白鵝eEF1A1基因序列(GenBank登錄號:XM_027454993、XM_013172141),根據大腸桿菌偏愛密碼子進行優化,由蘇州金唯智生物股份有限公司合成,合成質粒命名為pUC57-DeEF1A1和pUC57-GeEF1A1。合成基因的兩端預留BamHⅠ和XhoⅠ限制性核酸內切酶酶切位點。北京鴨、浙東白鵝eEF1A1基因全長1 389 bp,編碼462 個氨基酸。用BamHⅠ和XhoⅠ雙酶切含有MDPV YL08株[15]NS1基因的重組質粒pUC57-NS1、pUC57-DeEF1A1和pUC57-GeEF1A1,回收目的片段NS1、DeEF1A1和GeEF1A1。利用T4DNA連接酶將目的片段分別插入至pGEX-6p-1或pET-32a的BamHⅠ和XhoⅠ多克隆位點之間,轉化DH5α,涂布固體LB平板(Amp,100 μg/mL),37 ℃培養14 h。挑取單個菌落于液體LB(Amp 100 μg/mL)中,37 ℃培養14 h,提取質粒。單(BamH Ⅰ)、雙酶切(BamH Ⅰ和XhoⅠ)鑒定質粒。相應質粒由哈爾濱博仕生物科技有限公司進行序列測定。重組質粒分別命名為pGEX-DeEF1A1、pET-GeEF1A1、pET-NS1和pGEX-NS1。
1.2.2 重組蛋白的誘導表達 重組質粒pGEX-DeEF1A1、pET-GeEF1A1、pET-NS1和pGEX-NS1分別轉化Rosetta(DE3),涂布含有Amp 100 μg/mL的固體LB平板。37 ℃培養12~14 h,挑取單菌落,獲得重組菌株。重組菌首先接種含有Amp 100 μg/mL的液體LB培養基中,37 ℃振蕩培養12~14 h。再以1%比例轉接新鮮的含有Amp 100 μg/mL的液體LB培養基,37 ℃振蕩培養至菌液OD600達0.5~0.6時,加入IPTG(終濃度至1.0 mmol/L),37 ℃繼續振蕩培養,分時段收獲菌液沉淀,SDS-PAGE電泳分析重組蛋白表達情況。重組蛋白分別命名為GST-DeEF1A1、TRX-GeEF1A1、TRX-NS1和GST-NS1。
1.2.3 重組蛋白GST-DeEF1A1和TRX-GeEF1A1的純化及鑒定 SDS-PAGE電泳后,參照文獻[16]采用切膠純化法純化重組蛋白。采用Bradford檢測法分別對重組蛋白的含量進行測定[17]。參照文獻[16]的方法采用HRP標記的GST或His標簽單克隆抗體進行Western Blot鑒定。
1.2.4 重組蛋白TRX-NS1和GST-NS1的純化及鑒定 重組蛋白TRX-NS1和GST-NS1的純化及HRP標記的GST或His標簽單克隆抗體進行鑒定的過程同1.2.3。Western Blot鑒定重組蛋白TRX-NS1和GST-NS1的抗原性。純化的重組蛋白經SDS-PAGE后電轉印至NC膜上,采用5%脫脂乳溶液封閉,4 ℃過夜,用PBST溶液重復洗滌3次,10 min/次,浸入PBS溶液1∶200稀釋的MDPV感染番鴨血清中,4 ℃過夜。棄去一抗稀釋液,用PBST溶液洗滌NC膜3 遍,10 min/次。然后用PBS溶液洗滌NC膜1 遍,10 min/次。把NC膜浸入PBS溶液1∶1 000稀釋的HRP標記兔抗鴨IgG中,4 ℃過夜。棄去二抗溶液,用無磷酸鹽緩沖液洗滌NC膜,共3遍,10 min/次。將NC膜移至新鮮配制的4-CN溶液中,放入恒溫箱中,37 ℃避光顯色5 min。經觀察,當顯色顏色深度合適時,用去離子水洗滌,終止顯色反應。
1.2.5 GST pull-down驗證 GST-DeEF1A1與TRX-NS1、GST-NS1與TRX-GeEF1A1的互作。
1.2.5.1 誘餌蛋白的固定 參照PierceTMGST Protein Interaction Pull-Down Kit說明書,按照TBS 緩沖液和裂解液1∶1的體積比混合制備洗液;每對組合(GST-DeEF1A1/TRX-NS1、GST-NS1/TRX-GeEF1A1)設置1組試驗組,5組對照組;吸取試劑盒中的谷胱甘肽瓊脂糖樹脂加入濾柱中,50 μL/濾柱;加入400 μL洗液,蓋上頂帽,上下溫和地顛倒8~10 次,使樹脂充分平衡,打開底塞,把濾柱放入一個收集管中;室溫下離心 1 min,5 000 r/min,棄掉收集管中的洗液,重新插入濾柱;重復上述洗滌步驟 4 次;將重組蛋白GST-DeEF1A1、GST-NS1和GST蛋白分別用洗液稀釋至1 mg/mL;將每個濾柱底部蓋上,頂部打開,將稀釋好的重組蛋白GST-DeEF1A1、GST-NS1和GST蛋白500 μL加入濾柱中;4 ℃,溫和搖動孵育30 min;去掉濾柱底部的塞子,將濾柱置于收集管中;室溫5 000 r/min,離心 1 min;加入 600 μL的洗液,按照前述洗滌步驟重復洗滌 4 次。
1.2.5.2 重組蛋白TRX-NS1、TRX-GeEF1A1的捕獲 將重組蛋白TRX-NS1、TRX-GeEF1A1和TRX蛋白分別用洗液稀釋至1 mg/mL;向1.2.5.1中已經固定有重組蛋白GST-DeEF1A1、GST-NS1或GST蛋白的濾柱中加入稀釋好的重組TRX-NS1蛋白或TRX蛋白樣品 500 μL,4 ℃孵育1 h,每隔 10 min溫和搖動1次;室溫離心1 min,5 000 r/min;加入600 μL的洗液,按照前述洗滌步驟重復洗滌 4 次。
1.2.5.3 誘餌-捕獲蛋白的洗脫 用洗液配置0.031 g/mL的谷胱甘肽洗脫緩沖液;向1.2.5.2中充分洗滌后的濾柱中加入 250 μL的洗脫液,不斷地溫和搖動,作用 5 min,室溫5 000 r/min,離心1 min,收集管內液體置于冰上保存。
1.2.5.4 洗脫液Western Blot分析 將1.2.5.3制備的洗脫液進行Western Blot分析。將轉印有上述各組洗脫液成分的NC膜放入含5%脫脂乳的封閉液中4 ℃封閉過夜。將封閉液倒掉,用PBST洗滌NC膜,共3遍,10 min/次。然后用PBS洗滌NC膜1 遍,10 min。然后將其放入10 mL同時含有1∶100 PBS稀釋HRP標記的His和GST標簽的混合單克隆抗體,4 ℃過夜。棄去混合單抗稀釋液。用PBST洗滌NC膜2 遍,10 min/次。然后用PBS洗滌NC膜1 遍,10 min/次。將NC膜移至新鮮配制的4-CN溶液中,放入37 ℃恒溫箱中,避光顯色,5 min后觀察,去離子水洗滌使反應終止。
1.2.6 水禽eEF1A1的氨基酸序列比對及3D結構建模 使用DNAMAN軟件對北京鴨eEF1A1與浙東白鵝eEF1A1氨基酸序列進行比對。通過SWISS-MODEL(https://swissmodel.expasy.org/interactive/)進行2 種eEF1A1的3D結構同源建模。
2 結果與分析
2.1 重組質粒酶切鑒定
構建的重組質粒pET-GeEF1A1、pET-NS1、pGEX-DeEF1A1和pGEX-NS1分別采用BamHⅠ單酶切和BamHⅠ、XhoⅠ雙酶切,經瓊脂糖凝膠電泳檢測,結果表明,酶切結果與預期一致。測序結果表明,目的基因插入載體的位置和閱讀框均正確。
2.2 重組蛋白的表達
重組質粒分別轉化Rosetta(DE3),IPTG誘導后1,2,3,4 h分時段進行取樣,SDS-PAGE結果表明,獲得了重組蛋白GST-DeEF1A1、TRX-GeEF1A1、TRX-NS1和GST-NS1的表達,分子量分別為76.9,67.9,89.5,98.6 ku,與預期相符(圖1,箭頭所示)。
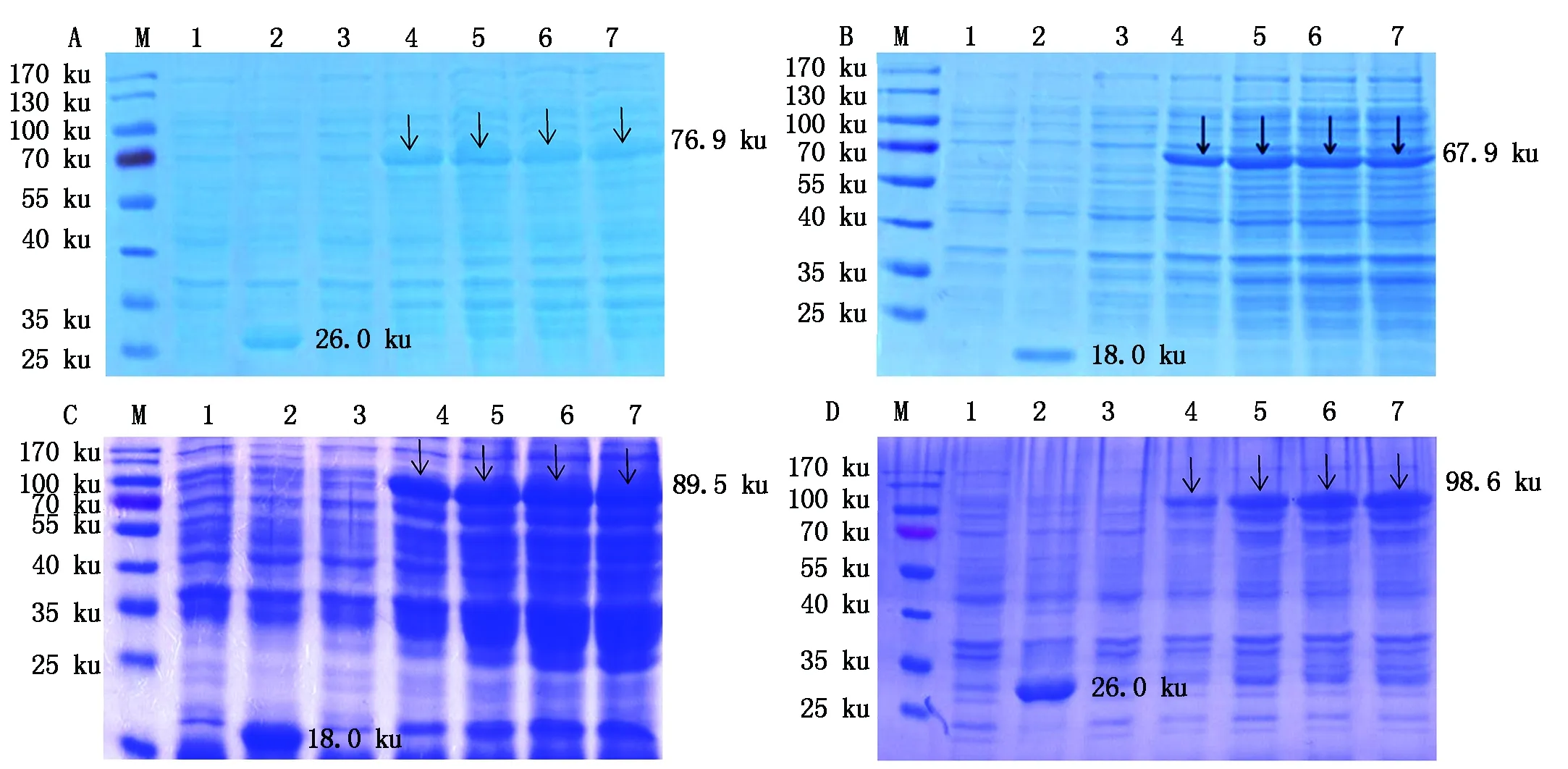
A.SDS-PAGE檢測重組蛋白GST-DeEF1A1的表達:M.蛋白Marker;1.誘導前的pGEX-6p-1/E.coli Rosetta(DE3);2.誘導后4 h的pGEX-6p-1/E.coli Rosetta(DE3);3.未誘導的pGEX-DeEF1A1/E. coli Rosetta(DE3)重組菌;4-7. 誘導1~4 h的pGEX-DeEF1A1/E. coli Rosetta(DE3)重組菌。B. SDS-PAGE檢測重組蛋白TRX-GeEF1A1的表達:M.蛋白Marker;1.誘導前的pET-32a/E.coli Rosetta(DE3);2.誘導后4 h的pET-32a/E.coli Rosetta(DE3);3.未誘導的pET-GeEF1A1/E. coli Rosetta(DE3)重組菌;4-7. 誘導1~4 h的pET-GeEF1A1/E. coli Rosetta(DE3)重組菌。C.SDS-PAGE檢測重組蛋白TRX-NS1的表達:M.蛋白Marker;1.誘導前的pET-32a/E.coli Rosetta(DE3);2.誘導后4 h的pET-32a/E.coli Rosetta(DE3);3.未誘導的pET-NS1/E.coli Rosetta(DE3)重組菌;4-7.誘導1~4 h的pET-NS1/E. coli Rosetta(DE3)重組菌。D.SDS-PAGE檢測重組蛋白GST-NS1的表達。M.蛋白Marker;1.誘導前的pGEX-6p-1/E.coli Rosetta(DE3);2. 誘導后4 h的pGEX-6p-1/E.coli Rosetta(DE3);3. 未誘導的pGEX-NS1/E.coli Rosetta(DE3)重組菌;4-7. 誘導1~4 h的pGEX-NS1/E. coli Rosetta(DE3)重組菌。
2.3 重組蛋白GST-DeEF1A1和TRX-GeEF1A1的鑒定
基于GST、His標簽單克隆抗體的Western Blot鑒定的結果表明,所獲得的表達蛋白為重組目的蛋白(圖2)。Bradford法測定重組蛋白GST-DeEF1A1的濃度為1.13 mg/mL,獲得重組蛋白TRX-GeEF1A1的濃度為1.31 mg/mL。
2.4 重組蛋白TRX-NS1和GST-NS1的純化及鑒定
重組蛋白TRX-NS1和GST-NS1切膠純化。經GST、His標簽單克隆抗體鑒定的結果表明,所獲得的表達蛋白為重組目的蛋白。重組蛋白TRX-NS1和GST-NS1可與MDPV感染番鴨血清特異性結合,抗原性良好(圖3)。采用Bradford檢測法對重組蛋白的含量進行測定,獲得重組蛋白TRX-NS1和GST-NS1濃度分別為1.33,1.26 mg/mL。
2.5 GST pull-down驗證GST-DeEF1A1與TRX-NS1、GST-NS1與TRX-GeEF1A1的互作
GST-DeEF1A1+TRX-NS1試驗組洗脫液經Western Blot 分析,與抗His和抗GST的混合單克隆抗體作用,分別得到89.5 ku大小的重組蛋白TRX-NS1的條帶和76.9 ku大小的GST-DeEF1A1重組蛋白條帶;對照組GST-DeEF1A1+TRX的洗脫液經Western Blot 分析得到大小為76.9 ku的重組蛋白GST-DeEF1A1條帶;對照組GST+TRX-NS1的洗脫液經Western Blot 分析得到大小為26.8 ku的標簽蛋白GST條帶;對照組GST+TRX的洗脫液經Western Blot 分析得到大小為26.8 ku的標簽蛋白GST條帶(圖4-A)。上述結果說明MDPV NS1蛋白可以和北京鴨eEF1A1在體外相互作用。
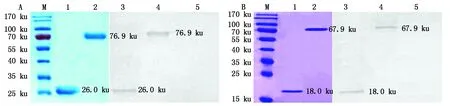
A.重組蛋白GST-DeEF1A1純化和鑒定結果:M. 蛋白質Marker;1.GST標簽蛋白;2.GST-DeEF1A1;3.GST蛋白;4.GST-DeEF1A1;5.TRX蛋白。B.重組蛋白TRX-GeEF1A1純化和鑒定結果:M.蛋白質Marker;1.TRX標簽蛋白;2.TRX-GeEF1A1;3.TRX蛋白;4.TRX-GeEF1A1;5.GST蛋白。
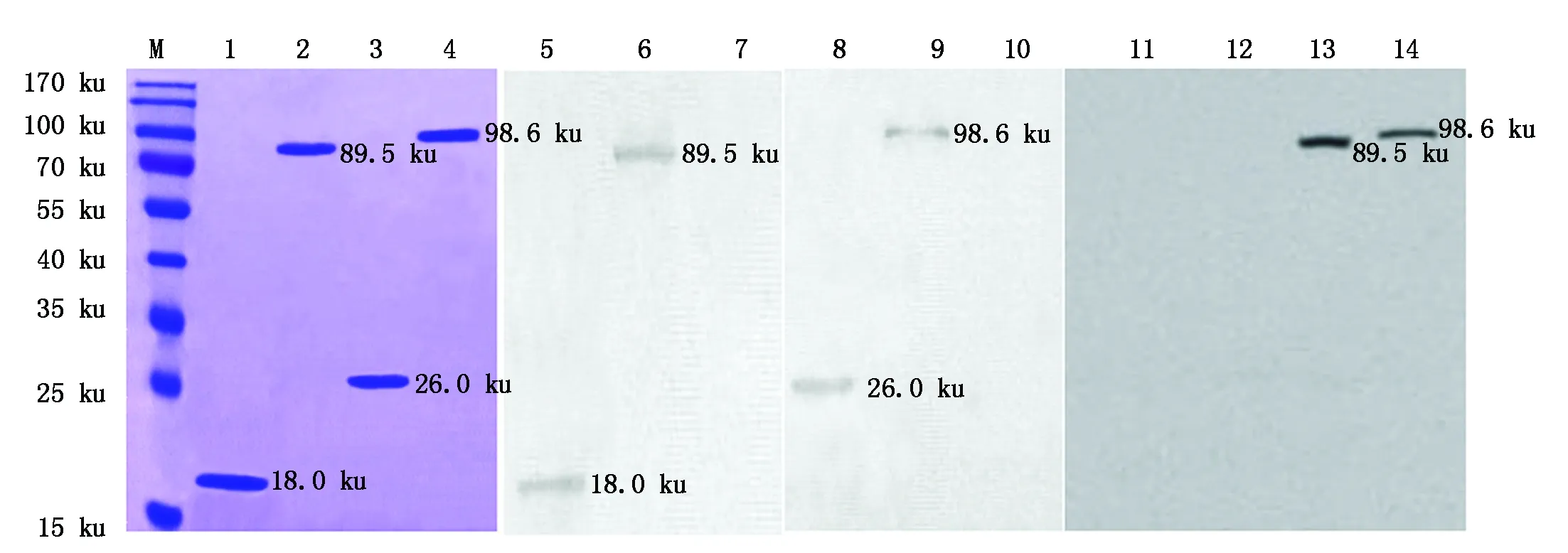
M. 蛋白質Marker;1.純化的TRX標簽蛋白;2. 純化的TRX-NS1蛋白;3. 純化的GST標簽蛋白;4. 純化的GST-NS1蛋白;5. His單抗鑒定TRX標簽蛋白;6. His單抗鑒定TRX-NS1蛋白;7. GST標簽蛋白;8. GST單抗鑒定GST標簽蛋白;9. GST單抗鑒定GST-NS1;10. TRX標簽蛋白;11. TRX標簽蛋白;12. GST標簽蛋白;13. MDPV感染血清鑒定TRX-NS1;14. MDPV感染血清鑒定GST-NS1。
GST-NS1+TRX-GeEF1A1試驗組洗脫液經 Western Blot 分析,與抗His和抗GST的混合單克隆抗體作用,僅得到98.6 ku大小的重組蛋白GST-NS1的條帶;對照組GST-NS1+TRX的洗脫液經Western Blot 分析得到大小為98.6 ku的重組蛋白GST-NS1條帶;對照組GST+ TRX-GeEF1A1的洗脫液經Western Blot 分析得到大小為26.8 ku的標簽蛋白GST條帶;對照組GST +TRX的洗脫液經Western Blot 分析得到大小為26.8 ku的標簽蛋白GST條帶(圖4-B)。上述結果說明MDPV NS1蛋白不能和浙東白鵝eEF1A1在體外相互作用。
2.6 水禽eEF1A1的氨基酸序列比對及3D結構建模
氨基酸序列比對結果顯示,北京鴨eEF1A1與浙東白鵝eEF1A1蛋白相似性為98.7%,只是在102-106 aa,108 aa有差異,北京鴨eEF1A1為102MITGT106Q108,浙東白鵝eEF1A1為102LFSFF106K108,其他位置完全一致(圖5)。
3D結構建模結果如圖6所示。2種蛋白空間結構高度類似,主要包含4個結構域,其中第一結構域和第二結構域富含α螺旋結構,第二結構域和第四結構域富含β折疊結構。二者在一維結構上的差異蛋白102MITGT106Q108形成第二結構域的第一個α螺旋結構(圓圈處)。
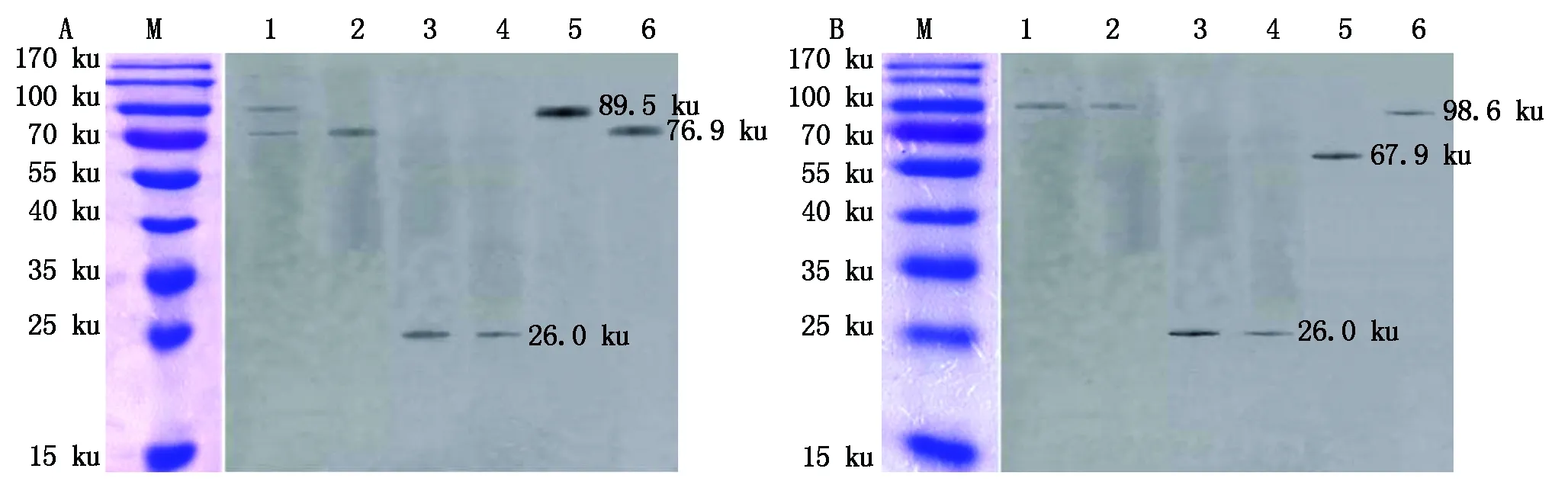
A:M.蛋白Marker;1.GST-DeEF1A1+TRX-NS1;2.GST-DeEF1A1+TRX;3.GST+TRX-NS1;4.GST+TRX;5.TRX-NS1 input;6.柱子空載GST-DeEF1A1。B:M.蛋白Marker;1.GST-NS1+TRX-GeEF1A1;2.GST-NS1+TRX;3.GST+TRX-GeEF1A1;4.GST+TRX;5.TRX-GeEF1A1 input;6.柱子空載GST-NS1。

圖5 水禽eEF1A1氨基酸序列相似性比對Fig.5 Amino acid sequence similarity alignment of waterfowl eEF1A1
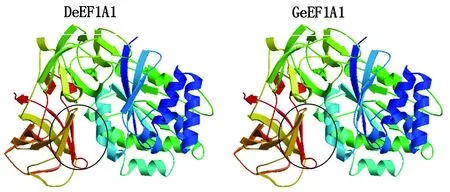
圖6 水禽eEF1A1的3D結構建模Fig.6 3D structural modeling of waterfowl eEF1A1
3 結論與討論
真核翻譯延伸因子包括eEF1A(eukaryotic translation elongation factor 1A)、eEF1B(eukaryotic translation elongation factor 1B)和eEF2(eukaryotic translation elongation factor 2),三者共同參與蛋白質合成過程,發揮肽鏈延伸作用[18]。eEF1A包含eEF1A1和eEF1A2 2種亞型。eEF1A1和eEF1A2在多肽延伸過程中承擔相似的功能,但二者表達模式具有一定的組織差異性[19-20]。eEF1A在細胞增殖、凋亡以及腫瘤發生和病毒復制方面也發揮著重要作用[21],其中eEF1A參與RNA病毒復制的報道較多,而參與DNA病毒生命周期過程的報道較少。張雙[14]采用GST pull-down技術證明鴨eEF1A1與GPV VP1可形成蛋白復合物,前者可影響GPV在鴨胚成纖維細胞表面的吸附,并具有抑制GPV增殖作用。而后,又將pcDNA3.0-eEF1A1轉染到鴨胚成纖維細胞中,同時用GPV感染細胞,證明在細胞內,eEF1A1表達量的增加可促進GPV增殖。推測eEF1A1可能是在GPV啟動子代病毒復制過程中起輔助作用。本研究通過GST pull-down 技術驗證重組NS1蛋白與水禽eEF1A1的相互作用,分析結果表明,MDPV NS1蛋白可以和北京鴨eEF1A1在體外相互作用而不能與浙東白鵝eEF1A1在體外相互作用。北京鴨eEF1A1與浙東白鵝eEF1A1只是在102-106 aa和108 aa有差異,北京鴨eEF1A1為102MITGT106Q108,浙東白鵝eEF1A1為102LFSFF106K108,其他位置完全一致,推測NS1蛋白與北京鴨eEF1A1、浙東白鵝eEF1A1在體外互作的差異性可能與這7個氨基酸有關。通過SWISS-MODEL進行水禽eEF1A1的同源3D結構建模結果表明,2種蛋白空間結構高度類似,二者在一維結構上的差異蛋白102MITGT106Q108(102LFSFF106K108)形成第二結構域的第一個α螺旋結構。推測該螺旋結構與第二結構域其他2個α螺旋所圍成的空腔可能是MDPV NS1蛋白與水禽eEF1A1的互作結合位點;第二結構域的第一個α螺旋結構的差異可能是MDPV NS1蛋白可以和北京鴨eEF1A1在體外相互作用而不能與浙東白鵝eEF1A1在體外相互作用的原因。

