卵巢癌類器官的建立及其在藥物測試中的應用進展
陳 棟,時艷芳,劉宇辰
1.北京大學深圳醫院甲狀腺乳腺外科(廣東深圳 518036)
2.深圳大學第一附屬醫院深圳市轉化醫學研究院(廣東深圳 518035)
3.平邑縣中醫醫院婦科(山東臨沂 276000)
卵巢癌是嚴重威脅生命健康的惡性腫瘤,死亡率居女性惡性腫瘤首位。由于早期臨床癥狀的隱匿性或非特異性,超過80%的患者直到癌轉移或晚期才被診斷出來。大多數卵巢癌表現為上皮性卵巢癌(epithelial ovarian cancer,EOC),其中75%的EOC患者被診斷為高級別漿液性卵巢癌(high-grade serous ovarian cancer,HGSOC),死亡率高達80%[1]。早期診斷的缺乏以及術后化療效果差等原因,導致過去幾十年卵巢癌患者的整體生存率提升有限[2],尋找與開發新的治療方案是當前卵巢癌研究和治療的熱點和難點。
傳統二維培養的腫瘤細胞系和腫瘤異種移植動物模型作為臨床前研究模型被廣泛使用,但都存在一定的缺陷。二維培養的腫瘤細胞操作簡單,適用于高通量藥物篩選,但在長期的培養過程中喪失了腫瘤的異質性,無法模擬患者體內腫瘤的復雜結構、病理特征、基因型以及細胞間的信號通路[3]。源自患者的異種移植模型雖然能夠模擬親本腫瘤的特征,維持腫瘤異質性和基因組穩定性,但其構建效率低、耗時長、費用昂貴、存在種屬差異,也不適合高通量藥物篩選[4]。
近年來,腫瘤類器官培養技術的出現與發展為腫瘤研究帶來了全新的臨床前研究模型。類器官是在體外對干細胞或器官祖細胞進行誘導分化形成的,在結構和功能上類似目標器官或組織的三維細胞復合體,具有穩定的表型和遺傳學特征,能夠在體外長期傳代培養。腫瘤類器官模型不僅能夠展現其來源腫瘤的病理學特征,保持基因表達的穩定性,還能精確地預測患者對抗腫瘤藥物的反應。目前已經報道了膀胱癌[5]、胃癌[6]、前列腺癌[7]、胰腺癌[8]、肝癌[9]、乳腺癌[10]、子宮內膜癌[11]、結腸癌[12]等多種腫瘤類器官模型。研究表明這些腫瘤類器官從組織病理學特征、基因拷貝數變化和基因突變類型等方面都能夠高度還原在體腫瘤的特征,是目前腫瘤基礎研究和臨床應用相互轉換的橋梁。借助于腫瘤類器官庫的建立,及其對藥物殺傷效果預測的準確性,可以在制定腫瘤患者治療策略前,一方面通過檢測腫瘤類器官的突變類型,確定可能起作用的候選藥;另一方面利用腫瘤類器官對藥物進行篩選,獲得在類器官上對腫瘤有殺傷作用而對健康組織毒副作用較小的藥物,進而應用于臨床,實現腫瘤的個體化治療。近年來,卵巢癌類器官的構建及應用研究取得了重要成果(圖1)。本文圍繞卵巢癌類器官模型的建立、鑒定及其在藥物測試中的最新研究進展作一綜述。
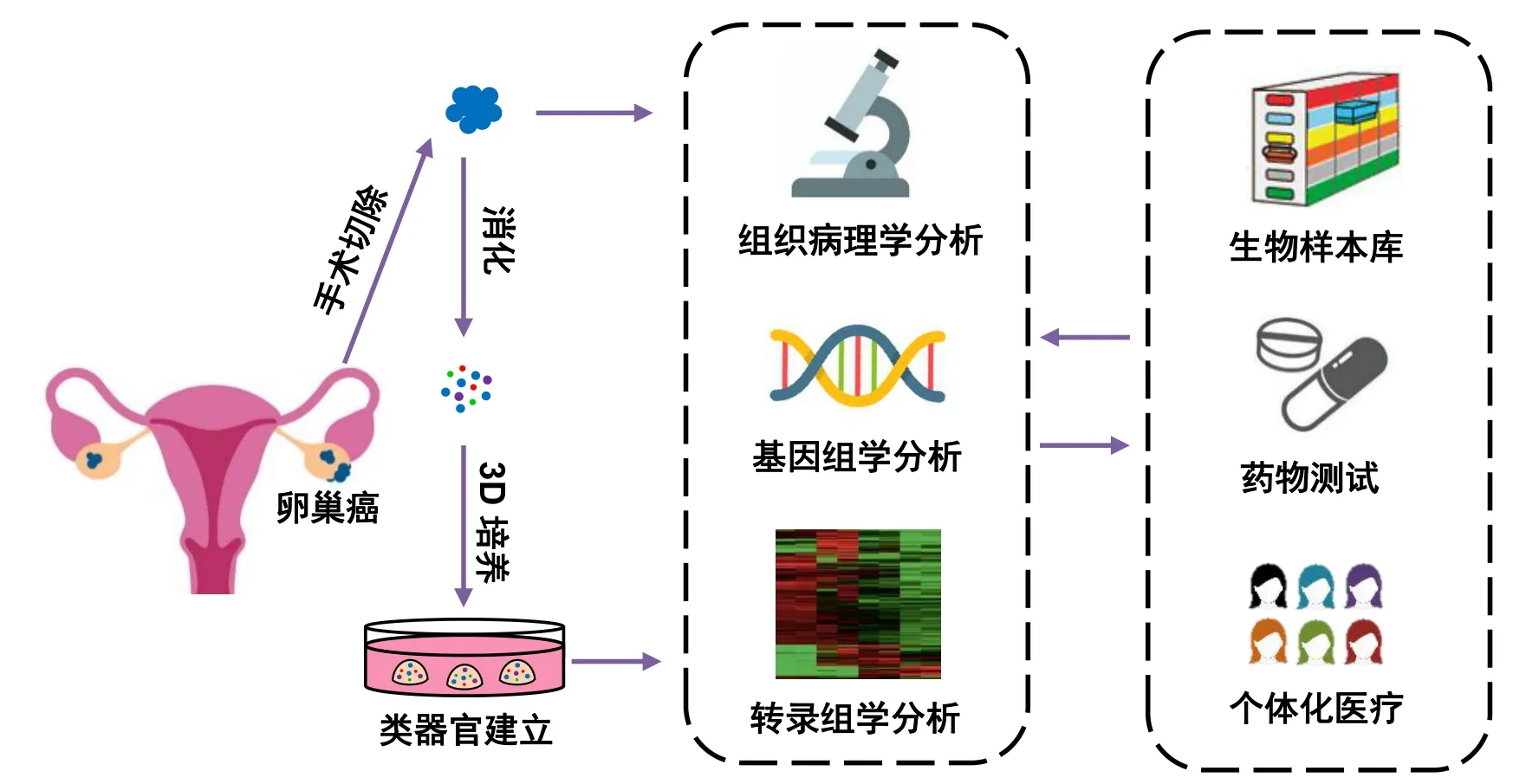
圖1 卵巢癌類器官模型的建立、鑒定以及在藥物測試中的應用研究流程圖Figure 1.The establishment and identification of ovarian cancer organoid model and its application research model diagram in drug testing
1 卵巢癌類器官的建立
與細胞系的培養方式不同,類器官是將從組織或器官分離出的多能干細胞或器官祖細胞置于基質膠中進行三維培養。培養基中需要添加多種生長因子、抑制因子、激素等為類器官提供類似在體的生長環境。2009年,Hans等通過向培養基中加入表皮生長因子、Wnt(wingless/integration-1)信號激動劑、R-脊椎蛋白 1(roof plate-specific spondin 1,R-spondin-1)和骨形成蛋白信號抑制劑頭蛋白(noggin)等培養出小腸類器官[13]。2011年,其團隊再次通過引入煙酰胺、成纖維細胞生長因子、胃泌素、p38抑制劑SB202190、間變性淋巴瘤激酶(anaplastic lymphoma kinase,Alk)抑制劑A83-01等成功培養出小腸和結腸的多種疾病類器官模型[12]。
近年來相繼報道了卵巢癌類器官培養體系的建立和應用。2018年,Hill等利用22名HGSOC患者的腫瘤標本建立了33個類器官系,這些類器官來源于原發性、轉移性以及復發性腫瘤部位提取的實體瘤,同時,他們從提取的腹水或胸膜液中培養出類器官,成功率接近100%,與其他腫瘤類器官培養組分相似,HGSOC類器官培養基中也需要添加R-spondin-1,這表明該類器官的生長是Wnt通路依賴的[14]。2019年,Kopper等利用32位患者的腫瘤樣本分別建立了56個類器官系,幾乎涵蓋了EOC的所有亞型[15]。除了建立常見的HGSOC類器官,該團隊也成功培養出低級別惡性亞型如低級別漿液性癌(low-grade serous carcinoma,LGSC)類器官和透明細胞癌(clear cell carcinoma,CCC)類器官。患者的原發腫瘤以及不同位置的轉移灶都可以用于構建類器官,表明該模型是卵巢癌異質性研究的潛在材料[15]。研究發現在培養基中添加皮質醇、毛喉素和神經調節蛋白-1因子能夠顯著提高卵巢癌類器官構建的成功率,但Wnt因子不是必需的[15]。優化后的培養基可使卵巢癌類器官長期、穩定傳代培養,并像細胞系一樣低溫凍存和高效復蘇[15]。Maenhoudt等測試多種培養基成分發現神經調節蛋白-1是EOC類器官生長的關鍵因子,而且還能增加EOC類器官的傳代數[16]。Hoffmann等發現Wnt信號途徑的激活會導致HGSOC類器官生長停滯,表明低量的Wnt環境有利于HGSOC類器官的長期穩定生長[17]。另一項研究成功培養出I-III期不同亞型的卵巢癌類器官,建系成功率約為80%,其與先前報道的主要區別在于培養基中沒有添加煙酰胺、神經調節蛋白-1、皮質醇和毛喉素因子,而加入了胃泌素和胰島素生長因子[18]。卵巢癌類器官的構建方法并不唯一,不同的培養基組分會導致建系效率和成功率有所差異。個性化的培養方式也有利于建立不同亞型的卵巢癌類器官用于科學研究和臨床試驗。
2 卵巢癌類器官重現腫瘤組織的表型和基因型
類器官是由不同類型細胞構成的復雜三維結構,需對培養的腫瘤類器官進行身份驗證以確定其是否能夠維持親本腫瘤的特征。通常從基因型和表型兩個方面來鑒定類器官與原始腫瘤的同源性。基因型上常用全基因組或者全外顯子組測序的方法來表征腫瘤組織和對應類器官在拷貝數改變和體細胞突變上的一致性。表型上可以通過蘇木精和伊紅(hematoxylin-eosin staining,H&E)染色和免疫組織化學染色對腫瘤組織和對應的類器官進行組織病理學分析,以確定類器官的表型是否與其來源的腫瘤一致。
Hill等根據H&E染色發現HGSOC類器官與親本腫瘤在形態學和細胞學上相匹配,親本腫瘤和其產生的類器官都表現出廣泛的核多態性以及突出的核仁和致密的染色質,重現了HGSOC的細胞學特征[14]。免疫組織化學染色發現類器官和親本腫瘤在標志蛋白的表達上也相符。例如,大多數HGSOC的腫瘤組織以及對應的類器官對苗勒管的標志物配對盒基因8(paired-box 8,PAX8)都呈陽性反應,在HGSOC類器官中檢測到突變型p53的免疫陽性顯色同樣也存在于其對應的腫瘤樣本中。通過全外顯子測序分析發現,HGSOC類器官與親本腫瘤中基因突變相似度的中位數為98.2%。卵巢癌和類器官在基因突變譜上的高度一致性表明HGSOC類器官可作為評估親本腫瘤DNA損傷修復缺陷的模型。另一項研究建立的不同病理學亞型的EOC類器官表現出廣泛的形態學差異,轉移癌產生的類器官也與在體的癌灶在病理學上表現出高度的一致性[15]。EOC類器官重現了親本腫瘤的基因突變和拷貝數變異模式,即使經長時間傳代培養后,親本腫瘤中的基因突變和基因拷貝數變異在類器官中仍然得到了較好的維持[15]。EOC類器官還能夠重現疾病的細胞和分子表型,并顯示出親本腫瘤中存在的非典型性和蛋白質標志物表達[16]。低覆蓋率的全基因組測序表明,腫瘤中的絕大多數體細胞拷貝數改變同樣保留在相應的類器官中。全外顯子測序發現絕大多數遺傳改變都同時存在于原發腫瘤和對應的類器官中[16]。此外,近期兩項研究也發現患者來源的卵巢癌類器官高度重現了原始腫瘤的基因組學特征[18-19]。以上研究表明,患者卵巢癌衍生的類器官能夠高度還原體內腫瘤的形態特征、疾病特征和基因組構成。
異質性被認為是癌癥治療失敗的主要原因,建立個體化的臨床前模型對于預測癌癥的藥物反應和制定有效的治療策略至關重要。腫瘤異質性不僅表現在不同患者之間的差異,還表現在同一患者體內不同腫瘤細胞生長和轉移的差異,其導致患者的腫瘤生長速度、侵襲能力、藥物敏感性和預后都存在顯著差異[20]。異質性同樣是卵巢癌的重要臨床特征,研究表明卵巢癌類器官能夠反映患者體內腫瘤的異質性特征[15,21]。Kopper等通過對原發性和轉移性的卵巢癌類器官進行拷貝數變異分析發現,患者腫瘤的拷貝數變化只存在于轉移部位,而且這些拷貝數變異在腫瘤和相應的類器官之間高度保守,說明卵巢癌在進化過程中的不同時間點基因組發生了改變,而且卵巢癌類器官可以精確反映腫瘤的異質性[15]。通過單細胞DNA測序分析發現卵巢癌類器官本身的異質性與原始腫瘤樣本具有很大的相似性,表明類器官可以用作研究卵巢癌異質性的有效工具[15]。
3 卵巢癌類器官在抗腫瘤藥物測試中的應用
新藥研發是一個復雜、漫長、耗資巨大,且失敗率較高的過程。由于缺乏可靠的疾病模型,利用腫瘤細胞系和動物模型開發的大多數藥物在臨床試驗中被證實無效[22-23]。化療是臨床治療卵巢癌的重要手段,近年來針對卵巢癌患者的分子靶向治療也顯示出了廣闊的應用前景,然而,靶向藥物僅對部分患者有效,患者對化學藥物的敏感度也存在差異。腫瘤類器官作為新的臨床前疾病模型在臨床治療藥物篩選上具有巨大的潛力和價值。基因組分析發現高達50%的HGSOC患者具有DNA修復缺陷,通常是乳腺癌1號基因(breast cancer 1,BRCA1)或乳腺癌 2號基因(breast cancer 2,BRCA2)突變引起的。Hill等通過測試22名患者腫瘤組織制備的33例HGSOC類器官在同源重組和復制叉保護上的缺陷發現,無論發生哪一種DNA修復基因突變,類器官中同源重組功能的缺陷都與聚腺苷二磷酸核糖聚合酶 [poly(ADP-ribose)polymerase,PARP] 抑制劑的敏感性相關,因此PARP抑制劑可能是這些患者的潛在治療藥物[14]。此外,復制叉保護的功能缺陷也與卡鉑、細胞周期檢測點激酶1(checkpoint kinase 1,CHK1)和共濟失調毛細血管擴張突變基因Rad3相關激酶(ataxia telangiectasia and Rad3 related,ATR)抑制劑的敏感性相關[14]。與基因組分析方法相比,基于類器官模型進行功能測定能更準確地預測臨床治療效果。將卵巢癌類器官的基因組分析和功能測試相結合,可以更好地識別靶向DNA損傷和修復缺陷。Kopper等利用56例患者的卵巢癌類器官,測定了其對臨床治療方案中常用的鉑類與紫杉醇類和非鉑類藥物的敏感性,以及在復發性疾病中獲得的化學耐藥性,研究發現不同患者來源的卵巢癌類器官對藥物的反應存在明顯差異,顯示出類器官對藥物反應的多樣化,表明卵巢癌類器官有望作為預測患者臨床化療效果的臨床前模型[15]。
近期的幾項研究也顯示了卵巢癌類器官作為臨床前模型的潛在價值。Maenhoudt等通過測試臨床常用的化療藥物(紫杉醇、卡鉑、阿霉素、吉西他濱)在HGSOC類器官中的反應發現,卵巢癌類器官對化療藥物表現出特異的敏感性,不同藥物對同一患者來源的類器官也產生差異化的效果,表明卵巢癌衍生的類器官對于藥物篩選具有潛在的適用性[16]。另一項研究納入了23名經全基因組測序的卵巢癌患者,他們的卵巢癌類器官維持了原始腫瘤病變的基因組特征,并重現了患者對新輔助卡鉑與紫杉醇聯合治療的反應,研究還發現卵巢癌類器官對化療藥物和靶向藥物的反應表現出患者間和腫瘤內部對藥物反應的異質性[19]。此外,Nanki等利用23種FDA批準的藥物在原發性卵巢癌患者制備的類器官上進行了敏感性測試,表明這些類器官培養物可用于篩選有效的個性化的治療藥物[18]。Chen等開發了以HGSOC惡性滲出標本為原料的類器官培養模型,這種標本可以在體外快速產生類器官,并至少能存活6天[24]。使用這些類器官進行藥物敏感性試驗可以篩選出具有治療潛力的藥物,有助于篩選新藥或為現有的治療方案提供個性化的選擇。
近年來,卵巢癌類器官的相關研究都顯示出其在臨床藥物治療效果預測上的巨大潛力,表明以卵巢癌類器官進行藥物測試指導個體化臨床治療的思路具有實踐價值。鑒于卵巢癌類器官對體內腫瘤的基因表達譜和臨床特征的保持,可以對患者腫瘤來源的類器官進行大規模培養,并進行高通量藥物篩選,以找到適合每位患者的最佳治療方案。
4 結語
卵巢癌類器官是卵巢癌病變組織的潛在“替身”,它能夠精確還原患者體內腫瘤的復雜結構、功能特征以及對藥物的反應,進而成為患者個性化治療的臨床前模型,極大推動卵巢癌轉化醫學和精準醫學的發展進程。類器官培養技術還可從正常組織、癌前病變、低度惡性腫瘤到高度惡性腫瘤的過程中培養不同類型的類器官,用于分析基因突變和病理特征,實現早預防、早發現、早治療,對于卵巢癌的早期篩查具有重要意義。
目前的類器官模型仍存在缺陷,如其本質仍是體外模型,缺乏與腫瘤微環境成分(如基質、血管、免疫細胞、微生物群等)的相互作用。相關研究提出通過類器官與生物工程技術相結合(如類器官芯片)來克服上述缺陷。未來的挑戰是將微環境的成分與卵巢癌類器官進行共培養,開發出更貼合生理狀態的模型,以分析感染物、免疫系統和癌癥進展之間的聯系。盡管目前腫瘤類器官技術仍存在一定局限,尚需進一步優化以用于疾病建模和個性化醫療,但類器官仍是腫瘤基礎研究和轉化醫學研究中的重要工具,有助于推動卵巢癌個體化精準醫療的發展。

