一沙一世界
潘磊
我們無論是體內還是體外,都時時刻刻處于微生物的包圍之中,它們無處不在。人體中有它們,土壤里有它們,大氣中有它們,海洋里有它們,淡水中也有它們,甚至火山熔巖、鹽湖深底、宇宙太空都有微生物的身影。
前人對微生物的認識
縱觀歷史,其實古代先賢對于微生物的利用遠遠早于我們能真實地觀察到它們。考古學家發現,早在公元前7000年的新石器時代,中國就有了利用微生物發酵大米、蜂蜜和水果而成的雞尾酒飲料。1991年在意大利阿爾卑斯山上發現的奧茲冰人,生活在5300多年前,其身上也留存有利用真菌緩解萊姆病(一種以蜱為媒介的螺旋體感染性疾病)的證據。古希臘人在很早的時候就意識到“壞空氣”(miasmatic odors)中存在“看不見”的東西,可以傳播疾病,從而提出了衛生學的初步理念——隔離可以很好地阻斷疾病的擴散。甚至在圣經中(《舊約—利未記》第13章)都清晰地描述了對麻風和其他傳染病如何開展有效的隔離。可悲的是,面對新冠疫情的突顯,西方似乎早已忘記了這一原則和衛生學常識。
“西方醫學之父”古希臘科學家希波克拉底(Hippocrates,前460年—前370年)也曾指出病人或他們所處的環境中含有“致病的因素”。古希臘科學家瓦羅(M. T. Varro,前116年—前27年)則進一步給出了微生物的概念:“我們必須注意病患所處的環境,因為空氣中漂浮著我們看不見的微小生物,它們可以通過口腔和鼻孔進入我們的身體,從而引發嚴重的疾病。”這在當時已經是非常準確、非常了不起的認知了。現代微生物學可以說起源于列文虎克(A. van Leeuwenhoek, 1623—1723)的顯微鏡時代,他首次在雨滴中直接觀察到這些微小的生物。之后,偉大的科學家巴斯德(L. Pasteur, 1822—1895)真正讓我們對于微生物的認知越升了一個量級。他首次分離了單一的微生物菌株,提出了發酵的概念,發明了“巴氏滅菌法”。之后,德國科學家科赫(R. Koch, 1843—1910)提出了著名的“科赫法則”,將人類疾病和單一致病菌株關聯起來。
微生物群和腸道共生菌
近10年來,一個新名詞——微生物群(microbiota)逐漸被大家所認知。它特指一種生態學的群體概念,指征多細胞生物體內、體表或某種局限環境中所形成的相對穩定的微生物群。當然其范疇不限于細菌,也包含古菌、病毒、真菌、原生生物等微生物。如果單指依托于動植物等多細胞生物的微生物群來說,其與宿主的關系大致可區分為:互惠共生(mutualism),即菌群和宿主都從彼此身上獲益;共棲共生(commensalism),多指宿主從菌群獲益而不影響菌群本身(奉獻型);偏害共生(amensalism)和寄生共生(parasitism)則都會對宿主造成傷害,前者不影響自身(損人不利己型),后者還能從宿主獲益(損人利己型)。而無關共棲或稱中立共棲(neutralism),則是雙方相安無事,僅僅是生活在一起,互不影響。
在人體上,與我們共棲的微生物菌群就是人類共生菌。1880年代中,奧地利科學家埃斯克里奇(T. Escherich)第一次提出細菌長期共棲于人體的科學證據,他發現的這種細菌就是大名鼎鼎的大腸桿菌(Escherichia coli),后人用埃斯克里奇的姓氏命名了這種細菌。現如今,人體上已被發現擁有上千種細菌,數量超過百億。它們分布于人的口腔、腸道、肺臟、陰道、眼瞼、耳蝸、皮膚等等可以和外界進行交換的黏膜組織中。但更有意思的是,這些菌群在人體上的分布也不是隨機的。不同組織部位所共棲的共生菌群存在著顯著的種類差異和特異性。這取決于菌群在所處部位與宿主之間功能互作的結果。當然,我們人體也不是天生就擁有穩定的共生菌群結構。雖然,有報道稱胎兒在羊水中就已開始接收母體帶來的外源共生菌。但總體的認識是,我們從出生那一刻起開始真正大量地獲得共生菌的定殖,這一階段大概要歷時3年時間,進而菌群在每個個體中趨于動態的平衡和穩定。
腸道具有人體里表面積最大的黏膜層,是人體和微生物交互作用的主戰場。腸道共生菌也是迄今被研究得最多、種類最多、數量最多,以及功能最多樣的人體共生菌類群。僅人體腸道所含有的細菌數就有1012,是人體自身細胞數的10余倍。這些共生菌所含的基因數是人類自身基因數的150多倍。所以,不難理解腸道共生菌對人類個體的影響也必然是巨大且顯著的,無論是發育還是衰老,代謝還是免疫,行為還是認知,其對人體的影響無處不在。難怪有科學家聲稱,腸道共生菌一直是人體“被遺忘的器官”。
影響腸道共生菌的因素
不論是我們出生后的菌群塑造過程,還是菌群已在人體內形成較為穩定組成的成熟階段,腸道共生菌始終處于動態變化中,這種變化受到很多因素的影響。如飲食習慣,不同營養物質的攝入,必然導致腸道生理環境的不同,自然催生了可特異利用這種環境或營養代謝物質的細菌滋生。從大的范圍來說,愛吃甜食的江浙人士和喜食辣椒的川貴人群,他們的腸道菌組成就截然不同。換言之,這些菌群的存在也是保證川貴人群的腸胃更加耐受辣椒的重要因素之一,不至于發生像其他地方的人們初食爆辣而疾奔如廁的囧樣。從小的范圍來講,每一戶人家都有著自己的口味和飲食習慣。你和鄰居的腸道共生菌也存在著不小的差異。甚至有證據表明,我們的進食和口味選擇也受到腸道菌的控制。有時候,真的不是你想吃飯,而是你的腸道菌“喊”你吃飯,而且還有著明顯的口味偏好[1,2]。同理,營養不良人們的腸道共生菌與健康人群的也存在著極大的差異。世界衛生組織的研究也發現,在尚不能有效恢復營養不良人群的腸道菌群之前,即使提供充足的食物,也不能有效改善這些人的身體狀況[3]。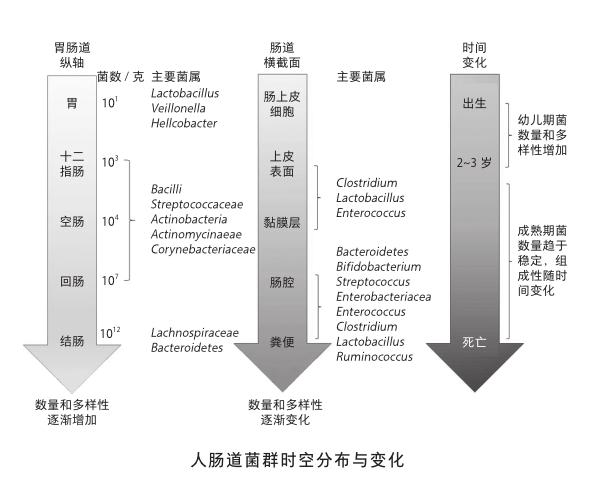
地域環境也是很好理解的影響腸道菌組成的重要因素之一[4]。全球不同的氣候、環境,以及差異性衛生條件,都極大地制約著每個人的菌群發展。你碰不到的菌,自然就沒機會在你體內定殖。菌群的差異也是水土不服的影響因素之一。甚至有研究發現,經常進行全球商務飛行的人士所伴隨的腸胃不適與自身腸道菌群不能及時適應密切相關[5]。另一個很好理解的因素就是藥物的使用,尤其是抗生素和某些疫苗,都會顯著改變我們腸道共生菌的構成。有研究表明,無論是母親在懷孕期間,還是幼兒階段,不恰當地使用抗生素,都可能轉變小兒的腸道菌環境,從而極易引發成年后的哮喘疾病[6]。其實我們的腸道菌構成是非常脆弱的,僅僅一次簡單的抗生素治療,就可以立時破壞我們腸道共生菌的群落結構,而在停藥后,需要花費數月甚至更長的時間才能恢復到原先的多樣化水平。但即使這樣,重塑的菌群結構也會與用藥前存在顯著的差別,可以說這是一個不可逆的過程。根本原因在于,腸道共生菌環境是一個相對和諧的小型生態環境。雖然抗生素只對部分種類細菌有效,但是單一菌種的破壞,很容易通過微生物之間的互相作用,放大到對整個生態環境的破壞。例如,肥胖癥、糖尿病、哮喘等疾病都與抗生素治療的不良反應密切相關。
影響腸道共生菌的因素還有很多,比如本身的遺傳基因背景、運動情況、心情的好壞、年齡等等。這里僅再強調一點,那就是我們偉大的母親。母親在孕前、孕中、產后的生活習慣會極大地影響胎兒的腸道菌塑型,從而會對成年后的個體健康產生一生的影響。例如,順產和母乳喂養就比剖腹產和奶粉喂養,在幼兒腸道菌多樣化形成中具有更大優勢,能顯著降低幼兒過敏、哮喘甚至自閉癥等疾病的發生概率。所以,請再次感謝我們的母親吧!
前面提到腸道共生菌群在我們個人之間存在著差異,其實即使在每個個體之中,它們的組成與分布也是有著時空的特異性。按照腸胃軸的縱向分布,腸道共生菌無論是細菌數還是種類的多樣性,基本是按照胃—十二指腸—空腸—回腸—結腸的空間順序逐次增加。僅結腸的含菌量甚至都能達到胃部含菌量的1011倍。如果從腸道的橫截面來看,由糞便中心逐次向外,腸腔—黏膜層—腸上皮層表面也都特異定殖著不同類別的菌群。當然,之前提到過的時間軸就更是如此,從出生—幼年—成年—老年,腸道共生菌都在不停地變化著。這也是為什么很多老年疾病的發生和發展與腸道共生菌的失衡密切相關。
腸道微生物研究面臨的挑戰和前景
鑒于腸道共生菌如此重要,各國科學家陸續提出各種人類共生菌研究方面的計劃。從2005年至今,至少已有8個較大的微生物方面的研究計劃在實施,如美國的人類微生物組項目、加拿大的微生物組倡議、歐洲和中國共同參與的“人類腸道宏基因組計劃”(MetaHIT),以及日本的人類宏基因組聯盟等。科學家希望首先建立涵蓋人類共生菌的巨大的基因信息庫,追蹤共生菌的動態變化規律,了解其與疾病之間的關系。近年來,微生物組學的研究伴隨著科技的發展而突飛猛進,比如單細胞基因組學的發展、宏基因組和轉錄組學的建立、大數據體系和新型數學算法的開發等,都為微生物群組的研究鋪平了道路。科學家研究的最終目標是希望能回答兩個重要的科學問題:健康的人類共生菌微生態是如何塑造的,它又是如何保持和修復的。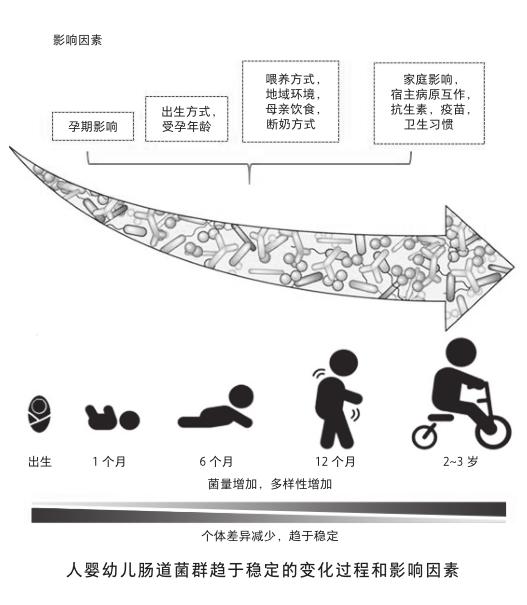
現階段,人類共生菌的研究還面臨著很多困難。首先,腸道中絕大數多數的區域處于無氧環境,很多共生菌自然是厭氧細菌,且它們的生長環境苛刻,甚至要依賴于其他細菌才能存活。這就導致科學家僅能通過大規模測序了解有些細菌的存在,但始終無法將它們分離出來,并在體外培養,所以很難深入了解它們的生物特質。第二,即使測序比對能夠讓我們了解某些細菌的存在,但對于如此龐大的細菌種類,絕大多數細菌的基因組信息尚未被有效收集。也就是說,即使你獲得了新的基因序列,卻苦于沒有“字典”,根本就不知道它是什么。所以信息數據庫的建立也是全球微生物研究計劃的首要任務。第三,雖然很少的功能細菌已經被解析,但是如何讓這些細菌通過回輸方式穩定地“扎根”在新宿主體內從而發揮功能,還是一個很棘手的問題。人體并不像我們研究的無菌動物模型,它含有大量共生菌。即使疾病已導致腸道菌群的紊亂,但這些混亂的細菌也相應地形成了較為和諧的局面。如何讓“有益的”治療菌打破這種平衡,從而讓其自身穩定定殖,進而形成新的平衡,這是極具挑戰性的。因為不僅宿主和微生物存在活躍的互動,微生物之間也存在著各種競爭或依存關系。此外,個體的差異也限制了共生菌治療的有效開展。畢竟同樣的菌群“雞尾酒”配方,肯定不可能適合所有存在巨大共生菌個體差異的患者。這也是精準醫療必須要解決的首要問題。
但也無需過于悲觀,人體共生菌的應用其實早已展開潛移默化的應用。比如枯草芽孢桿菌、酵母菌早就應用于嬰幼兒的腹瀉和消化不良,比如我們常食用的益生菌食品。還有能夠幫助我們自身合成維生素和氨基酸、分解纖維素的共生菌都已經在食品、保健品或藥物中加以應用。更為復雜的糞菌移植(將健康人糞便中的功能菌群移植到患者胃腸道內,以重建新的腸道菌群,實現腸道及腸道外疾病的治療),也已在臨床醫療中逐步開展。早在1958年,美國丹佛的醫生就嘗試用健康人的糞便,給爆發性的腸炎病人灌腸,用來緩解由于抗生素處理而造成的腸道菌群紊亂。當然,那時還沒有提出精確的治療理念,僅是知道這種方法可以很好地在人體腸道中重建“自然”[7]。50多年后,醫生們通過臨床實驗發現,引發頑固性小腸炎的艱難梭菌(Clostridium difficile)很容易在抗生素治療后復發,即使用強力的萬古霉素也很難將其清除干凈。但是如果通過十二指腸回輸健康人群的糞便,要比抗生素處理更能顯著地降低艱難梭菌的復發感染[8]。這之后,糞菌移植的療效也在器官移植、自閉癥、潰瘍性腸炎、腹瀉等臨床疾病中得以證實。甚至有人開玩笑地說“去吃屎吧”,這也許并不再是罵人的話。
此外,隨著微生物組學計劃的開展和共生菌研究的深入,很多具有想象力的應用前景也陸續出現在我們面前。例如,基于個人共生菌群的專一性,有人提出可將它作為我們的“分子指紋”。同樣,這些個人的共生菌基本信息也將是我們未來能夠開展精準醫療的基礎與前提。當然,各類以共生菌為配方的“雞尾酒”藥方也在如火如荼的發展中。可以想象,未來這種生物藥物將會有更為廣闊的市場。甚至還有科學家提出,學會構架共生菌微生態也將是我們未來星際殖民的有利輔助,如果能夠在外星球首先定殖類地和對人類有益的共生菌界面,對于新星球環境的改造和后期的順利殖民將起著至關重要的作用。正如馬克思的墓志銘上所寫名言的含義所指:科學家不應滿足于對事物的描述,而是要想辦法能夠改變并利用它。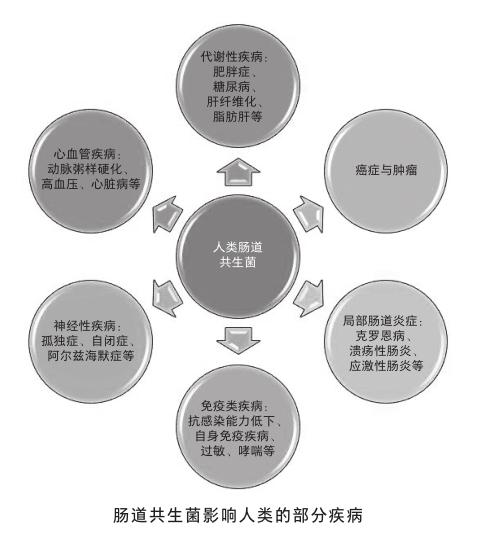
[1]Breton J, Tennoune N, Lucas N, et al. Gut commensal E. Coli proteins activate host satiety pathways following nutrient-induced bacterial growth. Cell Metab, 2016, 23: 324-334.
[2]Leit?o-Gon?alves R, Carvalho-Santos Z, Francisco A P, et al. Commensal bacteria and essential amino acids control food choice behavior and reproduction. PLoS Biology, 2017, 15: e2000862.
[3]Blanton L V, Charbonneau M R, Salih T, et al. Gut bacteria that prevent growth impairments transmitted by microbiota from malnourished children. Science, 2016, 351: 6275.
[4]Yatsunenko T, Federico E R,Manary M J. et al. Human gut microbiome viewed across age and geography. Nature, 2012, 486: 222-227.
[5]Dey N, Wagner V E, Blanton L V, et al. Regulators of gut motility revealed by a gnotobiotic model of diet-microbiome interactions related to travel. Cell, 2015, 163, 95-107.
[6]Mets?l? J,Lundqvist A,Virta L J, et al. Prenatal and post-natal exposure to antibiotics and risk of asthma in childhood. Clin Exp Allergy, 2015, 45: 137-145.
[7]Kelly C P. Fecal microbiota transplantation—an old therapy comes of age. N Engl J Med, 2013, 368: 474-475.
[8]Van Nood E, Vrieze A, Nieuwdorp M, et al. Duodenal infusion of donor feces for recurrent Clostridium difficile. N Engl J Med, 2013, 368: 407-415.
關鍵詞:微生物 微生物群 腸道共生菌 人體 遺忘的器官 ■

