血清微小RNA-21、顆粒體蛋白前體對無創機械通氣早產兒呼吸窘迫綜合征預后的預測價值
郭中林
河南省林州市婦幼保健院兒科 456550
早產兒呼吸窘迫綜合征(Respiratory distress syndrome,RDS)是指28周左右的胎兒,由于肺還未發育完整,肺泡表面缺少肺泡表面活性物質,導致肺泡張不開,不能吸入氧氣進行血氧交換而引起的呼吸困難與急促[1]。該病胎齡越小得病率越高,起病急、進展迅速且病死率較高。臨床常采取無創機械通氣治療本病,能在一定程度上緩解疾病癥狀,輔助肺部氣體交換,改善通氣狀況和缺氧狀態。目前,關于RDS的發病及進展機制尚不明確。有學者表明RDS的致病因素與炎性因子失衡密切相關。血清微小RNA(microRNAs,miRNAs)是一類具有調控功能的內源性非編碼單鏈小RNA分子,可參與炎癥反應的調控過程,且有研究表示miRNA-21與RDS炎癥中炎性因子表達密切相關[2]。顆粒體蛋白前體(Progranulin,PGRN)是組織中分布廣泛、功能多樣的一個生長因子家族,是體內一種自分泌抗炎蛋白,具有調節炎癥反應的作用[3]。因此,本研究對行無創機械通氣的呼吸窘迫綜合征早產兒進行miRNA-21及PGRN檢測,以探究其對該病的預后預測價值。
1 資料與方法
1.1 一般資料 選取2019年1月—2020年3月收入我院的行無創機械通氣的早產兒RDS 130例為觀察組,男74例,女56例;胎齡28~35周,平均胎齡(31.08±3.14)周;出生時體重1.09~3.24kg,平均出生時體重(1.93±0.64)kg;出生時阿氏(Apgar)評分5~9分,平均Apgar評分(7.05±1.21)分;妊娠方式:剖宮產112例,陰道分娩18例;納入標準:(1)符合歐洲2019年頒布的“新生兒呼吸窘迫綜合征防治指南”[4]中早產兒RDS的相關診斷標準;(2)經影像學檢查及血氣分析等檢查確診為早產兒RDS;(3)28周<胎齡<35周出生早產兒;(4)72h內出現了呼吸加快等RDS典型癥狀。排除標準:(1)由心力衰竭或其他原因導致的呼吸窘迫綜合征;(2)出生時體重<1kg;(3)存在先天呼吸系統畸形或先天性心臟病;(4)伴有自身免疫系統障礙或重度感染;(5)存在宮內窒息。將同期住院的83例非RDS早產兒作為對照組,男49例,女34例;胎齡28~35周,平均胎齡(31.12±3.18)周;出生時體重1.11~3.27kg,平均出生時體重(1.96±0.69)kg;出生時Apgar評分5~9分,平均Apgar評分(7.13±1.28)分;妊娠方式:剖宮產69例,陰道分娩14例;納入標準:(1)經病史及超聲輔助檢查確診為早產兒;(2)28周<胎齡<35周出生早產兒。排除標準:(1)無自主呼吸或自主呼吸不強;(2)出生時體重<1kg;(3)有出生窒息史或先天心肺發育不良;(4)多胎妊娠。比較兩組患者一般資料無意義(P>0.05),具有可比性。本研究經醫院醫學倫理會審核并通過,患兒家屬知情并簽署同意書。
1.2 方法 兩組患兒均給予心電監護、保暖、預防感染、保持呼吸道通暢、氧療及補液等對癥治療。觀察組在此基礎上給予無創機械通氣輔助呼吸,采用嬰兒型專用定壓呼吸機(SLE2000)并根據患兒實際情況,選擇合適的鼻罩或面罩,連接通路進行通氣治療。呼吸機參數:氧濃度(FiO2)40%~60%,呼吸頻率(RR)40次/min,呼氣末正壓(PEEP)4cmH2O(1cmH2O=0.098kPa),峰值吸氣壓(PIP)12.5cmH2O。
1.3 觀察指標 兩組患兒均于入院時抽取空腹外周血液樣本3ml,送至檢驗科離心分層,取血清,保存備用。采用酶聯免疫法檢測miRNA-21及PGRN水平,試劑盒由Abcam公司提供,所有操作均嚴格按照說明書步驟進行。根據早產兒RDS預后情況分為存活組與死亡組,并收集兩組患兒的臨床資料,包括性別、胎齡、出生體重、呼吸急迫出現時間、分娩方式、胎膜早破、氧合指數(PaO2/FiO2)、miRNA-21及PGRN水平等,進行分析比較、評估。
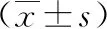
2 結果
2.1 治療前觀察組與對照組miRNA-21及PGRN水平比較 觀察組治療前miRNA-21及PGRN水平均高于對照組(P<0.05)。見表1。
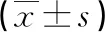
表1 治療前觀察組與對照組miRNA-21及PGRN水平比較
2.2 存活組與死亡組臨床資料單因素比較 死亡組出生體重低于存活組(P<0.05),miRNA-21及PGRN水平均高于存活組(P<0.05);而其余各指標比較無統計學意義(P>0.05)。見表2。
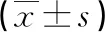
表2 存活組與死亡組臨床資料單因素比較
2.3 早產兒RDS發生死亡的Logistic回歸分析 將表2中具有統計學意義的相關因素進行Logistic回歸分析,得到出生體重、miRNA-21及PGRN水平是早產兒RDS發生死亡的獨立危險因素(P<0.05)。見表3。

表3 早產兒RDS發生死亡的Logistic回歸分析
2.4 miRNA-21及PGRN預測早產兒RDS死亡的ROC曲線分析 經ROC曲線分析,得到miRNA-21聯合PGRN預測的ROC曲線下面積、敏感度及特異度均高于miRNA-21和PGRN單獨預測面積、敏感度及特異度(P<0.05)。見表4、圖1。

圖1 miRNA-21及PGRN預測早產兒RDS死亡的ROC曲線

表4 miRNA-21及PGRN預測早產兒RDS死亡的ROC曲線分析
3 討論
RDS是新生兒最常見的疾病之一,其中早產兒最為多見,該病主要以盡快恢復正常通氣為治療原則,盡管早期積極使用無創機械通氣改善呼吸減低死亡率,但早產兒RDS的總體死亡率仍較高[5]。目前臨床關于早產兒RDS預后尚無統一指標,故尋找靈敏度和特異度較高的標志物來評估判斷早產兒RDS預后具有重要作用。
miRNA-21是一種靶向作用于mRNA,使mRNA沉默或抑制翻譯的轉錄后調節微小RNA,近年來,多數研究學者將其作為生物標志物,廣泛研究其在RDS發生發展中的靶向調節作用[6]。PGRN是一種多功能生長因子,可參與損傷修復、腫瘤進展及神經退行性病變等,在疾病炎癥過程中發揮重要作用,不同的組織和不同的炎癥PGRN能通過不同的信號通路,發揮抗炎或促炎作用[7]。近期有學者表示,PGRN能減輕誘導實驗鼠肺損傷,抑制細胞凋亡,說明PGRN可作為治療RDS的重要研究方向[8]。本研究結果顯示,觀察組治療前miRNA-21及PGRN水平均高于對照組,提示miRNA-21及PGRN水平的高表達與早產兒RDS的發生發展具有一定關系。
RDS可引起肺纖維化,從而加重病情。有研究表示,RDS血液中miRNA-21高水平表達,可促進肺纖維化,導致病情加重[2]。miRNA-21水平升高后可調控炎性因子,并激活炎性反應,進一步損傷肺組織,導致肺功能及氣體交換受損,出現呼吸困難或呼吸衰竭的癥狀。有學者表示,PGRN高表達水平時可調節和誘導慢阻肺患者上皮細胞凋亡,慢阻肺患者PGRN越高其肺功能越低,有可能作為預測慢阻肺預后的指標之一[9]。本研究結果顯示,死亡組出生體重低于存活組,miRNA-21及PGRN水平均高于存活組,說明出生體重輕且miRNA-21及PGRN高水平表達患兒的預后較差。本研究結果顯示,經Logistic回歸分析,得到出生體重、miRNA-21及PGRN水平是早產兒RDS發生死亡的獨立危險因素,說明低體重出生兒及高水平miRNA-21及PGRN是早產兒RDS發生死亡的危險因素。但出生體重對于影像學和血氣分析等檢查較為局限,精準度不高,故不納入曲線分析。
早產兒心肌細胞對缺氧缺血極度敏感。早產兒RDS肺循環阻力增大、缺氧及炎癥反應等均可造成心肌細胞微循環障礙和代謝異常,導致心肌細胞通透性增加,且由于受損的心肌細胞膜外滲導致血液中miRNA-21及PGRN水平升高[10]。有學者表示,可通過檢測miRNA-21評估RDS的預后情況[11]。也有學者表示,PGRN參與了早產兒RDS的發生發展,且與疾病的預后密切相關,具有一定的檢測價值。鑒于單一的指標預測能力仍存在不足,本研究將兩種指標聯合進行檢測,結果顯示,經ROC曲線分析,得到miRNA-21聯合PGRN預測的ROC曲線下面積、敏感度及特異度均高于miRNA-21和PGRN單獨預測面積、敏感度及特異度,提示miRNA-21及PGRN聯合預測能力較高,將其應用于臨床,能有效提高臨床決策能力。
綜上所述,miRNA-21及PGRN水平在早產兒呼吸窘迫綜合征中顯著增高,是引起該類患兒死亡的獨立危險因素,且兩者聯合檢測能顯著提高預測能力,對評估早產兒呼吸窘迫綜合征預后具有較高的臨床價值。

