基線誘導型共刺激因子水平與食管癌術后病人預后的相關性分析
劉貞 趙懷才 劉東岳 李秀昌 劉鵬飛
食管癌早期多無明顯癥狀,隨著疾病的進展出現進行性吞咽困難[1]。有研究表明,對于食管癌T1a和T1b期病人內窺鏡切除術是首選的治療方式[2]。一項薈萃分析顯示,接受食管癌切除術的病人,約半數病人在術后2年內出現復發、疾病進展[3]。Enane等[4]回顧性研究指出,不同分化程度食管癌術后預后存在差異;袁俊等[5]研究指出腫瘤淋巴轉移與食管癌預后關系密切,認為高腫瘤浸潤淋巴細胞是食管癌切除術術后獨立的良好預后因素。關于食管癌免疫逃逸機制的研究發現,調節性T細胞(Tregs)分泌表達的誘導型共刺激因子(Inducible costimulator,ICOS)在維持免疫耐受中起重要作用,并參與了免疫逃逸和抑制抗腫瘤免疫應答過程[6]。關于胃癌預后的相關性因素分析指出,ICOS表達水平可作為預測預后不良的生物標志物,靶向ICOS-L/ICOS共刺激軸可作為治療胃癌的潛在治療方法[7]。本研究探討基線ICOS表達水平與食管癌切除術病人短期預后的相關性。
對象與方法
一、對象
2016年6月~2018年4月我院胸外科診斷及治療的食管癌病人139例,其中男性84例,女性55例;年齡40~70歲,平均年齡(55.96±9.86)歲;隨訪2年后,120例病人完成隨訪。120例病人中出現預后不良55例,作為預后不良組,未出現預后不良65例,作為預后良好組;以ICOS表達水平中位數為界值,分為ICOS低表達組(60例)和ICOS高表達組(60例)。納入標準:(1)符合食管癌診斷標準,并通過術前病理檢測確診為食管癌[8];(2)無肺,肝,腦,腎和腎上腺等轉移;(3)術前病理檢測為食管鱗狀細胞癌;(4)簽署知情同意書。排除標準:合并其他器官或組織腫瘤;合并嚴重心肺功能疾病、營養狀況差及呈惡液質樣者;繼發性食管癌;瘤體已與主要器官,如主動脈、氣管等緊密粘連而不能切除;依從性差,不配合隨訪。本研究經我院倫理委員委員會批準。
二、方法
1.治療方法:參照2014年版中華醫學會內鏡學分會制訂的《中國早期食管癌篩查及內鏡診治專家共識意見》的手術治療原則及方案進行治療[9]。
2.基線ICOS表達水平檢測:利用免疫組織化學染色技術,經10%中性甲醛溶液固定,石蠟包埋以5 μm切片,石蠟切片以二甲苯脫蠟,乙醇水化;完成后采用0.3%雙氧水孵育15分鐘,微波抗原修復15分鐘;冷卻至室溫后充分水洗,采用10%牛血清白蛋白封閉30分鐘;滴加經PBS稀釋的ICOS抗體(1∶300),4 ℃孵育過夜;使用通用型HRP生物標記素標記二抗孵育30分鐘;DAB顯色后,蘇木素復染,乙醇脫水,二甲苯透明,中性樹脂封片鏡檢。光學顯微鏡下隨機觀察10個高倍視野,結合染色強度進行半定量評分。評分標準[9]:計數陽性細胞百分比,<25%為1分,25~50%為2分,>75%為3分。細胞著色輕度:淡黃色為1分,棕黃色2分,棕褐色為3分。以陽性細胞百分比得分×著色強度得分為最終評分,1~3分為低表達,≥4分為高表達。
3.觀察指標:收集兩組病人人口學資料,包括年齡、性別、BMI等;既往史,包括高血壓、手術史等;實驗室及病理檢查資料,包括腫瘤TNM分期、腫瘤位置、大小、手術入路、手術方式、淋巴清掃情況等。
4.隨訪:兩組病人均門診隨訪2年,隨訪術后預后情況,隨訪截止時間2020年4月27日。參照世界衛生組織(WHO)發布的實體瘤療效評價標準(RECIST1.1)評定,分為4個等級[10]:進展、穩定、部分緩解、完全緩解。預后不良=進展;預后良好=穩定+部分緩解+完全緩解。
三、統計學處理
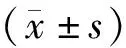
結果
1.隨訪結果:隨訪截止時間2020年4月27日,139例病人共計120例病人完成隨訪,失訪率為13.67%,最終納入120例食管癌病人,共計55例病人出現預后不良。見表1。
2.預后不良組與預后良好組病人臨床資料比較:預后不良組與預后良好組淋巴結轉移、分化程度、淋巴結清掃數目、基線ICOS表達水平比較差異有統計學意義(P<0.05),其余組間比較,差異無統計學意義(P>0.05)。見表1。

表1 預后不良組與預后良好組病人臨床資料比較
3.食管癌切除術病人短期預后不良風險預測因素分析:Logistics多因素回歸分析顯示,淋巴結轉移(OR=0.132)、分化程度(OR=0.359)基線ICOS低表達(OR=0.303)是食管癌切除術術后病人預后不良的危險因素。見表2。

表2 多因素Logistics分析
4.兩組病人預后不良風險比較:K-M生存分析曲線顯示,基線ICOS高表達組病人預后不良風險低于基線ICOS低表達組(log-rank χ2=7.934,P=0.005)。見圖1。

圖1 兩組食管癌切除術術后病人預后不良風險發生風險比較
5.基線ICOS表達水平預測病人預后不良的效能:基線ICOS 表達水平預測病人預后不良風險的AUC為0.726,特異度為72.73%、敏感度為67.69%,優于分化程度、淋巴結轉移。見圖2,表3。

圖2 基線ICOS 表達水平預測食管癌切除術術后病人預后不良的ROC曲線

表3 基線ICOS表達水平預測食管癌切除術術后病人預后不良的效能
討論
食管癌是最常見的惡性腫瘤,5年總體存活(OS)<20%,每年導致超過40萬人死亡[11]。食管癌切除術是治療食管癌的主要方式,然而食管癌切除術術后約50%病人出現預后不良,影響術后生存期[12]。術后病人預后分層在制定最佳治療方式中起著至關重要的作用。目前,用于預測食管癌切除術術后預后情況的因子眾多,包括腫瘤分化程度、淋巴結轉移等。ICOS是一種由Tregs分泌的細胞因子。多項研究表明,ICOS與多種腫瘤疾病的疾病進展和預后不良相關聯[13-15]。盡管機制尚未完全了解,但關于胃癌、直腸癌的研究發現高ICOS表達水平與病人良好預后呈正相關;Solinas等[16]研究證實,ICOS可抑制對宿主的有害免疫反應,表明ICOS參與了腫瘤病人預后過程。本研究通過檢測食管癌病人基線ICOS表達水平,探討其與病人預后的相關性。
ICOS屬B7-CD28免疫球蛋白超家族,是在活化T細胞上表達的活化共刺激免疫檢查點,參與調節T細胞活化和適應性免疫應答,其配體ICOSL在抗原呈遞細胞和腫瘤微環境中的腫瘤細胞上高表達[17]。ICOS和ICOSL的表達與激活免疫反應誘導的可溶性因子的釋放有關。ICOS和ICOSL的結合在T細胞亞群的多樣性中產生T細胞活化和效應子功能,以及由調節性T細胞介導的抑制免疫活性,在增強抗腫瘤免疫應答中具顯著作用。一項關于結直腸癌研究發現,ICOS的高表達與結直腸癌病人的總生存期(OS)顯著相關(n=230,P<0.001);多變量分析證明,ICOS表達是獨立的預后因素,證實ICOS參與了腫瘤的預后過程。在本研究中K-M曲線分析顯示,ICOS高表達組病人預后不良風險低于ICOS低表達組(log-rank χ2=5.971);多因素分析顯示,ICOS低表達水平為病人術后預后不良的獨立風險因素。ICOS主要在CD4+T細胞上表達,表達水平與細胞毒性T淋巴細胞抗原4(CTLA-4)增加和程序性死亡(PD-1)表達有關;介導了調節T細胞功能的關鍵雙向信號,促進和維持T細胞反應的正性第二信號和調節T細胞耐受性的負性第二信號。同時在調節活化T細胞和效應T細胞中起重要作用,可促進腫瘤病人Th1效應子反應,通過腫瘤相關巨噬細胞(TAM)和MDSCs在內的腫瘤相關髓樣細胞通訊來抑制腫瘤細胞的侵襲和轉移[18-19]。ICOS與其配體ICOSL結合通過TAM或腫瘤細胞信號通路中參與CD4+T細胞細胞功能,并可響應在非造血細胞上的炎癥信號傳導。這可能有助于改善食管癌病人術后預后,降低預后不良風險。
淋巴結轉移及低分化程度是食管癌病人術后預后不良的風險因素。腫瘤細胞增殖的復雜過程是由主轉錄因子(TF)MYC協調,TF將祖細胞定型轉入譜系,與MYC共同驅動指數增殖,向正向分化,最終導致細胞周期退出。分化程度與自我復制涉及增殖與該前向分化的脫鉤。細胞凋亡p53(TP53)或其主要輔因子的主要調節劑可抑制癌癥細胞的無限增殖,但在低分化食管癌病人中該機制被普遍滅活,癌細胞的生長、浸潤和轉移無顯著限制因素,同時,腫瘤內形成的大量新生血管網為癌腫的增殖、遷移提供了生存條件,更易出現淋巴結轉移。淋巴結轉移是食管癌治療的重要預后因素和決定性因素,Kashima等[20]一項關于淋巴結轉移的食管癌10年生存率分析顯示,淋巴結轉移病人預后不良比例明顯增高,表明發生淋巴結轉移影響食管癌預后。
本研究通過繪制ROC曲線顯示,ICOS表達水平預測食管癌病人術后預后不良風險的AUC為0.726,特異度為72.73%、敏感度為67.69%,優于淋巴結轉移、分化程度。說明ICOS表達水平預測食管癌病人術后預后具顯著效能,能夠有效幫助臨床醫生識別食管癌病人術后預后不良人群。但限于本研究樣本量較少且僅納入食管鱗狀細胞癌病人,最終結果可能產生一定的偏倚,后期還需要增大樣本量,納入其他型食管癌病人來對本研究結論做進一步驗證。
綜上所述,淋巴結轉移、分化程度、基線ICOS低表達是食管癌病人術后預后不良的危險因數,其中ICOS低表達可作為預測食管癌病人術后預后不良風險的重要指標。

