宮腔鏡聯合左炔諾孕酮宮內節育系統治療子宮內膜息肉的臨床價值分析
劉瑋
子宮內膜息肉屬于婦科最為常見的疾病,好發于育齡期婦女,研究提示其發病率接近20%,目前針對子宮內膜息肉的發病機制研究上尚未完全闡明,考慮與內分泌功能的異常以及遺傳等因素有關,以白帶異常、陰道不規則流血、下腹脹痛等為主要臨床表現[1-2]。目前治療方法多樣,多項指南提示以藥物治療為基礎,手術治療為根治手段[3]。手術方法的選擇上則以清宮術和宮腔鏡微創治療為最常用,明視下宮腔鏡手術可將肉眼所見息肉切除,其切除率與復發率均明顯低于清宮術,但仍有一定的復發率[4]。尤其針對重癥與多發子宮內膜息肉者,復發率明顯增高,故在進行宮腔鏡切除術后還建議聯合藥物治療,以減少復發率,改善患者臨床癥狀,促進內分泌功能早期恢復[5]。為此本研究宮腔鏡聯合左炔諾孕酮宮內緩釋系統治療子宮內膜息肉的臨床價值,現報告如下:
1 資料與方法
1.1 一般資料
選擇2019年1月—2020年1月本院收治的重癥子宮內膜息肉患者80例,入組前簽署同意書并申報醫院倫理委員會批準。診斷上以宮腔鏡術后病理組織活檢明確。納入標準:年齡30~45歲,育齡期,已婚,精神狀況正常。排除標準:惡性病變、精神疾患、心肺肝腎功能障礙、曾行子宮和/或宮頸相關手術、入組前1個月使用性激素和/或孕激素治療、對擬使用藥物過敏等。按照隨機數字表法分為兩組,各40例。觀察組:年齡30~45歲,平均年齡(35.5±1.1)歲,出現臨床表現時間1~7周,平均(3.5±0.5)周,術中所見提示息肉類型:單發18例,多發22例;對照組:年齡30~45歲,平均年齡(35.6±1.2)歲,出現臨床表現時間1~7周,平均(3.6±0.4)周,術中所見提示息肉類型:單發19例,多發21例,兩組年齡、出現臨床表現時間及術中所見提示息肉類型等比較,差異無統計學意義(P>0.05)。
1.2 方法
對照組實施單純宮腔鏡下息肉切除治療,手術時機為月經干凈后1周,使用0.9%生理鹽水膨宮,明視下對肉眼可見息肉進行摘除,針對單發息肉者實施Ⅰ期切除,多發息肉者性電切聯合電凝治療,術后復查經陰道超聲,如息肉未摘除干凈者再次行清宮術治療;觀察組則在對照組基礎上于術后宮腔內置入左炔諾孕酮宮內緩釋系統(拜耳制藥有限公司,國藥準字J20090144,規格52 mg左炔諾孕酮/劑),與宮腔鏡術后如能確定為良性子宮內膜息肉則立即置入子宮內,如無法確定良性者,待病理結果明確良性后立即置入子宮內,同時均使用腹部超聲明確置入位置。
1.3 觀察指標及評定標準
比較兩組治療3個月后不同觀察時間點子宮內膜厚度及血紅蛋白水平變化,比較兩組隨訪期間出現的并發癥,統計治療后1年子宮息肉復發率。其中子宮內膜厚度以經陰道超聲檢查測定為標準;血紅蛋白水平則通過美國貝克曼庫爾特有限公司生產的Immage800型全自動生化儀檢測為標準;隨訪期間出現的并發癥主要觀察經期延長、反復貧血、盆腔感染及下腹痛的發生情況;子宮內膜息肉復發同樣以經陰道超聲檢查提示息肉為標準。
1.4 統計學處理
使用SPSS 20.0進行,計量資料以(±s)表示,兩組間均數的比較使用t檢驗,復發率等以例(%)表示,組間率的比較通過χ2檢驗進行,P<0.05則差異有統計學意義。
2 結果
2.1 兩組治療3個月后不同觀察時間點子宮內膜厚度比較
治療1個月后、治療3個月后,觀察組子宮內膜厚度均顯著小于對照組,差異有統計學意義(P<0.05)。見表1。
表1 兩組治療3個月后不同觀察時間點子宮內膜厚度比較(mm, ±s)
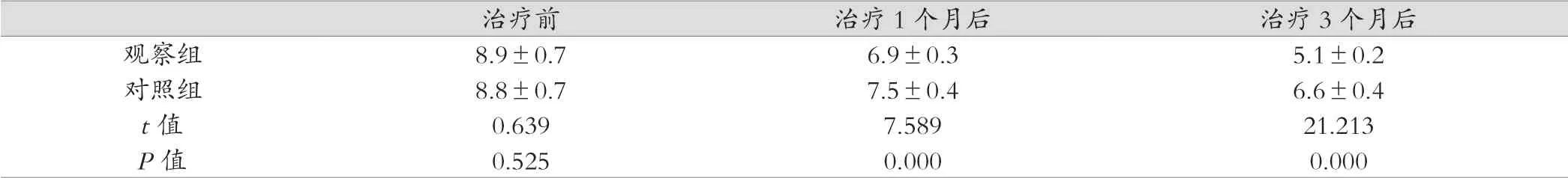
表1 兩組治療3個月后不同觀察時間點子宮內膜厚度比較(mm, ±s)
治療前 治療1個月后 治療3個月后觀察組 8.9±0.76.9±0.35.1±0.2對照組 8.8±0.77.5±0.46.6±0.4 t值 0.6397.58921.213 P值 0.5250.0000.000
2.2 兩組治療3個月后不同觀察時間點血紅蛋白水平變化比較
治療1個月后、治療3個月后,觀察組血紅蛋白水平均顯著高于對照組,差異有統計學意義(P<0.05)。見表2。
表2 兩組治療3個月后不同觀察時間點血紅蛋白水平變化比較(g/L, ±s)

表2 兩組治療3個月后不同觀察時間點血紅蛋白水平變化比較(g/L, ±s)
治療前 治療1個月后 治療3個月后觀察組 78.9±2.589.9±3.8108.7±5.6對照組 78.8±2.680.5±2.685.8±4.3 t值 0.17512.91220.513 P值 0.8610.0000.000
2.3 兩組隨訪期間出現的并發癥比較
觀察組發生經期延長、反復貧血、盆腔感染及下腹痛的總比例顯著低于對照組,差異有統計學意義(P<0.05)。見表3。

表3 兩組隨訪期間出現的并發癥比較
2.4 治療后1年隨訪子宮內膜息肉復發率比較
治療后1年隨訪觀察組子宮內膜息肉復發例數為1例,對照組子宮內膜息肉復發例數為9例,觀察組治療后1年子宮內膜息肉復發率顯著低于對照組,差異有統計學意義(χ2=7.314,P=0.007<0.05)。
3 討論
以往研究證實子宮內膜息肉在育齡期婦女中發病率高達20%,臨床上以不規則陰道流血、月經紊亂、不孕癥為多見[6]。治療則以藥物為基礎,手術治療為首選,常用的方法有超聲引導下清宮術,但對肉眼可見的微小息肉無法做到有效摘除,以及盲探操作造成子宮內膜損傷等[7]。宮腔鏡下息肉摘除則通過明視觀察,對于微小息肉亦能達到治療效果,但對于重癥患者尤其是多發微小息肉者,單純應用宮腔鏡治療,存在一定的術后復發率,同時因手術對子宮內膜的影響而導致術后月經周期恢復慢[8]。故有部分學者推薦圍術期聯合藥物干預,以便更有效的改善月經周期減少術后復發[9-10]。
針對子宮內膜息肉患者,觀察組在對照組使用宮腔鏡手術同時聯合應用左炔諾孕酮宮內緩釋系統干預,比較兩組治療3個月后不同觀察時間點子宮內膜厚度及血紅蛋白水平變化發現,治療1個月后、治療3個月后,觀察組子宮內膜厚度均顯著小于對照組,觀察組血紅蛋白水平均顯著高于對照組。說明針對子宮內膜息肉患者在使用宮腔鏡術后聯合宮內置入左炔諾孕酮宮內緩釋系統,能有效改善治療后子宮內膜厚度,調節月經周期,減少出血,進而提高機體血紅蛋白水平[11]。另外比較兩組隨訪期間出現的并發癥發現,觀察組發生經期延長、反復貧血、盆腔感染及下腹痛的總比例顯著低于對照組。證實針對針對子宮內膜息肉患者在使用宮腔鏡術后聯合宮內置入左炔諾孕酮宮內緩釋系統,對減少治療期間并發癥,提高治療安全性有一定價值[12]。最后比較術后1年隨訪子宮息肉復發率發現,術后1年隨訪觀察組息肉復發例數為1例,對照組息肉復發例數為9例,觀察組術后1年息肉復發率顯著低于對照組。進一步證實針對子宮內膜息肉患者在使用宮腔鏡術后聯合宮內置入左炔諾孕酮宮內緩釋系統,可有效的降低術后息肉復發率,提高臨床治療效果[13]。
針對子宮內膜息肉患者,觀察組聯合使用的左炔諾孕酮宮內緩釋系統,作為一種抗雌激素活性類孕激素活性物,宮內置入后能有效的抑制子宮內膜腺體分娩并促進其萎縮,導致內膜間質脫膜化,且在宮內局部緩慢釋放較高濃度孕激素,促使子宮內膜、子宮肌層以及血清中形成較高濃度梯度[14-15]。同時有研究提示宮內置入左炔諾孕酮緩釋系統,其子宮內膜中藥物濃度可達血藥濃度的1000倍以上,達到子宮肌層濃度的100倍以上[16-17]。且宮內置入后可緩慢釋放,其劑量為20 μg/d,相對于口服、局部以及靜脈給藥等,能更好的維持藥物濃度,以持續抑制雌激素合成與分泌,尤其對于增殖期子宮內膜轉向分泌期,降低雌激素敏感性,而且還可抑制宮腔內微血管形成,減少子宮內膜增生,降低術后復發率[18]。
綜上所述,對于子宮內膜息肉患者在實施宮腔鏡術后聯合應用左炔諾孕酮宮內緩釋系統宮內置入,可作用于宮內膜,使內膜萎縮變薄,減少相關并發癥,預防子宮內膜息肉復發。

