VPS33B對卵巢癌細胞增殖凋亡的影響及機制研究
曠思思,石麗云,廖秀瓊
(深圳市人民醫院計劃生育科,廣東 深圳 518028)
卵巢癌是目前臨床上較為常見的一種女性生殖系統惡性腫瘤,其發病早期具有極強的隱匿性,絕大多數患者一經確診便已是中晚期,喪失了手術根治的時機,預后不良[1-2]。故此,探索卵巢的早期診斷新手段以及有效的新療法具有極其重要的意義,亦是提高卵巢癌患者生存周期的重中之重。VPS33B基因英文官方名稱為Vacuolar protein sorting 33 homologB(yeast),該基因主要編碼蛋白空泡蛋白分選蛋白33B,上述蛋白是Secl/Munc-18(SM)蛋白家族成員之一[3],既往臨床上關于VPS33B基因的報道主要集中在關節攣縮以及腎功能不全等方面,尚無關于該基因在腫瘤發病機制方面的研究報道。隨著近年來相關研究的日益深入,越來越多的學者發現VPS33B基因在肺癌、胃癌等多種惡性腫瘤中均存在異常表達,可能是潛在的癌癥相關基因之一,有望成為卵巢癌治療的潛在靶點[4-5]。鑒于此,本文通過研究VPS33B對卵巢癌細胞增殖凋亡的影響及機制,旨在為卵巢癌的診治提供新的思路和靶點,現報告如下。
1 對象與方法
1.1材料:人卵巢癌OVACA-3細胞購自美國ATCC細胞庫;RPMI1640培養基以及胎牛血清均購自美國Hyclone公司;BCA蛋白質定量試劑盒購自天根生化科技有限公司;蛋白裂解液RIPA以及蛋白酶抑制劑PMSF均購自碧云天公司;PI3K、AKT、c-Myc單克隆抗體均購自Cell Signaling Technology;VPS33B多克隆抗體購自Proteintech公司;TRIzol試劑盒、逆轉錄試劑盒以及熒光定量PCR試劑盒均購自大連寶生物工程有限公司;穩定過度表達的VPS33B慢病毒購自銳博公司;特異性針對VPS33B的RNA干擾片段購自廣州銳博公司。本次研究經過本院醫學倫理委員會同意。
1.2研究方法
1.2.1構建過表達VPS33B的OVACA-3細胞株:采用10%胎牛血清的RPMI 1640培養基,于37℃,5%CO2條件下實施傳代培養,待細胞生長狀態良好時實施慢病毒轉染。取OVACA-3細胞以D-hanks洗滌3次,加入胰酶消化1~2 min,取適量培養基種植消化,800 r/min離心處理2 min后去除上清液,加入全培吹散細胞至單細胞懸液。取5 000個細胞置入24孔板內,加入500μl全培,混勻,8 h后細胞貼壁后,計算各試劑所需劑量,進行過度表達VPS33B的慢病毒轉染,6~8 h后換液,持續培養48 h。
1.2.2干擾VPS33B過表達組卵巢癌OVACA-3細胞株轉染siRNA靶向干擾VPS33B過表達處理:嚴格遵循siRNA轉染試劑說明書相關操作步驟,將干擾片段si-VPS33B離心后用150μl DEPC水溶解配置成終濃度為20 μmol/L的工作液,放置在-80℃冰箱中保存備用。取生長至90%~95%的融合度的OVACA-3細胞,采用D-hanks洗滌3次,加入胰酶消化2 min,取適量培養基種植消化,800 r/min離心處理2 min后去除上清液,加入全陪吹散細胞至單細胞懸液。于6孔板內各孔分別接種2×105個細胞,接種8~12 h后,待細胞貼壁,且密度達至40%~60%匯合度時進行轉染。
1.2.3細胞增殖測定:主要是通過四甲基偶氮唑(MTT)法進行測定,具體操作如下:首先取處于對數生長期的OVACA-3細胞接種在96孔板內,于37℃,5%CO2培養箱中孵育24 h,待細胞貼壁后無血清培養24 h。分別測定過表達VPS33B、轉染siRNA靶向干擾VPS33B過表達以及未經處理的OVACA-3細胞,測定570 nm吸光度值。每次各組均設置5個復孔,實驗重復3次,以平均值作為最終結果。
1.2.4細胞凋亡檢測:通過Annexin V-FITC流式細胞技術進行檢測。將處于對數生長期的細胞接種在直徑60 mm的培養皿中,貼壁后在無血清狀態下培養,一應操作嚴格參照細胞凋亡測定試劑盒說明書完成,每組重復3次,以平均值作為最終結果。
1.2.5PI3K、AKT、c-Myc蛋白濃度檢測:采用Westernblot法實現,首先在6孔板中加入100 μg的胰蛋白酶提取液,同時加入2 ml的培養基,將轉染處理后的細胞置入EP管內,并與胰蛋白提取液根據1∶100比例混合,冷凍10 min,促使細胞完全裂變為E溶液。于EP管內以1∶100比例加入胰蛋白酶提取液2 ml,促使細胞完全裂變為F溶液。將E與F溶液按照80∶1的體積混勻,放置在37.5℃保溫相中20 min,冷卻后計算PI3K、AKT、c-Myc蛋白濃度。
1.3觀察指標:對比三組OVACA-3細胞增殖情況,三組OVACA-3細胞轉染48 h后凋亡情況以及三組OVACA-3細胞PI3K、AKT、c-Myc蛋白表達水平。
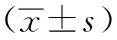
2 結果
2.1三組OVACA-3細胞增殖情況評價:過表達VPS33B組OVACA-3細胞增殖能力低于OVACA-3對照組和干擾VPS33B過表達組,且干擾VPS33B過表達組OVACA-3細胞增殖能力高于OVACA-3對照組,差異有統計學意義(均P<0.05)。見表1。
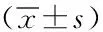
表1 三組OVACA-3細胞增殖情況評價
2.2三組OVACA-3細胞轉染48 h后凋亡情況評價:過表達VPS33B組OVACA-3細胞轉染48 h后活細胞占比低于OVACA-3對照組和干擾VPS33B過表達組,凋亡細胞、壞死細胞占比高于OVACA-3對照組和干擾VPS33B過表達組;且干擾VPS33B過表達組OVACA-3細胞轉染48 h后活細胞占比高于OVACA-3對照組,凋亡細胞、壞死細胞占比低于OVACA-3對照組,差異有統計學意義(均P<0.05)。見表2。

表2 三組OVACA-3細胞轉染48h后凋亡情況評價
2.3三組OVACA-3細胞PI3K、AKT、c-Myc蛋白表達水平評價:過表達VPS33B組PI3K、AKT、c-Myc蛋白表達明顯低于OVACA-3對照組以及干擾VPS33B過表達組,且干擾VPS33B過表達組PI3K、AKT、c-Myc蛋白表達均高于OVACA-3對照組,差異有統計學意義(均P<0.05)。見圖1~3。

圖1 三組細胞中PI3K蛋白表達水平變化,依次為干擾VPS33B過表達組、OVACA-3對照組、過表達VPS33B組

圖2 三組細胞中AKT蛋白表達水平變化,依次為干擾VPS33B過表達組、OVACA-3對照組、過表達VPS33B組

圖3 三組細胞中c-Myc蛋白表達水平變化,依次為干擾VPS33B過表達組、OVACA-3對照組、過表達VPS33B組
3 討論
迄今為止,關于卵巢癌的具體病因以及發病機制尚未完全明確,可能與環境、內分泌激素、遺傳、晚婚晚育等因素密切相關[6-8]。由于卵巢癌患者發病早期往往缺乏特異性癥狀,發現時往往已處于晚期階段,易出現腫瘤灶的轉移,臨床治療主要以手術聯合化療等綜合療法為主,但效果并不十分理想,嚴重威脅女性生命健康安全[9-10]。因此,探尋與卵巢癌發生、發展密切相關的基因,可為卵巢癌發病機制奠定基礎,進一步為臨床診治方案的制定提供參考依據。相關研究報道顯示,在腫瘤的發生、發展過程中,多種基因均會發生異常改變,且長期處于該狀態下會影響細胞生長以及分化,從而為腫瘤的發生、發展創造有利條件[11-13]。VPS33B基因主要定位于人15號染色體q26.1上,其所編碼的蛋白在蛋白排序功能調控中起著至關重要的作用[14]。由此可見,該基因表達可能與細胞增殖、凋亡存在密切相關,其具體作用機制值得臨床深入研究,可能為卵巢癌的治療提供理論依據。
本研究結果發現,VPS33B對卵巢癌細胞增殖具有一定的抑制作用,同時對卵巢癌細胞凋亡具有促進作用。這提示了VPS33B基因可能在卵巢癌的發生、發展過程中扮演著抑癌基因的角色。考慮原因可能在于過表達VPS33B基因有效阻滯了細胞周期進程,從而促使細胞周期G1期朝S期轉化出現障礙,繼而導致細胞周期被阻滯在G1期,最終影響細胞增殖、分化。同時,VPS33B可能與NESG1在卵巢癌發生、發展過程中起著協同抑癌的作用,可能是通過調控可特異性結合DNA區域并調控基因轉錄的蛋白分子表達,繼而干擾該類基因和相互作用的轉錄因子形成復合體,從而調控基因轉錄以及轉錄后翻譯。近年來,PI3K/AKT/c-Myc信號通路是眾多學者關注的熱點,其可在多種細胞內表達,進一步介導細胞的增殖以及分化。且有相關研究報道[15-17]證實,PI3K/AKT/c-Myc信號通路的活化可促進淋巴血管的形成以及腫瘤細胞增殖,繼而促使病情朝不可控方向發展。作為機體內的重要信號通路,PI3K活性增強可調控下游抗氧化蛋白,繼而促使機體受活性氧的損害,發生氧化應激反應,導致卵巢癌細胞的氧化以及抗氧化平衡被打破,最終刺激了卵巢癌細胞的增殖[18-20]。而本研究結果發現:過表達VPS33B組PI3K、AKT、c-Myc蛋白相對表達量明顯低于OVACA-3對照組以及干擾VPS33B過表達組,且干擾VPS33B過表達組PI3K、AKT、c-Myc蛋白相對表達量均高于OVACA-3對照組。這也提示了VPS33B對卵巢癌細胞增殖凋亡的影響機制可能與抑制PI3K/AKT/c-Myc信號通路活化有關,值得后續進一步關注。
綜上所述,VPS33B可發揮明顯的抑制卵巢癌細胞增殖作用,同時對卵巢癌細胞凋亡具有促進作用,其可能作用機制是抑制PI3K/AKT/c-Myc信號通路活性,值得進一步研究。

