氫氧化鑭抑制慢性腎衰高磷血癥所致血管鈣化的作用機制
李曉佳,王勝男,谷 超,孫麗君,趙璐璐,高 原,王琪雯,元曉榮,陳乃宏,李 剛
(1.內蒙古醫科大學,內蒙古 呼和浩特010059;2中國醫學科學院藥物研究所天然活性物質與功能國家重點實驗室)
慢性腎病(chronic kidney disease,CKD)為腎臟結構或功能異常超過3個月,且對健康產生影響,其診斷標準為腎臟損傷標記物的異常,及腎小球濾過率<60mL/min/1.73 m3,任何一項出現超過3個月即可被診斷為慢性腎病[1]。根據2017年的流行病學調查顯示,2017年全球人群中慢性腎病患病率約為9.1%。而我國CKD患者約有1.323億,成為全球慢性腎病患病率最高的國家[2]。慢性腎衰竭(chronic renal failure,CRF)是各種慢性腎臟病發展至后期的共同結果。高磷血癥是慢性腎衰患者,尤其是終末期腎臟病患者常見的并發癥。高磷會導致甲狀旁腺功能繼發性亢進、對骨及礦物質代謝異常[3],同時會造成心臟瓣膜、血管以及軟組織等發生轉移性鈣化。
血管鈣化在CKD后期患者中普遍存在,與CKD患者死亡原因密切相關[4]。血管鈣化(vascular calcification,VC)共有四種類型包括:動脈內膜鈣化,動脈中膜鈣化,主動脈瓣鈣化和鈣化防御。在終末期腎病患者中,動脈內膜鈣化和中層鈣化比較容易發生,其中內膜鈣化是最常見的類型[5]。目前,關于高磷誘導血管鈣化的機制還不是很清楚。研究表明,血管平滑肌細胞(vascular smooth muscle cell,VSMC)在血管鈣化過程中起著關鍵作用,其通過骨/軟骨細胞表型轉分化的機制促進鈣化的形成[6]。Jakob Voelkl等[7]的研究表明,鋅可通過G蛋白偶聯受體39(G protein-coupled receptors 39依賴的腫瘤壞死因子-α誘導蛋白3(TNFα-inducible protein 3antibody,TNFAIP3)抑制NF-κB信號途徑的激活,進而抑制磷酸鹽誘導的VSMCs的成骨樣細胞轉分化和減緩血管鈣化的發展,Jakob Voelkl等的研究還發現了,糖皮質激素誘導激酶(SGK1)是血管鈣化的關鍵調節因子,SGK 1可通過激活NF-κB通路,而促進血管鈣化,抑制SGK 1可減輕CKD血管鈣化。綜上所述,NF-κB信號通路在CKD患者血管鈣化的發生發展中具有重要作用。
目前治療高磷酸血癥的常用藥物主要有:碳酸鈣、碳酸鑭等[8~11]。本文研究一種新型鑭類磷結合劑-氫氧化鑭,課題組前期研究表明氫氧化鑭可有效降低血清磷水平,保護腎功能,具有很好的開發潛力。因此本文中,我們探討了氫氧化鑭對慢性腎衰并發癥血管鈣化的影響,并對其作用機制進行了研究,為氫氧化鑭成為臨床候選藥物提供臨床前期的藥理學研究基礎。
1 實驗動物及試劑
Wistar大鼠,雄性,6周齡,于北京維通利華實驗動物技術有限公司購買(SCXK(京)2016-0006),飼養于內蒙古醫科大學動物實驗中心屏障區。
氫氧化鑭(實驗室合成);碳酸鑭(CAS:54451-24-0),碳酸鈣(CAS:471-34-1),腺嘌呤(CAS:73-24-5)購買于Sigma-aldrich;烏拉坦(DC08BA0021,生工生物工程(上海)股份有限公司);1.2%高磷飼料(北京科澳協力飼料有限公司);磷測試盒(C006-1-1),鈣測定試劑盒(C004-2-1),肌酐測定試劑盒(C011-2-1),尿素氮測定試劑盒(C013-2-1),均購于南京建成生物工程研究所;大鼠成纖維細胞生長因子(FGF23)ELSA試劑盒(F4444-B,),大鼠甲狀旁腺(PTH)ELSA試劑盒(F4378-B)購于上海易利生物科技有限公司;核蛋白提取試劑盒(78833,Thermo Scientific NE-PER Nuclear and Cytoplasmic Extraction Reagents);Anti-Mouse IgG(H+L),(1:5000,A23910),Anti-Rabbit IgG(H+L),(1:5000,A23920)購于Abbkine;Transgelin(6G6)抗體(1:600,SC-53932),Runx2抗體(1:600,SC-101145,)購于Santa Cruz Biotechnology;β-Actin抗 體(1:2000,K101527P,Solarbio);TRAF6抗體(1:5000,ab40675,Abcam);NF-κB p65抗體(1:500,#6956,Cell Signaling Technology);Lamin A/C抗體(1;1000,10298-1-AP,Proteintech);總RNA提取試劑盒(DP419,天根生化科技(北京)有限公司);反轉錄試劑盒(FSQ-101,ToYoBo Life Science);熒光定量檢測(SYBR Green)試劑盒(QPK-201,ToYoBo Life Science)。
2 主要儀器
Molecular Devices多功能酶標儀(SpectraMax i3x,美谷分子儀器有限公司);高速冷凍離心機(3-18K,Sigma);Leica顯微鏡(GmbH,Wetzlar,Germany LEICA DM 2000);熒光定量PCR儀(PiKoreal96,美國Thermofisher公司);BIO-RAD基礎電泳儀(1645050,伯樂生命醫學產品(上海)有限公司);Odyssey紅外激光成像系統(Odyssey CLX,美國LICOP公司)。
3 實驗方法
3.1 實驗動物分組及給藥
在1~2周模型大鼠每天按照200 mg/kg的劑量進行灌胃,2%腺嘌呤混懸液。3~4周,以相同濃度的腺嘌呤每2天灌一次胃。4周后,大鼠眼眼眶取血離心后取血清進行檢測,檢測血清磷、肌酐和尿素氮水平來確定CKD模型是否建造成功。造模成功后隨機分為氫氧化鑭(LH)組(0.4 g/kg,0.2 g/kg,0.1 g/kg),碳酸鑭(LC)組(0.3 g/kg),碳酸鈣(CC)組(0.42 g/kg)及Model組,每組15只,連續灌胃給藥8周。另選15只毛色、體態相近的Wistar大鼠作為Control組,不給予藥物。除對照組外,其他組均給予1.2%高磷飼料,自由飲食,持續12周。在給藥8周后,測定血清中的磷,肌酐,尿素氮,PTH,FGF23。在給藥結束后處死所有動物,用20%的烏拉坦麻醉大鼠,腹主動脈采血,離心取血清。將每只動物的胸主動脈一部分于-80℃保存用于Western Blot和qRT-PCR分析,另一部分用10%的中性甲醛固定用于組織病理學檢查。
3.2 血清生化檢測
使用試劑盒測量血清鈣、磷、肌酐和尿素水平。使用脲酶法評估血清尿素氮水平。肌氨酸氧化酶法用于測量血清肌酐水平,而MTB方法用于評估血清鈣水平。通過大鼠ELISA試劑盒方法測量血清PTH和FGF23水平。
3.3 胸主動脈Von kossa和EVG染色方法
使用4%多聚甲醛將大鼠胸主動脈血管固定好,隨后委托塞維爾生物進行Von kossa及EVG染色切片。
3.4 qRT-PCR使用RNA simple Total RNA Kit總RNA
提取試劑盒進行胸主動脈總RNA的提取,將RNA逆轉錄為cDNA,使用SYBR Green熒光染料法進行PCR反應,反應結束后,分析qPCR引物的特異性。對目的基因進行分析,GAPDH作為內參。引物序列(見表1)。

表1 引物序列Tab.1 Sequences of the primers
3.5 Western Blot
提取各組大鼠胸主動脈總蛋白及核蛋白,使用BCA法檢測蛋白含量,使用SDS-PAGE進行蛋白分離,轉模,封閉完成后一抗4℃孵育過夜,TBST洗膜后二抗孵育,使用Odyssey紅外激光成像系統進行條帶成像,實驗獨立重復4次。
4 統計學處理
實驗結果以均數±標準差(mean±SD)表示,使用Graphpad Prism 8.0.1及SPSS 2.0進行數據分析及作圖,數據處理運用單因素方差分析(One way-ANOVA),P<0.05表示差異有統計學差異,P<0.01表示差異有顯著性差異。
5 結果
5.1 氫氧化鑭對CKD大鼠血清生化指標的影響
為了評估氫氧化鑭對CKD大鼠血清生化指標的影響,我們在造模4周后和給藥8周后分別檢測了CKD大鼠的血清磷、鈣、肌酐、尿素氮水平。造模結束后,與Control組相比,Model組的血清磷、肌酐、尿素氮均顯著升高,說明已成功建立慢性腎衰高磷血癥大鼠模型。
如圖1所示,給藥8周后,與Model組相比,給予LH各劑量組、LC、CC治療后CKD大鼠血清磷濃度、血清肌酐水平、尿素氮、PTH、FGF-23水平水平均顯著降低,且氫氧化鑭具有劑量依賴性。藥物治療后血清鈣的檢測結果無統計學差異(見圖1)。

圖1 氫氧化鑭治療慢性腎衰高磷血癥大鼠8周血清檢測結果Fig.1 Lanthanum Hydroxide Treatment of Chronic Renal Failure Hyperphosphatemia Rats 8 Weeks Serum Test Results.
6.2 氫氧化鑭延緩血管鈣化的發生及發展
根據對FGF23的檢測,我們發現氫氧化鑭能夠調節機體FGF23水平,降低血管鈣化發生率。為了進一步研究氫氧化鑭對慢性腎衰高磷血癥所致的血管鈣化的影響,我們進行了大鼠胸主動脈的病理檢測。
大鼠胸主動脈的Von-kossa及EVG染色結果顯示,與Control組相比,Model組大鼠的主動脈血管彎曲膨大、彈性較差、血管中膜可見大量黑色鈣化沉積(見圖2),而且鈣化區域的彈性纖維減少,并發生彈性纖維的斷裂(見圖3),而給藥氫氧化鑭后,可看到CKD大鼠血管鈣化沉積明顯減少,并且彈性纖維的斷裂也有所改善。氫氧化鑭(0.4 g/kg)組改善血管鈣化的作用最明顯。實驗中發現,給藥碳酸鈣后,對血管鈣化的改善程度并不明顯。

圖2 氫氧化鑭治療慢性腎衰高磷血癥大鼠8周后胸主動脈Von kossa染色結果Fig.2 Von kossa staining results of thoracic aorta in rats with chronic renal failure and hyperphosphatemia after 8 weeks of treatment with lanthanum hydroxide.
6.3 氫氧化鑭對CKD大鼠模型胸主動脈組織Sm22α、Runx2和Traf6 mRNA表達的影響
為了驗證氫氧化鑭是否通過抑制NF-κB通路抑制血管鈣化的發生及發展。我們對CKD大鼠的主動脈血管進行了qRT-PCR檢測。
平滑肌22α(Sm22α)是血管平滑肌細胞骨架相關蛋白,是收縮型VSMCS標記物[12]。Runx2是成骨細胞表型轉化最關鍵的特異性轉錄因子,它的異常表達常被作為血管鈣化的早期評價指標[13]。我們運用qRT-PCR技術檢測了主動脈血管的Sm22α、Runx2及NF-κB通路中Traf6的表達。
如圖4所示,與Control組相比,Model組的血管平滑肌細胞標記物Sm22α mRNA的表達顯著降低(P<0.01),而成骨標記物Runx2 mRNA的表達顯著升高(P<0.01),NF-κB通路中Traf6 mRNA的表達顯著升高(P<0.01),給予氫氧化鑭治療后,劑量依賴性的逆轉了上述基因的表達(P<0.01)。

圖4 氫氧化鑭對CKD模型大鼠胸主動脈組織Sm22α、Runx2、Traf 6mRNA表達的影響Fig.4 The effect of lanthanum hydroxide on the expression of Sm22α,Runx2,Traf6 mRNA in the thoracic aorta of CKD model rats.
6.4 氫氧化鑭對CKD大鼠胸主動脈SM22α、RUNX2、TRAF6和NF-κB蛋白表達的影響
為了進一步驗證氫氧化鑭對NF-κB通路的作用,我們運用Western Blot技術檢測了SM22α、RUNX2及NF-κB通路中TRAF6及NF-κB的蛋白表達,細胞質的蛋白以β-actin,為內參,細胞核的蛋白以LaminA為內參。如圖5、6所示,與Control組相比,Model組血管平滑肌標志性蛋白SM22α表達顯著降低(P<0.01),而成骨標志性蛋白RUNX2表達顯著升高(P<0.01),表明CKD大鼠血管平滑肌細胞已經由收縮表型向成骨表型轉分化。在給藥8周后,與Model組相比,各給藥組SM22α蛋白的表達升高,RUNX2表達顯著降低。為了驗證氫氧化鑭是否通過NF-κB通路抑制血管鈣化的發生,檢測了NFκB及其上游TRAF6的表達。與Control相比,Model組的TRAF6的表達顯著增加(P<0.01),胞質內NFκB的表達顯著降低(P<0.01,P<0.05),而細胞核內NF-κB的表達的表達顯著升高(P<0.01,P<0.05)。與Model組相比,給予LH各劑量組、LC、CC治療的CKD大鼠TRAF6表達顯著降低;細胞核內NF-κB的表達顯著降低,氫氧化鑭劑量依賴性逆轉了上述蛋白的表達。

圖5 氫氧化鑭對CKD模型大鼠胸主動脈組織細胞質中TRAF6、NF-κB、SM22α蛋白表達的影響Fig.5 The effect of lanthanum hydroxide on the expression of TRAF6,NF-κB and SM22α in the cytoplasm of the thoracic aorta of CKD model rats.
7 討論
本文研究了一種新型磷結合劑-氫氧化鑭,通過對血清生化指標的檢測和胸主動脈組織病理學的研究,證明了氫氧化鑭可降低血清磷水平、調節鈣磷平衡,延緩CKD血管鈣化的發生及發展。并證明了氫氧化鑭可通過抑制NF-κB通路抑制血管鈣化的發生及發展。
本文中選用腺嘌呤造模,可在短時間內誘發腎衰竭,動物之間的差異很小,在CKD動物模型后期,可觀察到骨骼異常和血管鈣化,該模型顯示了CKD進行性發作和腎功能衰竭的病程[14~16]。如圖1所示,給藥8周后,與Model組相比,給予LH各劑量組、LC、CC治療后CKD大鼠血清磷濃度、血清肌酐水平、尿素氮水平顯著降低,且氫氧化鑭具有劑量依賴性。由此可知,碳酸鑭和氫氧化鑭(0.2 g/kg)的治療效果相當,而氫氧化鑭(0.4 g/kg)的治療效果更好。因此,氫氧化鑭相較于碳酸鑭具有更高的效價。
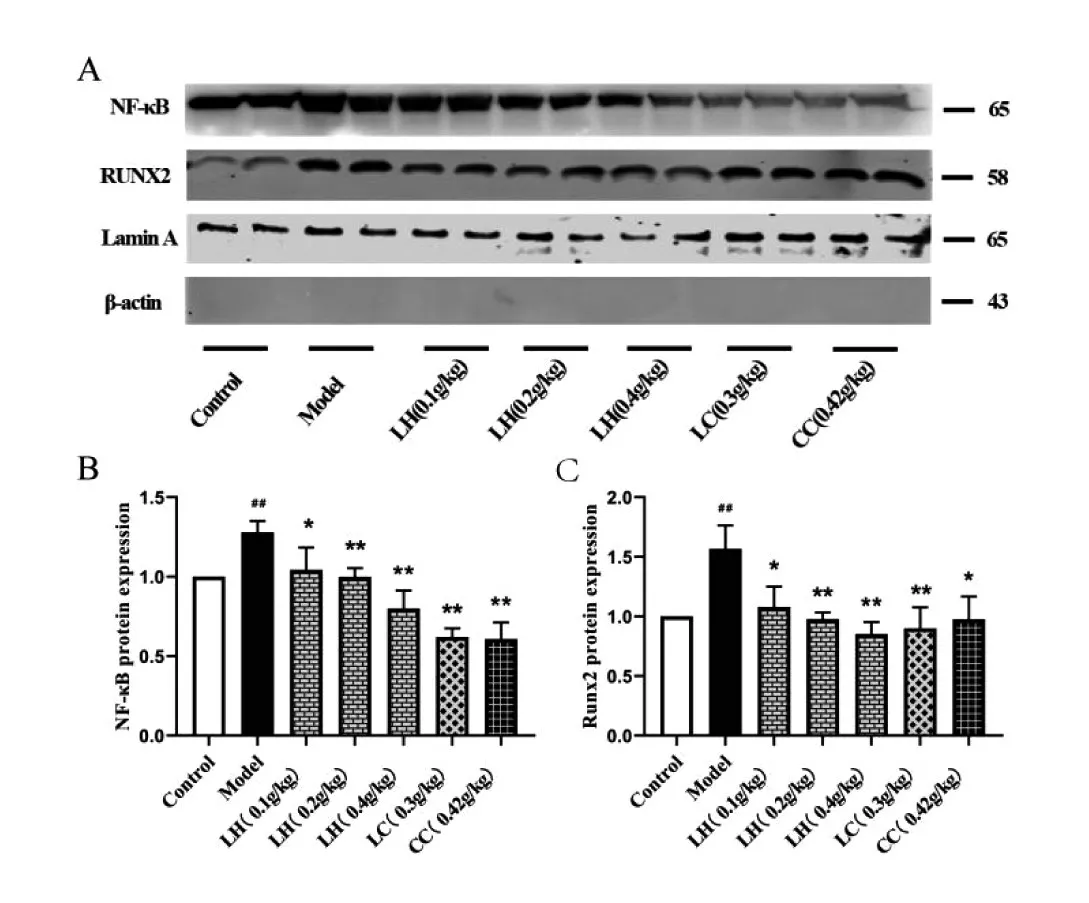
圖6 氫氧化鑭對CKD模型大鼠胸主動脈組織細胞核中NF-κB、RUNX2蛋白表達的影響Fig.6 The effect of lanthanum hydroxide on the expression of NF-κB and RUNX2 protein in the nucleus of the thoracic aorta tissue of CKD model rats.
通過對相關文獻的查閱以及胸主動脈血管的mRNA和蛋白表達的檢測,結果表明:與Control組相比,Model組SM22α的蛋白表達顯著下降,隨后我們檢測了NF-κB上游的蛋白TRAF6和NF-κB,與Control組相比,Model組的TRAF6的表達顯著升高,細胞核內的NF-κB表達明顯增加,氫氧化鑭給藥8周后,劑量依賴性的逆轉了上述蛋白的表達。綜上所述,氫氧化鑭可通過抑制NF-κB的入核,抑制高磷血癥過程中VSMCs中的成骨轉分化,進而抑制血管鈣化的發生及發展。然而,La3+如何進入細胞,激活NF-κB途徑,抑制血管平滑肌細胞鈣化,將是我們未來研究的方向。
綜上所述,新型磷結合劑-氫氧化鑭可有效降低血清磷水平,調節體內鈣磷平衡,具有延緩慢性腎衰血管鈣化發生和發展的作用。同時證明了氫氧化鑭是通過阻斷NF-κB通路的激活,抑制慢性腎衰血管鈣化的發生及發展。

