實驗動物原發性癲癇的磁共振擴散成像特征及病理學對照研究
趙鵬飛,馬雪英,孫振婷,高 陽,喬鵬飛*
(內蒙古醫科大學附屬醫院影像診斷科,內蒙古 呼和浩特010050)
1 引言
原發性癲癇主要發生于兒童和年輕人,患者腦部無明顯器質性改變,發作又具有不定時性和短暫性,在臨床診治和病理研究方面均面臨較大的挑戰[1]。目前臨床上用于癲癇診斷的主要方法有腦電圖(electroencephalogram,EEG)、正電子發射型計算機斷層顯像(positron emission computed tomography,PET)、單光子發射計算機斷層成像(single photon emission computed tomography,SPECT)及磁共振顯像(magnetic resonance imaging,MRI)等。用于常規檢查的EEG在癲癇發作期敏感性較高,但非發作期的診斷價值大打折扣[2,3],PET與SPECT費用昂貴不宜普及,近年來MRI在方法學方面取得了極大的進展,相繼出現的軸位彌散加權成像(diffusion weigh imagin,DWI)、體素內不相干運動擴散成像(introvoxel incoherent movement,IVIM)及彌散峰度成像(diffusion kurtosis imaging,DKI)技術,更是實現了從宏觀影像學到微觀影像學乃至功能評估的跨越[4~6]。在這些新技術的基礎上,我們嘗試采用擴散成像MRI評估癲癇的發生與發展,考慮到人類原發性癲癇無法獲取病變組織的病理資料,本研究應用大鼠模型分析癲癇磁共振特征與病理改變的關系,為深入分析其應用價值提供數據支撐,并間接為臨床診斷、評估、治療癲癇提供了功能磁共振方面的支撐。
2 材料與方法
2.1 實驗動物及分組
實驗動物為80只6~8周齡健康清潔級Wistar大鼠,由上海西普爾-必凱實驗動物有限公司提供(許可證號:SCXK(滬)2019-1106),雌雄各半。所有動物按照體重由低到高編號,采用隨機數字表分為兩組,空白對照組和癲癇模型組各40只。
2.2 模型制備與評價
空白對照組正常飼養,癲癇模型組采用腹腔注射海仁酸(10mg/支,購自Sigma官網)的方式制備癲癇模型。本研究在前期預實驗中采用梯度劑量法確立了該模型的最佳海仁酸用量為6 mg/kg,以生理鹽水配置為1 mg/mL的溶液,根據大鼠體重給藥,比如200 g大鼠給藥量為(6mg/kg×0.2kg)1mg/mL=1.2 mL。在腹腔注射后30 min開始觀察大鼠行為,發生前驅癥狀且腦電圖呈現典型癲癰樣放電為模型制備成功[7]。本研究經內蒙古醫科大學附屬醫院附屬醫院倫理委員會批準(S.2019014)。模型制備成功后根據Racine量表進行評級,由輕至重將癲癇行為評為0~V級,0級:完全正常,I級:咀嚼、眨眼、立須等面部肌肉抽搐,II級:以點頭運動為主的頸部肌肉的抽搐,III級:單側前肢的陣攣、抽搐IV:雙側前肢陣攣、抽搐伴身體立起,V級:雙側后肢強直、身體背曲強直、跌倒。
2.3 大鼠MRI掃描方法
于致病后3天進行MRI檢查。主要步驟:10%的水合氯醛(400mg/kg)腹腔注射麻醉,采用美國GE公司的Discovery MR750 3.0T超導型磁共振掃描儀進行MRI檢查,將大鼠固定于四通道老鼠腦部核磁共振線圈,檢查序列包括矢狀面T2WI、FLAIR,冠狀面T1WI、T2WI、DWI、DKI、IVIM序列。DKI序列采集0 s/mm2~2500 s/mm2范圍內的6個b值,25個擴散敏感梯度方向;IVIM序列采集0 s/mm2~200 s/mm2范圍內的11個b值和700 s/mm2~1300 s/mm2范圍內的3個b值,層厚2.9mm,層間隔0mm。所得圖像數據傳輸至工作站,運用MRIcro軟件勾畫ROI并進行測量,ROI包括灰質內12個腦區:雙側基底節區、海馬、杏仁核海馬區、顳葉皮層、頂葉皮層、額葉皮層,白質內5個腦區:雙側外囊區、雙側前聯合區域及胼胝體,每個腦區ROI測3次,每個ROI控制在4個體素左右,取平均值,分別測量其平均峰度(mean kurtosis,MK)值、各向平均擴散率(mean diffusion rate,MD)值、部分各向異性(fractional anisotropy,FA)值、真性水分子擴散系數(diffusion coefficient,D)、微循環灌注系數(microcirculation perfusion coefficient,D*)和灌注分數(perfusion fraction,f),然后計算出每個腦區各參數的均值。
2.4 大鼠病理評估方法
本研究中40只用于模型制備的大鼠共獲得成功模型28只(成功率70.0%,癲癇模型組),于致病后3天、1、3、5周[8]。隨機取7只大鼠,空白對照組同期隨機取10只大鼠,斷頭,取出全腦組織,生理鹽水沖洗干凈,浸泡于4%的多聚甲醛浸泡過夜,次日進行石蠟包埋制備常規病理切片,HE染色觀察病理形態的變化,并采用Tunel染色實驗測定細胞凋亡率,主要步驟:磷酸鹽(PBS)緩沖液沖洗4次,每次5min,避光操作,先加入封閉液200 μL孵育10min;再次PBS緩沖液沖洗,加入透化溶液孵育5min;再次PBS緩沖液沖洗,避光配置tunel溶液并滴加在每個切片后,避光孵育60min。電子顯微鏡下觀察,死亡細胞被染成棕色或棕黃色,計算死亡細胞比例。
2.5 統計學方法
采用統計學軟件SPSS 22.0分析數據;先行正態分布及方差齊性檢驗,FA值、MD值、MK值符合正態分布,以均數(χ)±標準差(S)表示;兩組間比較行獨立樣本t檢驗;多個時間點的組間比較屬于重復測量數據,行重復測量的方差分析及事后LSD、SNK檢驗;D*值、D值、f值均不符合正態分布,以中位數(M)±四分位數間距(Q)表示,組間比較行Mann-Whitney U檢驗。FA值、MD值、MK值、D*值、D值、f值與癲癇程度的相關性分析行Spearman相關(秩相關),與神經元凋亡率的相關性分析采用Pearson相關(簡單線性相關);檢驗水準為α=0.05,以P<0.05為差異有統計學意義。
3 結果
3.1 空白對照組與癲癇模型組大鼠的擴散成像MRI參數比較
經觀察,大鼠在致病3周時擴散成像MRI參數變化最為明顯,因此我們主要統計該時間點的MRI參數差異。統計結果顯示,癲癇模型大鼠的MRI參數組間差異最為顯著的是海馬區、丘腦及顳葉白質的MK值、D值及f值,癲癇模型組的MK值偏大,D值和f值偏小,與空白對照組相比差異有統計學意義(P<0.05)。除此以外,癲癇模型組的海馬區和丘腦區D*值也明顯低于空白對照組,差異有統計學意義(P<0.05)(見表1、圖1)。

圖1 a:癲癇模型組MK值偽彩圖;b:癲癇模型組D值偽彩圖;c:癲癇模型組f值偽彩圖Fig.1 a:False color map of MK value in epilepsy model group;b:D-value pseudo color map in epilepsy model group;c:F-value pseudo color map of epilepsy model group
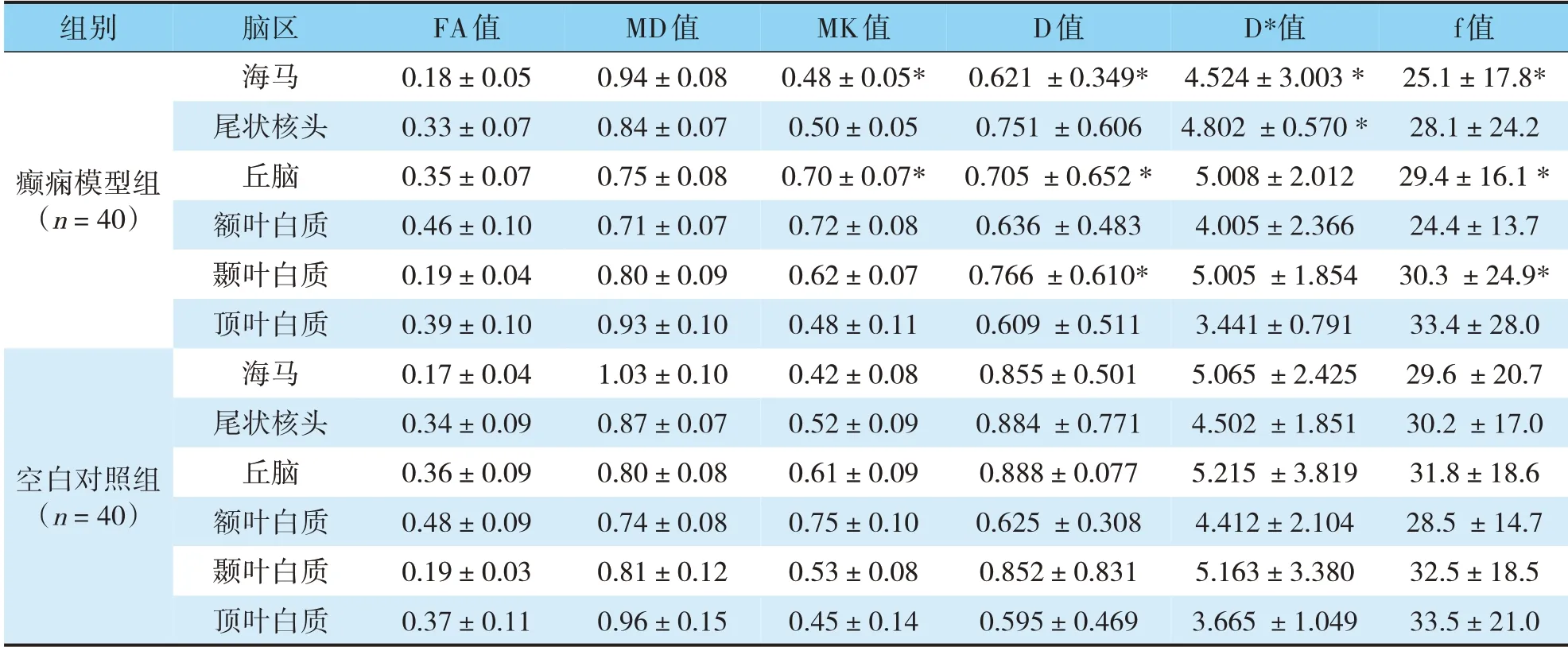
表1 癲癇模型組與空白對照組大鼠的擴散成像MRI參數比較Tab.1 Comparison of MRI parameters of diffusion imaging between epilepsy model group and blank control group
3.2 空白對照組與癲癇模型組大鼠的病理比較
HE染色后觀察大鼠腦組織病理形態(見圖2),正常對照組大鼠腦組織細胞排列整齊,形態正常,癲癇模型組大鼠腦組織發現明顯的神經元壞死,空泡變性,核仁消失,部分可見淋巴細胞浸潤。TUNEL染色后觀察大鼠腦組織神經元凋亡率(見圖3),癲癇模型組致病后3d、1、3、5周的神經元凋亡率均高于空白對照組,差異有統計學意義(P<0.05)(見表2)。

表2 各組大鼠不同時間點神經元凋亡率比較Tab.2 Comparison of neuronal apoptosis rate at different time points in each group of rats

圖2 兩組大鼠不同時間點腦組織切片HE染色特征比較(10x)Fig.2 Comparison of HE staining characteristics of brain tissue sections at different time points between the two groups(10x)
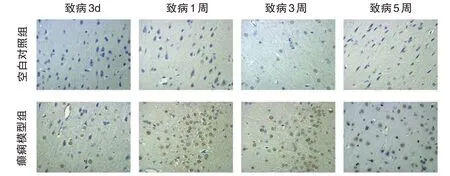
圖3 兩組大鼠不同時間點腦組織切片TENEL染色結果比較(10x)Fig.3 Comparison of tenel staining results of brain tissue sections at different time points between the two groups(10x)
3.3 擴散成像MRI參數與大鼠病理特征的關系
將病理嚴重程度分為輕度、中度與重度,采用Spearman檢驗分析各個參數與大鼠病理嚴重程度的關系,采用Pearson檢驗分析各個參數與大鼠神經元凋亡率的關系,結果如表3所示,癲癇大鼠海馬區、丘腦及顳葉白質的MK值和病理嚴重程度(ρ=0.665-0.778)、神經元凋亡率(r=0.675-0.705)呈正相關性(P均<0.001),D值及f值與與病理嚴重程度(ρ=0.454-0.701)、神經元凋亡率(r=0.554-0.714)呈負相關性(P均<0.001)。

表3 癲癇大鼠病理嚴重程度及神經元凋亡率與各個MRI參數之間的相關性分析結果Tab.3 Correlation analysis results between the pathological severity and neuronal apoptosis rate of epileptic rats and various MRI parameters
4 討論
癲癇的臨床診斷主要依靠臨床表現、神經電生理學以及影像學檢查,原發性癲癇缺乏明顯的器質性改變,在病理研究方面受到較大的限制。擴散成像MRI是指將多種MRI方法聯合用于疾病診斷與評估,在近幾年的技術發展中,MRI通過不同的掃描與影像重建模式,逐漸實現了對組織微觀結構改變的觀察和對局部功能異常的評估,這對甄別癲癇的病理研究具有重要意義[9~11]。
本研究借助大鼠癲癇模型對MRI參數與腦組織病理特征做對照研究。模型制備方法選擇了海仁酸注射法,該模型相對成熟,具有與人類癲癇相似的行為學表現,和海馬區萎縮、硬化等神經病理學改變,且模型對其后癲癇刺激的敏感性長期增強[12~13]。在3個差異參數中,MK值是DKI技術的主要參數,DKI是在DTI的基礎上發展起來的,是目前唯一能在活體內進行非侵襲性探測組織微觀結構信息的技術。研究表明,MK值是水分子沿著空間各方向彌散峰度的平均值,主要用于反應局部結構的復雜程度,對腦白質微結構變化十分敏感,且不受組織結構空間方位的影響,穩定性高[14]。D值與f值是IVIM技術的主要參數,其中D值主要反應水分子的真實擴散情況,f值主要反應微循環灌注成分所占的比例[15]。目前,IVIM在腫瘤和骨病的診斷中應用較多,在腫瘤性疾病中,由于高級別腫瘤增殖能力強,細胞密度大,同時新生毛細血管多,血供豐富,故而可能存在D值降低和f值增大的情況[16]。在某些腫瘤中,雖然新生毛細血管增多,但同時也面臨著高核漿比和高細胞密度的情況,微循環灌注成分所占整體的比例并不一定增多,f值也可能下降[17]。目前,將IVIM用于癲癇診斷的報道尚不多見,本研究發現癲癇大鼠的D值和f值都低于對照組,這與其病理改變是密不可分的。反復癲癇發作可導致腦組織缺血缺氧性損傷,產生大量活性的氧自由基[18],從而導致了局部灌注不足和f值降低。
本研究進一步采用擴散成像MRI掃描證實了該模型在腦微結構和功能變化方面具有和原發性癲癇相似的特征,即海馬、丘腦、顳葉白質的MK值、D值及f值與對照組明顯不同,說明該模型用于原發性癲癇的病理研究基本可靠。并發現癲癇大鼠海馬區、丘腦及顳葉白質的MK值和病理嚴重程度、神經元凋亡率呈正相關性,D值及f值與病理嚴重程度、神經元凋亡率呈負相關性,進一步驗證了擴散成像MRI評估癲癇病理的可靠性。
綜上所述,本研究通過實驗動物病理對照研究證實,擴散成像MRI能較為準確的反應癲癇患者腦組織病理變化,對其臨床診斷和病情評估可能存在重要價值。

