無錫市企業執行《醫療器械不良事件監測和再評價管理辦法》的現狀調查與分析
王文聯,曹俐娜
無錫市藥品不良反應監測中心,江蘇無錫 214000
醫療器械不良事件監測和再評價是實施醫療器械上市后監管的重要工作內容,是強化醫療器械全生命周期科學監管,提高監管成效的重要舉措[1-2]。為加強醫療器械不良事件監測和再評價工作,落實醫療器械上市許可持有人(以下簡稱 “持有人”)不良事件監測和再評價主體責任,保障公眾用械安全,國家市場監督管理總局令第1 號《醫療器械不良事件監測和再評價管理辦法》[3-4](以下簡稱《辦法》)已于2019 年1 月1 日起施行。“國家醫療器械不良事件監測信息系統” 這一新的信息化系統也于2019 年1 月1 日起啟用。
目前,《辦法》實施已經兩年有余,該文通過調查2019年1—12 月該市100 家持有人在履行《辦法》等法規義務的真實現狀、醫療器械不良事件(以下簡稱 “MDR”)監測工作開展的實際情況,及時發現其中的實際問題與困難,并進行分析和對策研究,為提高持有人MDR 監測能力提出合理化建議,為《辦法》的更好落實提供現實依據。 報道如下。
1 資料與方法
1.1 一般資料
對2019 年1—12 月在 “國家醫療器械不良事件監測信息系統” 注冊的無錫市的持有人開展問卷調查。 隨機抽取了100 家持有人發放調查問卷,每家持有人發放一份調查問卷,共計100 份,由持有人監測部門負責人或監測業務骨干填寫,回收有效調查問卷100份。
1.2 研究方法
問卷調查法為該文采用的核心方法,主要用于收集持有人關于《辦法》施行后的執行現狀的相關數據,包括單位基本信息、組織機構與人員現狀、持有人主動收集及上報情況、個例MDR 監測情況、群體MDR 監測情況、定期風險評價報告完成情況、重點監測情況、再評價情況、分析和建議,主要以選擇題的形式作答(單選、多選兩種類型)。 此外,與各領域醫療器械監測專家開展深度訪談作為補充。
對回收的100 份有效問卷,使用SPSS(Statistical Product and Service Solutions)統計軟件進行數據錄入、整理與統計分析。
2 結果
2.1 樣本基本情況
100 家持有人2019 年通過 “國家醫療器械不良事件監測信息系統” 總計收到反饋報告1 604 份,最多為545份,最少為0 份。 持有人完成反饋報告評價數1 582 份,評價率為98.6%。 僅1 家企業進行了主動上報工作,共上報了11 份不良事件報告。
2.2 持有人監測部門與人員情況
對調查結果顯示:持有人均建立了醫療器械質量管理體系。 22%的持有人有開展MDR 監測工作的獨立部門,76%有開展該項工作的依托部門,2%的持有人既無獨立部門,也無依托部門。 98%的持有人對指定部門的MDR 監測職責有相關文件進行明確規定,見表1。

表1 持有人MDR 監測部門情況
所有的持有人都配備有開展MDR 監測工作的專兼職人員,其中有專職人員的企業占50%,其余由兼職人員負責。
2.3 持有人建立自主收集報告的途徑情況
在調查結果顯示,96%的持有人都能夠主動開展不良事件信息收集工作,但效果不佳,2019 年僅1 家持有人主動上報了不良事件報告,尚有4%的持有人未主動收集不良信息。
持有人主動收集個例不良事件的主要途徑及其占比為:醫療機構途徑(28.5%),經營企業途徑(27.8%),電話/熱線途徑(23.8%),文件檢索途徑(8.6%),企業網站途徑(7.9%),其他途徑(3.3%)。
2.4 持有人關于MDR 監測情況
對于個例MDR 監測:94%的持有人已經建立了個例MDR 監測處理程序;96%的持有人在發現或獲知可疑MDR 后能夠立即調查原因;84%的持有人的能夠在報告時限內上報死亡及嚴重傷害事件;對于死亡、致嚴重傷害、可能導致嚴重傷害的事件,80%的持有人能夠按要求在規定時間內開展調查、分析和評價工作,6%的持有人偶爾會超過時限要求;14%的持有人目前尚未開展相關工作,見表2。
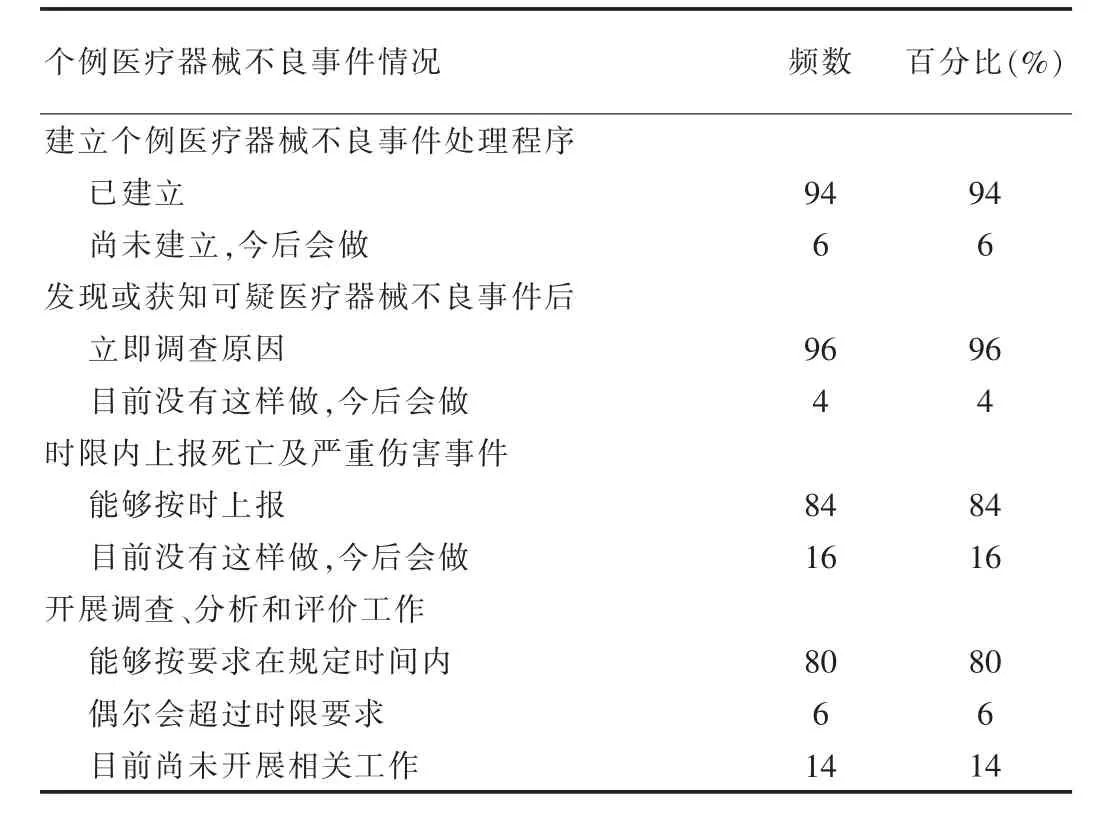
表2 個例MDR 監測工作情況
對于群體MDR 監測:82%的持有人制定了群體MDR 應急預案/處理程序。 目前,所調查的持有人均未發生過群體事件。 對于MDR 監測記錄及后續追蹤:90%的持有人已經建立并保存MDR 監測記錄;90%的持有人能夠開展持續跟蹤和處理監測信息的工作。
2.5 持有人完成定期風險評價報告情況
調查結果顯示,全部的持有人都制定了醫療器械產品上市后定期風險評價報告程序文件和制度。 78%的持有人能夠按照已制定的程序文件和制度,按時限要求規范撰寫和遞交報告,22%的持有人不能規范地按照要求撰寫和遞交報告。
結果顯示,調查企業中僅1 家持有人有創新醫療器械,但目前未收到其主動開展監測工作的文件。
2.6 持有人風險控制情況
結果顯示,92%的持有人會對反饋報告進行分析評價,其中45.7%的持有人能夠定期進行分析評價,54.3%的持有人不定期進行。在分析評價過程中,39.1%的持有人發現了風險信號,且展開了調查,見表3。

表3 持有人對反饋報告的分析評價情況
調查企業中62%的持有人沒有在境外銷售的產品,28%的持有人在境外銷售并能能夠按照要求上報境外發生的醫療器械不良事件的控制措施以及在境內擬采取的控制措施,但仍有10%的持有人雖然在境外銷售,但不能及時上報控制措施。
76%的持有人采取過風險控制措施,12%的持有人未采取過風險控制措施。 采取過風險控制措施的持有人主要采取的風險控制措施有:改進工藝占28.3%,其次為主動提出說明書修改25.0%,通過致醫生信、持有人網站、媒體等途徑將風險告知醫務人員和公眾占20.0%,主動召回產品占18.3%,其他占8.3%。
2.7 持有人再評價情況
調查結果顯示,50%的持有人能夠主動開展再評價工作,對原注冊資料完成重新評價內容的占比分別為:產品風險分析資料(25.7%),說明書、標簽等內容(24.3%),產品技術要求(20.0%),研究資料(12.9%),臨床評價資料(10.0%),綜述資料(7.1%)。
2.8 持有人面臨的工作難點及存在問題
調查結果顯示,持有人工作難點主要集中在定期風險評價完成工作(19.0%)、主動收集和上報工作中(18.1%)以及個例醫療器械不良事件分析評價工作和再評價工作(17.1%)等,見表4。 持有人在開展監測工作面臨的主要問題有:企業人員相對匱乏、持有人對醫療器械不良事件監測工作的投入相對有限以及技術指導不到位等,見表5。

表4 醫療器械生產企業面臨的監測工作難點

表5 醫療器械企業開展監測工作面臨的主要問題
3 討論
3.1 持有人MDR 監測情況有待提高
100 家持有人都建立了醫療器械質量管理體系,均配備有開展MDR 監測工作的專(兼)職人員。 但通過此次調查分析發現,持有人在執行《辦法》過程中仍存在諸多問題:被調查的100 家持有人中,僅1 家企業主動上報了11 份不良事件報告;在發現或獲知可疑MDR 后:4%的持有人不能夠立即調查原因;對于死亡、致嚴重傷害、可能導致嚴重傷害的事件:16%的持有人的不能夠在報告時限內上報;對于死亡、致嚴重傷害、可能導致嚴重傷害的事件的調查、分析和評價工作:6%的持有人偶爾會超過時限要求、14%的持有人目前尚未開展相關工作;對于群體MDR:仍有18%的持有人尚未制定群體MDR應急預案/處理程序;仍有22%的持有人未能按時限要求規范撰寫和遞交上市后定期風險評價報告;有10%的持有人在境外銷售,未及時上報控制措施。
3.2 持有人MDR 監測工作難題亟待解決
持有人認為在監測工作中存在難點主要為定期風險評價完成工作、主動收集和上報工作、個例MDR 監測分析評價工作和再評價工作。 這是因為這幾項工作需要人員相對固定且需長期進行,對工作人員的業務熟悉程度以及職業敏感度要求比較高。而企業人員流動較快,崗位、職責變動較快,導致員工對監測工作一知半解,監測工作完成情況參差不齊。
持有人所存在的主要問題包括:①專業人員相對匱乏。 現階段而言,持有人對監測工作的重視程度還不夠高,從事監測工作的人員大多為兼職人員且人員較少,監測工作完成度不高或超時限完成。 ②對MDR 監測工作的投入相對有限。 絕大部分持有人沒有設立專門的MDR 信息收集團隊,沒有相應的崗位職責要求,相關培訓較為匱乏。 ③技術培訓不到位。 目前《辦法》已經實施兩年多,監管部門和監測機構開展了數次培訓,但是企業參與度不高[5]。
據《辦法》要求,持有人應當對其上市的醫療器械進行持續研究,評估風險情況,承擔醫療器械不良事件監測的主體責任,根據分析評價結果采取有效控制措施,并履行相應法規義務[6]。 上述調查情況說明持有人在主動報告、MDR 監測、定期風險評價以及風險控制等方面與《辦法》要求有一定差距,需要有所改進。
4 建議
4.1 持有人層面
①強化持有人主體責任意識。《辦法》進一步明確了以企業為主體直接報告醫療器械不良事件的要求。 上市后MDR 監測和再評價也是醫療器械全生命周期管理的核心內容[7]。 持有人應真正認識到MDR 監測工作與企業發展、產品質量命運的密切關系,全程貫徹主體責任,嚴把醫療器械研發、注冊、生產、上市及售后各個環節關口,注重MDR 監測和報告,全力降低各種風險發生概率,確保企業持續健康運營發展[8-9]。
②構建專業的監測隊伍。 一是建立具有醫療器械、流行病學、統計學等相關專業背景的高學歷和/或高職稱的MDR 監測團隊[10],明確相應的崗位職責、制定完善的質量管理體系,通過責任明確化、行為規范化,不讓制度流于形式,有效推動監測工作的深層次開展。 二是加強對MDR 監測人員的理論與技術培訓,經常性地組織內部培訓或派員參加國家、省、市市場監管部門或監測機構的培訓,及時把握監測動態,更新監測理論水平和技術能力。三是針對性地提升監測人員在多途徑收集信息、多角度提取分析、綜合評價安全風險、及時主動采取有效措施等方面的能力,同時定期組織開展不良事件群體、突發事件的演練,在實踐中逐步形成高效的不良事件處理流程[11]。
③拓寬MDR 信息收集渠道。 持有人應充分發揮營銷和臨床使用終端業務人員的主體作用,通過動向經營企業、醫療機構、患者收集MDR 信息、定期對數據庫進行文獻檢索獲取產品安全性信息等, 多渠道收集MDR信息[12]。 同時,借助網絡平臺,構建持有人自身的信息傳遞網絡,一旦收集到MDR 信息,能快速在持有人內部共享,并報至MDR 監測專門部門進行后續處理。
4.2 監管層面
①建立MDR 監測工作聯動機制。 建立市場監督管理部門與衛生行政部門的協調工作機制,通過聯合發文,出臺相關政策,明確醫療機構與持有人在MDR 信息溝通方面的工作要求,醫療機構及時上報MDR,同時將信息及時反饋給持有人,以便持有人不斷改進產品,有效控制風險,切實保障醫療器械的安全性、有效性[13]。 建立健全監測聯動機制,探索創建政府監管、企業負責、醫療機構協同和社會媒體監督的醫療器械監測管理體系,通過對MDR 監測收集醫療器械的真實使用數據,及時采取有效措施規避剩余風險,形成有效的監管網絡,良好的社會共治格局[14]。
②完善MDR 監測檢查機制。對醫療器械生產企業和產品上市后開展的現場檢查是監督企業落實MDR 監測責任的重要手段[15]。 監管部門應轉變目前以工作指導代替檢查的工作模式,切實用好《辦法》這一法律依據,重視對MDR 監測的現場檢查,及時發現企業在組織機構、人員、制度等方面的問題,對生產企業實施風險等級的即時評價與誠信管理的周期性評價相結合的全程動態管理[16],以行政手段督促企業落實主體責任,讓MDR 監測和再評價工作真正融入企業生產質量管理體系中去,切實保障上市后醫療器械安全有效。
③大力開展宣傳培訓。 各級監測部門應經常性組織持有人、醫療機構開展MDR 監測工作專題培訓[17],培訓內容涵蓋如何發現和上報MDR、如何規范填寫報告表、如何提高報告質量等基礎知識[18]和挖掘風險信號、開展重點監測等內涵性業務知識,在提高企業人員、醫務人員發現、收集、報告MDR 能力的基礎上,不斷提升監測人員的醫療器械安全風險信號發現識別能力[19],引導持有人對發生不良事件的原因進行深入挖掘研究,提前預警潛在風險,切實保障公眾用械安全。

