木霉菌對草坪草病原菌的抑菌效果及其機理初步研究
章武,楊錦玉,盧翔,林金梅,牛學禮
(嶺南師范學院,廣東 湛江524048)
最近幾十年,植物病原菌多樣性和致病性均呈現不斷增加的趨勢,其原因不僅與氣候變化引起的極端天氣有關[1-2],還與大量除草劑、殺菌劑等農藥的長期廣泛使用有關,嚴重地影響著植物的生長、產量以及環境和生態安全。因此,近年來國內外利用拮抗微生物防治植物病害的發生和危害已成為目前研究的重點和熱點之一[3-4]。
木霉菌(Trichodermaspp.)是真菌界,半知菌類,絲孢綱,絲孢目,叢梗孢科,木霉屬真菌[5]。它是自然界中普遍存在,且資源豐富的拮抗微生物[6-7],通過產生抗生素、細胞壁分解酵素等生物活性物質[8-9]或通過營養競爭、寄生[10]以及誘導植物產生抗性[11-14]等途徑對植物病原真菌和細菌產生拮抗作用,從而達到預防和治理植物病害的效果。自Weindling[14]于20世紀30年代首次發現木霉菌對植物病原菌具有拮抗作用以來,木霉菌作為生防因子逐漸被越來越廣泛應用于植物病原菌的生物防治,如利用哈茨木霉(Trichoderma harzianum)防治大豆核盤菌(Sclerotinia sclerotiorum)[15],深綠木霉(Trichoderma atroviride)防治番茄根腐病菌(Phytophthora cinnamomi)[16]等。現已有多種木霉菌生防產品登記注冊,在國際上,如美國的T22(哈茨木霉)[17]和以色列的T39(哈茨木霉)[18]等,中國也已研制出T4(哈茨木霉)[19]和T6(長枝木霉)水分散粒劑[20],L24(綠色木霉)分生孢子[21]和特力克木霉可濕性粉劑[22]等,這些制劑在植物病害防治中均取得較好防效。因此,木霉菌在植物病害的生物防治和環境保護等領域展現了巨大的應用前景。
目前以化學防治方法為主的草坪病害管理和防治措施是限制其健康發展的主要因素之一[26]。草坪草病害的生物防治是當今草坪管理技術的研究熱點,以菌治病其優越性在于資源豐富、選擇性強、無殘留、無污染、成本低、兼防兼治、對保持生態平衡起到長效的作用,但國內外研究木霉菌在草坪草病害防治方面的研究相對較少[27-31],因此,繼續挖掘與探索木霉菌資源對草坪草病害病原菌生防效果及其機理仍是該領域研究的重點。
本研究從海南省高爾夫球場土壤中篩選獲得的多株木霉菌菌株中選取生長速度快、產孢量較大的4株菌株,研究其對草坪草病原菌抑制作用及其作用機理,以期為新型、高效的微生物殺菌劑的研制、開發和合理應用提供理論依據和科學資料。
1 材料與方法
1.1 試驗材料
供試4株木霉菌株編號為:SQ-1Q-18(海南,三亞,神泉國際高爾夫球場)、SQ-1Q-15(海南,三亞,神泉國際高爾夫球場)、BD-1F-1(海南,萬寧,神州半島高爾夫球場)、BD-2Q-12(海南,萬寧,神州半島高爾夫球場)。供試的14種草坪草病原菌是筆者收集的常見草坪草病原菌(表1),均為實驗室保存菌種。

表1 供試草坪草病原菌信息Table 1 Information of turfgrass pathogens tested in current study
1.2 試驗方法
1.2.1 菌種活化 2018年4月,將4℃低溫保存于斜面的4株木霉菌和14株草坪草病原菌分別接種于馬鈴薯葡萄糖瓊脂(potato dextrose agar,PDA)培養基進行活化,置于25℃恒溫培養箱中培養5 d后備用。
1.2.2 對峙培養法測定抑菌活性 用記號筆在PDA培養基平板背面分別標記對峙培養木霉菌和病原菌所處具體位置(木霉菌和病原菌以培養皿中線相對稱,間隔3 cm),在無菌條件下,用滅菌打孔器(d=5 mm)對生長良好的4株木霉菌和14種病原菌進行打孔取樣,用接種針挑取菌餅并分別接種于已標示好位置的PDA培養基表面進行對峙培養,每個平板上接種一種木霉菌和一種病原菌。對照只在病原菌位置接種病原菌菌餅,每個對峙試驗及其對照均設4個重復。置于25℃恒溫培養箱中培養,每天觀察并記錄木霉菌和病原菌的對峙生長情況,并于第3天開始采用“十字交叉法”測量各處理組和對照菌落半徑并拍照,每天測定1次,連續測定4 d,根據生長抑制率公式[32]計算生長抑制率。
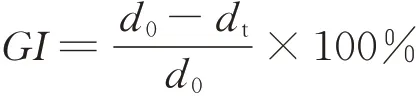
式中:d0為對照菌落半徑(cm),dt為處理菌落半徑(cm)。
740 Expression of microRNA-21 in serum exosomes of patients with different severities of asthma and its diagnostic value
1.2.3 拮抗等級測定 根據張瑾等[33]的方法進行拮抗等級測定。木霉菌菌落完全占據整個培養皿,即占據面積為100%,等級為Ⅰ;3/4<木霉菌菌落占據培養皿面積<1,等級為Ⅱ;2/3<木霉菌菌落占據培養皿面積<3/4,等級為Ⅲ;1/3<木霉菌菌落占據培養皿面積<2/3,等級為Ⅳ;0<木霉菌菌落占據培養皿面積<1/3,等級為Ⅴ;病原菌菌落占據培養皿面積為100%,等級為Ⅵ。
1.2.4 抑菌作用機理顯微觀察 在無菌條件下,用移液器吸取1 mL無菌PDA培養基,均勻涂抹于載玻片上,制成一層PDA培養基薄膜。待載玻片上的培養基凝固后,在載玻片兩端分別接種SQ-1Q-18木霉菌和14種草坪草病原菌,木霉與病原菌相距3 cm,再將載玻片置于無菌培養皿中,封膜后置于25℃恒溫培養箱,每處理3個重復。培養3 d后,當兩菌落相互交接時,將載玻片置于光學顯微鏡下觀察木霉菌與14種病原菌相互作用后菌落的形態特征,記錄并拍照。
1.2.5 玻璃紙法測定抑菌活性 將玻璃紙剪成直徑為9 cm的圓片,經高壓蒸汽滅菌后貼于PDA培養基中央(d=9 cm)。將菌株SQ-1Q-18菌餅接種于含有玻璃紙的培養基中央,25℃黑暗條件下培養。待木霉菌落接近玻璃紙邊緣時,移除玻璃紙及整個菌落,并在培養皿中央接種各病原菌的菌餅。將病原菌接種于未經處理的PDA培養基作為對照。每個處理及對照設置3次重復。每天觀察各病原菌的生長狀況,第3天開始測量病原菌的直徑并拍照,根據生長抑制率公式計算抑菌效果。
1.2.6 木霉菌菌液粗提液測定抑菌活性 用已滅菌的打孔器(d=5 mm)在活化的PDA平板上取木霉菌餅,用接種針挑取菌餅并接種于含有150 mL馬鈴薯葡萄糖液體培養基(potato glucose liquid medium,PDB)的500 mL三角瓶中,共接種10瓶,置于28℃、150 r·min-1搖床振蕩培養5 d后,用無菌脫脂棉濾去菌絲,再用無菌濾紙過濾。在得到的菌液中加入等體積的乙酸乙酯浸泡24 h后進行萃取,每瓶萃取3次后合并萃取液,并通過旋轉蒸發儀在45℃進行濃縮,獲得發酵液粗提物。用丙酮溶解粗提物,制備成溶液(10 mg·mL-1),用移液槍在含有PDA培養基的培養皿上均勻涂布10 μL粗提取物溶液,然后在培養皿中心接種病原菌菌餅,用相同體積的丙酮溶液作為對照,置于恒溫培養箱中,25℃黑暗條件下培養,每個處理重復3次。每天記錄病原菌菌絲生長情況,第3天開始測量病原菌的直徑并拍照,根據生長抑制率公式計算抑菌效果。
1.2.7 木霉菌株鑒定 1)形態學鑒定。菌株SQ-1Q-18活化后,在25℃條件下培養7 d,觀察菌株生長速度、菌落顏色及表面特征等,在顯微鏡下觀察菌絲、產孢細胞、孢子等菌株的形態特征。2)分子生物學鑒定。將菌株SQ-1Q-18活化后于25℃培養箱培養7 d,用無菌載玻片將菌絲刮下,充分研磨,參照Van Burik等[34]的十六烷基三甲基溴化銨(cetyltrimethylammonium bromide,CTAB)法提取病原菌基因組DNA并保存于-20℃冰箱。利用White等[35]設計rDNA-ITS區通用引物ITS-1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS-4(5′-TCCTCC GCTTATTGATATGC-3′),以4株木霉菌真菌基因組為模板進行PCR擴增。PCR擴增體系:10×PCR Buffer 5 μL,dNTP Mixture 4 μL,20 μmol·L-1引物各1 μL,5 U·μL-1Taq酶0.25 μL,模板DNA 1 μL,加滅菌雙蒸水至50 μL。PCR反應條件:94℃預熱4 min;94℃30 s,62℃30 s,72℃1 min,共34個循環;72℃延伸5 min。將所有PCR產物分別加入1.0%的瓊脂糖凝膠中進行電泳,經溴化乙錠染色后,于凝膠成像儀檢測。將PCR產物送至生工生物工程(上海)股份有限公司進行DNA測序。將測得的ITS序列,提交至NCBI核酸數據庫中獲得GenBank登錄號,同時利用GeneBank數據庫中的Blastn軟件進行比對和同源性分析。根據比對結果,從Genbank上下載相似度較高的木霉屬真菌rDNA-ITS片段,通過https://mafft.cbrc.jp/alignment在線軟件進行序列比對。以親緣關系相近真菌Nectira berolinensis為外群,使用Mega 7.0軟件中的最大似然法(maximum likelihood method)構建系統發育樹,并將分析結果結合形態學特征對木霉菌進行鑒定。
1.3 數據分析
用SPSS 22.0的One-Way ANOVA方法,對平板對峙培養下4種木霉菌對14種供試病原真菌的生長抑制率、木霉菌株SQ-1Q-18的次生代謝產物以及粗提取物對14種供試病原菌的抑制率進行方差分析,LSD法比較均值,置信區間設為95%,字母法進行顯著性標記。用Adobe Photoshop CC 2019和Adobe Illustrator CC 2018組合照片并注解。用R語言(4.0.0版)pheatmap軟件包的pheatmap函數繪制熱圖,用mat參數添加標準差及顯著性字母;用ggplot 2軟件包繪制4種木霉菌對供試病原菌總體抑制率的小提琴圖和木霉菌株SQ-1Q-18的次生代謝產物及關于粗提取物對14種供試病原菌抑制率的柱形圖。
2 結果與分析
2.1 木霉菌對病原菌的拮抗效果
對峙培養第2天,4株木霉菌菌絲開始與病原菌菌絲相互接觸。第5天時與對照相比,4株木霉菌株對14種供試病原真菌均有不同程度的拮抗效果,其中木霉菌SQ-1Q-18菌株的拮抗作用最明顯。4株木霉菌對地衣狀伏革菌(LF)的抑制作用最強,均達100%;其次是對玉蜀黍絲核菌(RZ)有較強抑制作用,其中菌株SQ-1Q-18和BD-1F-1對RZ的抑制率均達100%(圖1)。
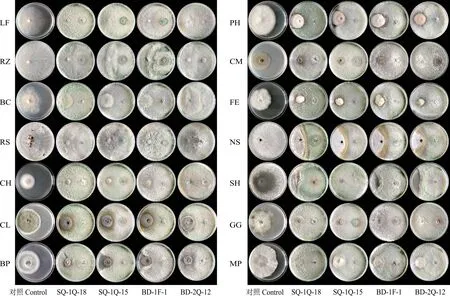
圖1 對峙培養第5天時4種木霉菌與14種草坪草病原菌平板生長狀況Fig.1 The growth status of 4 Trichoderma spp.isolates and 14 turfgrasses pathogens on the 5th day of agar confrontation culture
4株木霉菌對14種供試病原菌抑制效果明顯,抑制率在40%~100%。與其他3個木霉菌株相比,菌株SQ-1Q-18對立枯絲核菌(RS)、地毯草炭疽菌(CH)、雀稗微座孢(MP)、球黑孢霉(NS)和佩立金平臍蠕孢(BP)的抑制作用較強,抑制率分別為95.5%、88.5%、78.0%、61.6%和59.0%;SQ-1Q-15對草坪草幣斑病病原菌(SH)的抑制作用最強,抑制率為79.4%;BD-1F-1對草坪草墨斑病菌(CM)、草莖點霉(PH)、新月彎孢霉(CL)的抑制作用較強,抑制率分別為70.0%,55.4%和44.0%;BD-2Q-12對灰葡萄孢菌(BC)、禾頂囊殼禾谷變種(GG)和木賊鐮刀菌(FE)的抑制作用較強,抑制率分別為92.2%,81.9%和69.2%(圖2)。
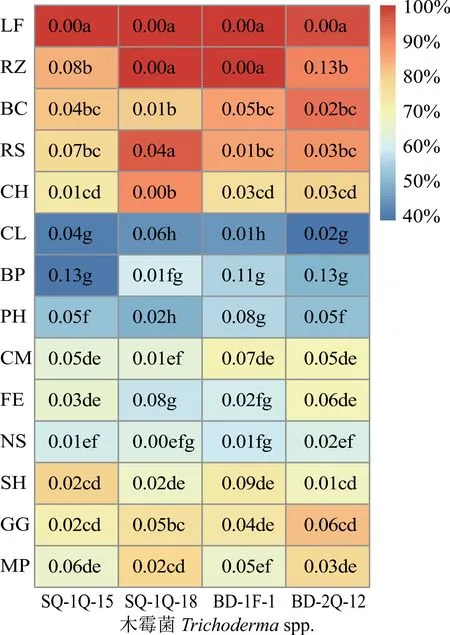
圖2 對峙培養第5天時4種木霉菌對14種草坪草病原菌的抑制率Fig.2 The inhibition rate of 4 Trichoderma spp.isolates and 14 turfgrass pathogens on the 5th day of confrontation culture
通過分析4株木霉菌對供試14種病原菌的平均抑菌率,發現木霉菌SQ-1Q-18的平均抑制效果較強,達72.8%,且均值離散度適中,分布密度相對均一(圖3),因此選擇木霉菌株SQ-1Q-18進一步研究其生防機理。
2.2 對峙培養拮抗作用觀察及分析
菌株SQ-1Q-18對供試的14種草坪草病原菌生長均有明顯的抑制作用,但SQ-1Q-18對不同的病原菌拮抗等級存在較大差異(表2)。對地衣狀伏革菌和玉蜀黍絲核菌的拮抗等級均為I級,即拮抗作用最強。對草坪草墨斑病菌、佩立金平臍蠕孢、立枯絲核菌、地毯草炭疽菌、灰葡萄孢菌、禾頂囊殼禾谷變種、雀稗微座孢的拮抗等級為Ⅱ級。對木賊鐮刀菌和草坪草幣斑病病原菌的拮抗等級為Ⅲ級。對新月彎孢霉、球黑孢霉、草莖點霉的拮抗等級為Ⅳ級。

表2 木霉菌SQ-1Q-18對14種病原菌生長的拮抗效果及等級Table 2 Inhibition effect of Trichoderma spp.isolates SQ-1Q-18 on the growth of fourteen pathogens
2.3 抑菌作用機理的顯微觀察
將載玻片上對峙生長的兩菌落交界處置于光學顯微鏡下觀察,發現木霉菌對14種病原菌的抑制作用方式相似。主要是在兩種真菌相互接觸后,木霉菌迅速侵入病原菌生長空間,而后木霉菌菌絲通過纏繞(圖4A)在病原菌菌絲體上,與病原菌交錯在一起,使病原菌菌絲變細、縊縮(圖4B)。嚴重時甚至導致病原菌菌絲斷裂(圖4C);或穿入病原菌菌絲體內(圖4D)或寄生在病原菌菌絲表面(圖4E),使病原菌菌絲細胞原生質濃縮,直至最后病原菌菌絲細胞降解(圖4F)等。
2.4 木霉菌次生代謝產物對病原菌的拮抗效果
將病原菌接種于SQ-1Q-18木霉菌在玻璃紙上生長過的培養基中培養5 d后,除玉蜀黍絲核菌(RZ)和立枯絲核菌(RS)外的12個病原菌生長狀況與對照相比均有拮抗效果。這表明SQ-1Q-18木霉菌生長過程中透過玻璃紙產生的次生代謝產物對玉蜀黍絲核菌(RZ)和立枯絲核菌(RS)拮抗作用不明顯,對其他12種病原菌均有不同程度的抑制作用(圖5A)。
2.5 木霉菌菌液粗提取物對病原菌的拮抗效果
由乙酸乙酯萃取、旋轉蒸發儀濃縮蒸干得到的SQ-1Q-18木霉菌粗提取物對14種草坪草病原菌的抑制效果不明顯,抑制率均在50%以下(圖5B),對各病原菌抑制效果也存在差異,其中,對草坪草幣斑病病原菌(SH)和佩立金平臍蠕孢(BP)的抑制率相對較高,分別為43.60%和42.91%;對新月彎孢霉(CL)、草莖點霉(PH)和球黑孢霉(NS)的抑制率較低,均小于5%;而對立枯絲核菌(RS)和玉蜀黍絲核菌(RZ)無抑制效果。
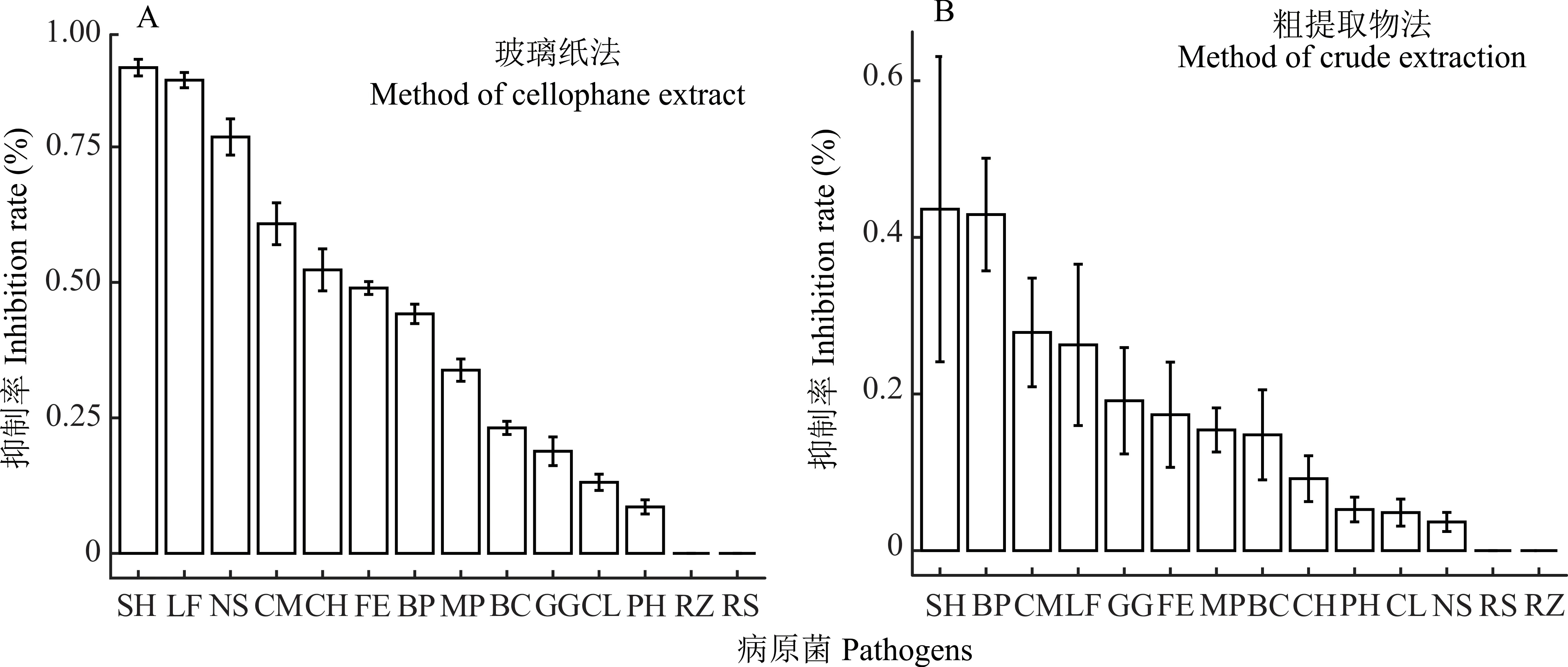
圖5 SQ-1Q-18木霉菌對14種草坪草病原菌的抑菌率Fig.5 Antibacterial rate of Trichoderma isolate SQ-1Q-18 against 14 turfgrass pathogens
2.6 木霉菌形態學特征
菌株SQ-1Q-18在PDA上活化后,氣生菌絲迅速生長;菌落初期呈白色、氈狀,后期孢子簇大量形成,變為淺綠色,致密地平鋪在培養基平板上,背面黃綠色或金黃色;分生孢子梗排列呈典型的金字塔形結構,初級分枝間隔分布,成對且大量再分枝;瓶梗細胞單生或2~5個輪生,燒瓶形至安瓿形,大小(7.9~)8.6~12.3(~13.6)μm×(2.2~)2.5~2.9(~3.3)μm(圖6A);分生孢子近球形或橢球形,表面光滑,淡綠色,老熟后呈深綠色,大小(2.5~)3.0~3.3(~3.6)μm×(2.5~)2.8~3.2(~3.5)μm(圖6B),根據形態特征初步將木霉菌株SQ-1Q-18鑒定為哈茨木霉。
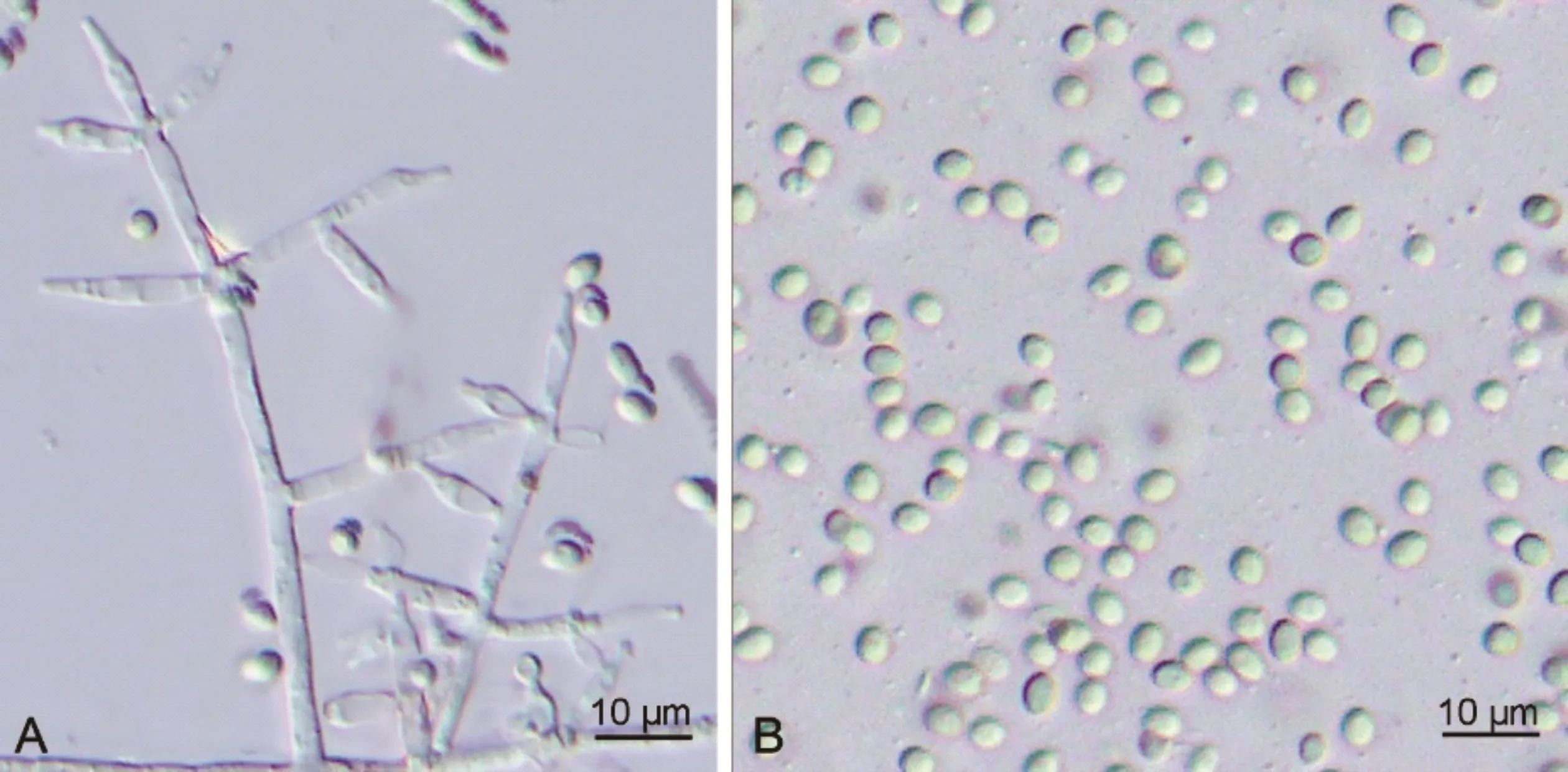
圖6 哈茨木霉(SQ-1Q-18)的形態學特征Fig.6 Morphological characteristics of T.harzianum(SQ-1Q-18)

續表Continued Table
2.7 木霉菌的分子鑒定
菌株SQ-1Q-18測序所得ITS片段長度為595 bp,提交至GenBank獲得登錄號為MT584872。序列經GenBank網站Blastn比對分析,發現與已發表的多個哈茨木霉序列(MK738145,MN658589,MN602615)相似度均為100%。從構建的系統發育樹可知本研究分離的木霉菌SQ-1Q-18與已知哈茨木霉菌株聚在一個分支,自展支持率為100%(圖7)。因此結合形態學特征進一步將其鑒定為哈茨木霉。
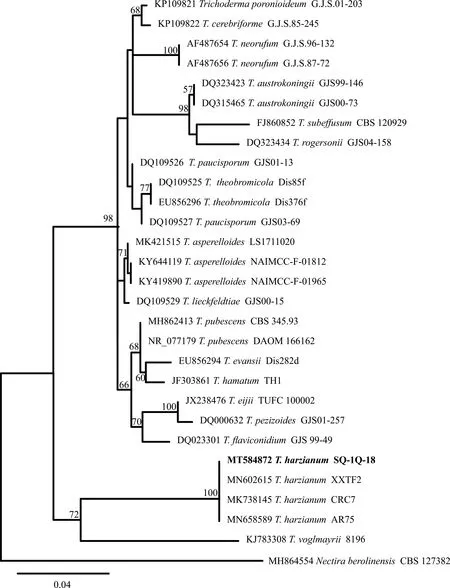
圖7 基于木霉屬真菌ITS序列建立的最大似然法系統發育樹Fig.7 Phylogenetic tree of Trichoderma spp.resulting from a maximum likelihood analysis of the ITS sequence alignment
3 討論
大量研究證實木霉菌廣泛存在于多種生境中并與其他生物進行各種各樣的相互作用,尤其對土傳病原真菌有顯著抑制作用,因而具有保護植物的能力進而被成功地應用于生物殺菌劑中[36-37]。但不同木霉菌株對同種病原菌的抑制機制和效果也有所不同,本試驗用海南省高爾夫球場土壤中篩選獲得的4株木霉菌測定其對草坪草病原菌的抑菌作用,并對抑制效果較好的SQ-1Q-18木霉菌抑菌機理進一步研究,發現供試木霉菌對14種草坪草病原菌有不同程度的抑制效果,抑制率為38.3%~100.0%,除地衣狀伏革菌外,4株木霉菌對同一病原菌的抑制程度存在一定的差異。本研究發現4株木霉菌對地衣狀伏革菌抑制率均高達100%,說明木霉菌對地衣狀伏革菌抑制效果極為顯著,本研究首次報道了木霉菌具有防治草坪草紅絲病的潛力。另外,菌株SQ-1Q-18和BD-1F-1對玉蜀黍絲核菌的抑制率也高達100%,這一結果說明木霉菌對防治草坪草病害的應用有巨大潛力。
已有研究表明木霉菌主要通過寄生、競爭、抗生、溶菌等作用而抑制病原菌,但不同木霉菌的作用機制和抑菌效果有所不同,同時也與病原菌本身生長和免疫特性有關[38-39]。本研究通過對木霉菌SQ-1Q-18菌絲顯微結構拮抗特征觀察發現木霉菌通過對病原菌菌絲進行纏繞、縊縮的方式使病原菌菌絲變細甚至斷裂,或直接穿入或吸附病原菌菌絲的方式寄生,競爭病原菌生長空間,甚至可導致病原菌菌絲細胞溶解,斷裂。
通過玻璃紙法研究木霉菌次生代謝產物對病原菌的抑制試驗表明,木霉菌SQ-1Q-18在培養基上產生的次生代謝產物對草坪草幣斑病病原菌、球黑孢霉和地衣狀伏革菌的抑制率達75%以上;由乙酸乙酯萃取、濃縮所得的SQ-1Q-18木霉菌粗提取物對佩立金平臍蠕孢和草坪草幣斑病病原菌的抑制率在40%以上。這與El-Katatny等[40]的研究結果相似,其研究發現哈茨木霉的培養濾液可抑制番茄果腐病病原菌孢子萌發,表明木霉次生代謝產物或其粗提物對部分病原菌生長有抑制作用。已有研究表明木霉菌在其生命過程中會產生多種揮發性或非揮發性抗生素[41-44],本研究中木霉菌分泌了何種抗生性代謝物對病原菌產生抑制作用仍需深入研究。
通過分析對峙培養過程中生長受到明顯抑制的地衣狀伏革菌、玉蜀黍絲核菌和立枯絲核菌,發現盡管在平板對峙培養中木霉菌株SQ-1Q-18對三者的抑制率均為100%,但通過玻璃紙法產生的次生代謝產物在第3天后對玉蜀黍絲核菌和立枯絲核菌無明顯抑制作用,同時通過萃取濃縮獲得的粗提取物對玉蜀黍絲核菌和立枯絲核菌亦無抑制作用。但兩種方法獲得的SQ-1Q-18化合物對地衣狀伏革菌的抑制率在14種病原菌中排名靠前(分別為第3、4位)。以上結果表明木霉菌SQ-1Q-18對不同病原菌抑制效果的作用方式不同,對地衣狀伏革菌的抑制不僅通過菌絲接觸對其進行抑制,而且通過產生不利于地衣狀伏革菌生長的化合物抑制地衣狀伏革菌菌絲的生長,但對玉蜀黍絲核菌和立枯絲核菌主要通過菌絲纏繞、縊縮、入侵和侵占生長空間等方式進行抑制。這種現象可能與3種病原菌菌株培養性狀有緊密聯系。地衣狀伏革菌菌絲緊貼平板表面生長形成革質菌落,病原菌生長方式使菌絲充分接觸培養基表面化合物,因此受木霉次生代謝產物影響較大。而玉蜀黍絲核菌和立枯絲核菌的菌絲生長迅速,菌絲疏松、未緊貼平板表面生長,說明即使菌絲與培養基接觸面小也能充分吸收營養,因此菌株受培養基表面化合物影響較小。
利用有生防潛質木霉菌防治草坪草病害已成為目前研究的新思路,如古麗君等[30]研究深綠木霉T2對瓜果腐霉的抑菌作用及機制;姬承東等[45]篩選了木霉菌防治蘑菇圈病原真菌等均取得較好的效果。哈茨木霉作為木霉屬真菌中重要生防真菌之一,已被廣泛運用于世界各地的植物病原真菌的防治[17-18],我國利用哈茨木霉菌防控草坪草鐮刀菌枯萎病和褐斑病已取得相關知識產權[46-47]。本研究首次證實哈茨木霉SQ-1Q-18對地衣狀伏革菌和玉蜀黍絲核菌的防治效果最為理想,其次生代謝產物或菌液粗提液對不同病原菌抑制效果不同,此外木霉菌作為草坪草病害的生防因子的機理需進一步研究。本研究結果可以為草坪草病害生物防治提供參考,并且為微生物殺菌劑的研發提供依據。
4 結論
1)采用對峙培養的方法觀測4株木霉菌株對14種草坪草病原菌的拮抗作用,結果表明各木霉菌對不同病原菌表現出不同程度的拮抗作用。其中菌株SQ-1Q-18抑菌效果最佳,其對玉蜀黍絲核菌和地衣狀伏革菌的抑制率高達100%,對灰葡萄孢菌、地毯草炭疽菌和立枯絲核菌的抑制率大于80%,且對供試病原菌的平均抑制率高達72.8%。
2)通過顯微鏡觀察得知木霉菌菌株SQ-1Q-18可通過產生抑菌圈侵占病原菌的生長空間,覆蓋和深入病原菌內部與其相互纏繞使得病原菌菌絲變細、縊縮甚至斷裂,或直接穿入病原菌菌絲內部吸取營養致使菌絲細胞溶解。
3)木霉菌菌株SQ-1Q-18能產生對草坪草病原菌有抑制活性的拮抗化合物,其中玻璃紙法產生的拮抗物質對草坪草幣斑病病原菌、球黑孢霉及地衣狀伏革菌拮抗作用較強,接種3 d后,其相對抑制率分別高達91.77%、89.80%和79.59%;木霉菌粗提取液對草坪草幣斑病病原菌和佩立金平臍蠕孢的抑制率相對較高,分別為43.60%和42.91%。
4)通過形態學特征和ITS rDNA序列將木霉菌株SQ-1Q-18鑒定為哈茨木霉。

