添加亞油酸條件下不同劑量硝酸鈉對水牛瘤胃體外發酵脂肪酸組成及相關微生物數量的影響
郭艷霞,李孟偉,唐振華,彭麗娟,彭開屏,謝芳,謝華德,楊承劍
(中國農業科學院廣西水牛研究所,農業農村部廣西水牛遺傳繁育重點實驗室,廣西南寧530001)
反芻動物瘤胃內環境是瘤胃正常發酵的重要保障,瘤胃內復雜的微生物發酵系統共同作用,協助機體對纖維素、非蛋白氮等物質的利用。此過程會以甲烷形式損失掉5%的飼料能量[1],另外,甲烷作為生物溫室氣體也會污染環境。很多研究者致力于抑制甲烷生成的研究,通過添加耗氫化合物是減少甲烷排放的主要方法之一[2]。硝酸鹽可作為耗氫化合物降低甲烷產量,并且作為非蛋白氮還可為瘤胃微生物提供氮源[3]。Huyen等[4]將硝酸鹽作為唯一非蛋白氮源添加到低蛋白質飼糧中,并給動物4周左右的適應期,并未對動物產生毒害作用。Li等[5]在羔羊日糧中添加硝酸鈣,發現每千克增重甲烷排放量降低17.3%,每千克干物質日糧甲烷排放量降低35.4%。然而,反芻動物瘤胃微生物還原硝酸鹽的過程中產生一種中間產物亞硝酸鹽,若未經硝酸鹽適應的動物突然攝入大量硝酸鹽會造成瘤胃內亞硝酸鹽中毒,因此控制硝酸鹽的添加量和適應性對于硝酸鹽在反芻動物生產中的應用至關重要。
亞油酸是指含18碳原子2個雙鍵的ω-6系多不飽和脂肪酸,在反芻動物瘤胃微生物作用下,第一步cis-11雙鍵被異構化為trans-12雙鍵,產生亞油酸的異構體共軛亞油酸cis-9,trans-11CLA;第二步經過微生物加氫作用,先被還原成反式油酸(t11-C18:1),再進一步還原生成硬脂酸(C18:0)[6]。共軛亞油酸(conjugated linoleic acid,CLA)具有抗癌、減輕動脈硬化、降低體脂、增強免疫力等作用[7],是維持機體細胞構成所必需的營養物質,提高動物產品CLA含量具有重要意義。亞油酸的氫化過程和甲烷生成過程均存在氫轉移,并且需要瘤胃微生物的作用,添加硝酸鹽對氫轉移過程和瘤胃微生物的影響的相關報道較少。因此,本試驗旨在研究添加亞油酸條件下不同劑量硝酸鈉對水牛瘤胃體外發酵脂肪酸組成及相關微生物數量的影響。
1 材料與方法
1.1 試驗動物及材料
試驗時間為2019年3-5月。選擇3頭體重約為(650±50)kg安裝永久性瘤胃瘺管的母水牛作為瘤胃液供體動物。瘺管牛的飼糧水平參照廣西水牛研究所的日常飼料配方配制,精粗比40∶60,每天飼喂2次,自由飲水。在晨飼前采集3只瘺管牛的瘤胃內容物,混合后經2層紗布過濾2次至預熱處理過和提前通入CO2的收集瓶中,39℃下連續通入CO2。
發酵底物豆粕、玉米(Zea mays)、象草(Elephantes herba)均采自廣西水牛研究所水牛場,經65℃烘干制成風干樣后,粉碎過0.425 mm孔徑篩網用于體外發酵。硝酸鈉(分析純)購于天津市百世化工有限公司;亞油酸標準品(純度≥99%)購于美國Sigma公司;其他化學試劑均為分析純。
1.2 試驗設計
采用單因素試驗設計,根據硝酸鈉添加量的不同分為4組,硝酸鈉的添加量分別為0(對照)、1、2、3 mg·mL-1,每組5個重復,每組都添加0.25 mg·mL-1的亞油酸。
1.3 培養方法
采用體外批次培養法(重復試驗2次,2次對照組產氣量相對偏差小于10%),體外發酵底物的精粗比為40∶60(風干基礎),底物飼料分為精飼料(豆粕25%,玉米15%)和粗飼料(象草60%),其營養成分見表1。根據試驗設計,準確稱取發酵底物300 mg象草粉,125 mg豆粕粉,75 mg玉米粉置入180 mL厭 氧 培養瓶中,分別添加不同劑量的硝酸鈉。人工瘤胃緩沖液的配制參照Menke等[8]的方法,持續通入CO2氣體,緩沖液由粉色變為無色。將乳化后的亞油酸液按相應設定比例加入培養瓶中,人工瘤胃緩沖液和瘤胃液體積2∶1混合均勻,抽取60 mL混合液加入培養瓶中,然后用橡膠塞和鋁蓋密閉,整個過程通入CO2氣體保持厭氧環境,盡快完成。將培養瓶置于恒溫水浴搖床中,水浴溫度(39.0±0.5)℃,振蕩頻率50 r·min-1。
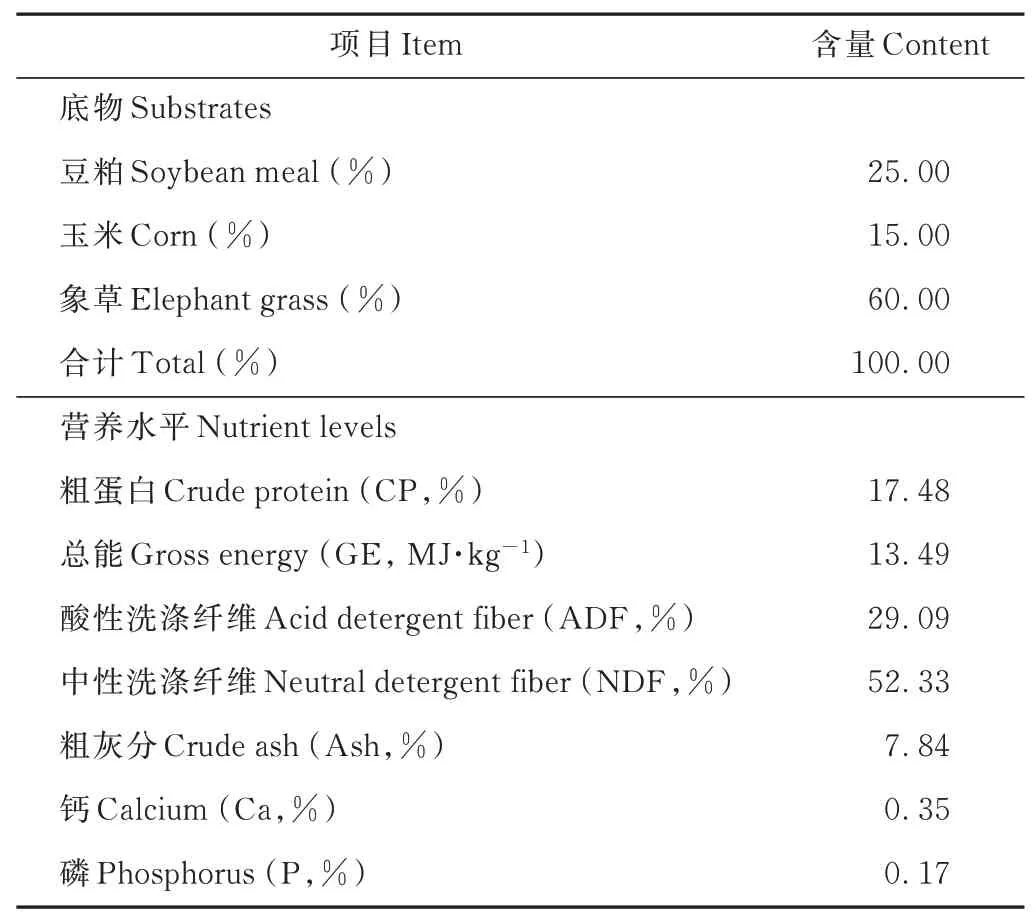
表1 底物組成及營養水平Table 1 Composition and nutrient levels of the substrate
1.4 樣品采集及分析
在培養3、6、9、12、24 h時,分別測定發酵瓶的產氣量和甲烷產量。取一帶軟細短管的注射器針頭,與100 mL潤滑的玻璃注射器連接,將針頭插入發酵瓶塞子,讀取注射器上的刻度并記錄數據。培養瓶凈產氣量(mL)=時間段產氣量(mL)-對應時間段空白均產氣量(mL),24 h累積總產氣量即各時間段培養瓶凈產氣量之和。用注射器測完產氣量,旋轉管塞排出管內氣體,然后用手動進樣針從發酵瓶抽取10 μL氣體測定甲烷含量,直接進樣至氣相色譜儀(Agilent 7890A,美國安捷倫科技公司),色譜柱為HP-INNOWAX(19091N-133)毛細管柱,規格為30 m×0.25 mm×0.25 μm,參照胡偉蓮等[9]的測定方法,測定條件為:柱溫80℃;氣化室溫度100℃;檢測室溫度120℃;載氣為高純氮氣,壓力179.5 Pa,總流量46.2 mL·min-1,柱流量2.7 mL·min-1,分流比15∶1,吹掃流量3 mL·min-1,循環流量100 mL·min-1;氫氣流量40 mL·min-1,空氣流量400 mL·min-1。24 h累積甲烷產量即各時間段培養瓶甲烷實際產量之和。
在培養24 h結束時,終止發酵。收集培養液,分別測定pH、氨態氮(ammonia nitrogen,NH3-N)、微生物蛋白(microbial protein,MCP)、揮發性脂肪酸(volatile fatty acid,VFA)、中長鏈脂肪酸和微生物數量等指標。用pH計(HANNA HI 8424,上海何亦儀器儀表有限公司)測定培養液pH值,測定前pH計先用緩沖液進行校正;采用苯酚-次氯酸鈉比色法[10]測定NH3-N含量;采用考馬斯亮藍G250染色法測定MCP含量;參照Li等[11]的方法測定VFA含量;采用氣相色譜儀(Agilent 7890A,美國安捷倫科技公司)測定巴豆酸作內標物,色譜柱為HPINNOWAX(19091N-133)毛細管柱,自動進樣器(Agilent G4513A,美國安捷倫科技公司),測定條件:氣化室溫度200℃;檢測室溫度220℃;柱溫采用程序升溫:80℃持續1 min,以15℃·min-1升溫至170℃后維持1.5 min;載氣為高純N2,壓力100 kPa,總流量63.8 mL·min-1,柱流量1.19 mL·min-1,分流比50∶1,吹掃流量3 mL·min-1,循環流量30 mL·min-1;氫氣流量40 mL·min-1,空氣流量400 mL·min-1;進樣量2.0 μL;采用氯仿/甲醇/BHT提取法測定瘤胃液中長鏈脂肪酸;采用硫酸甲醇酯化法測定甲酯化;利用氣相色譜儀(Agilent 7890B,美國安捷倫科技公司)測定中長鏈脂肪酸含量;參照Xu等[12]的方法,用毛細管氣相色譜-氫火焰離子化檢測器(GC-FID)和HP-88脂肪酸甲酯測定專用毛細管柱;用C17:0內標法檢測中長鏈脂肪酸含量,測定條件:載氣為高純He,流量1.1 mL·min-1;氫氣流量40 mL·min-1;空氣流量450 mL·min-1,分流比20∶1,進樣量1.0 μL。進樣口溫度為250℃,FID檢測器溫度為250℃;柱箱程序升溫:初始溫度為150℃,持續5 min,以2℃·min-1的速率升至175℃,持續15 min,再以7℃·min-1的速率升至200℃,持續20 min,最后以5℃·min-1的速率升至220℃,持續25 min;參照Denman等[13]的十六烷基三甲基溴化銨(cetyltrimethylammonium bromide,CTAB)法提取微生物總DNA,采用高通量實時熒光定量PCR儀(LightCycler 480,美國)測定微生物數量,具體參照Shingfield等[14]的方法。瘤胃液微生物的引物由上海生工生物工程公司合成,具體引物序列見表2。

表2 Real-time PCR引物序列Table 2 Primers sequence of real-time PCR
1.5 統計分析
采用Excel軟件整理數據,用SPSS 18.0統計軟件進行單因子方差(One-way ANOVA)分析,Duncan法進行多重比較,差異顯著性以P<0.05為判斷標準,試驗結果以平均值±標準誤(mean±SE)表示。
2 結果與分析
2.1 不同劑量硝酸鈉對產氣參數及瘤胃體外發酵參數的影響
與對照相比,添加硝酸鈉顯著降低了瘤胃培養液24 h累積總產氣量和總甲烷含量(P<0.05),并隨著硝酸鈉濃度的增加,甲烷含量顯著降低(P<0.05),1、2和3 mg·mL-1硝酸鈉處理,甲烷含量分別降低了68.62%、74.04%、77.31%。添加硝酸鈉培養液的pH值、NH3-N含量顯著高于對照組(P<0.05),對MCP含量影響差異不顯著(P>0.05)。添加硝酸鈉的異丁酸濃度顯著低于對照組(P<0.05),1、2 mg·mL-1硝酸鈉組的異戊酸濃度顯著低于對照組和3 mg·mL-1硝酸鈉組(P<0.05),而添加硝酸鈉對其他VFA含量和乙酸/丙酸影響差異不顯著(P>0.05)(表3)。
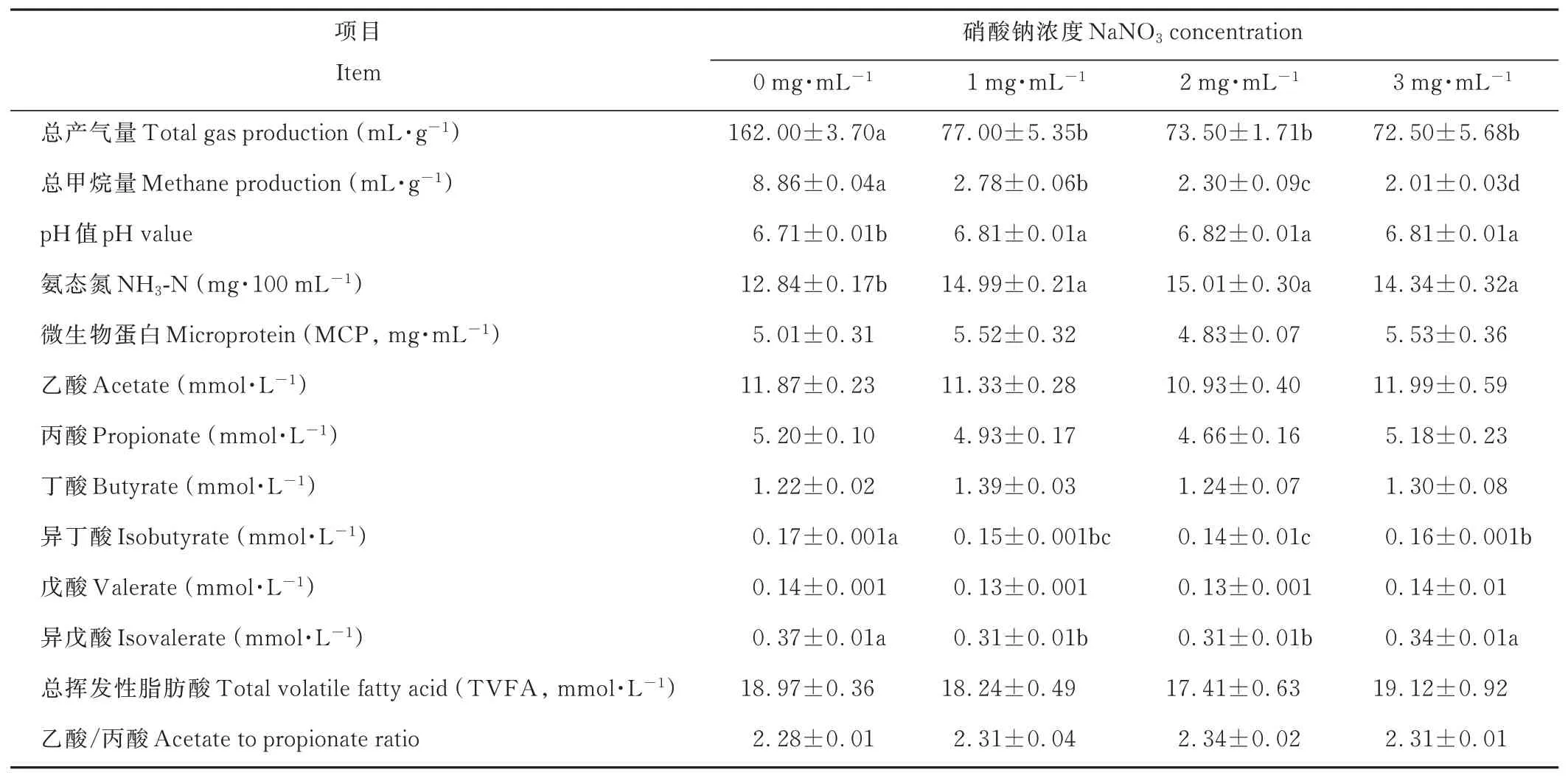
表3 體外發酵24 h后的累積總產氣量、總甲烷量、pH值、氨態氮、微生物蛋白和揮發性脂肪酸含量Table 3 The cumulative total gas production,total methane production,pH value,NH3-N,MCP and volatile fatty acid content after 24 h in vitro fermentation
2.2 添加不同劑量硝酸鈉對瘤胃液中長鏈脂肪酸組成的影響
添加3 mg·mL-1硝酸鈉組C6:0含量顯著高于其他組(P<0.05);2、3 mg·mL-1硝酸鈉組C10:0含量顯著高于其他組(P<0.05);3 mg·mL-1硝酸鈉組t11-C18:1含量顯著高于對照組(P<0.05);1 mg·mL-1硝酸鈉組C18:2cis-9,trans-11、C18:2trans-10,cis-12含量和UFA/SFA顯著高于其他組(P<0.05);3 mg·mL-1硝酸鈉組C19:0含量顯著高于其他組(P<0.05);3 mg·mL-1硝酸鈉組C21:0含量顯著低于對照組和2 mg·mL-1硝酸鈉組(P<0.05);1 mg·mL-1硝酸鈉組C20:5n3(EPA)含量顯著高于3 mg·mL-1硝酸鈉組(P<0.05);2 mg·mL-1硝酸鈉組C22:6n3(DHA)含量顯著高于其他組(P<0.05);2 mg·mL-1硝酸鈉組C22:1n9含量顯著低于對照組和3 mg·mL-1硝 酸 鈉 組(P<0.05);2、3 mg·mL-1硝 酸 鈉 組C22:2n6、PUFA、UFA含 量 顯 著 低 于 其 他 組(P<0.05)(表4)。
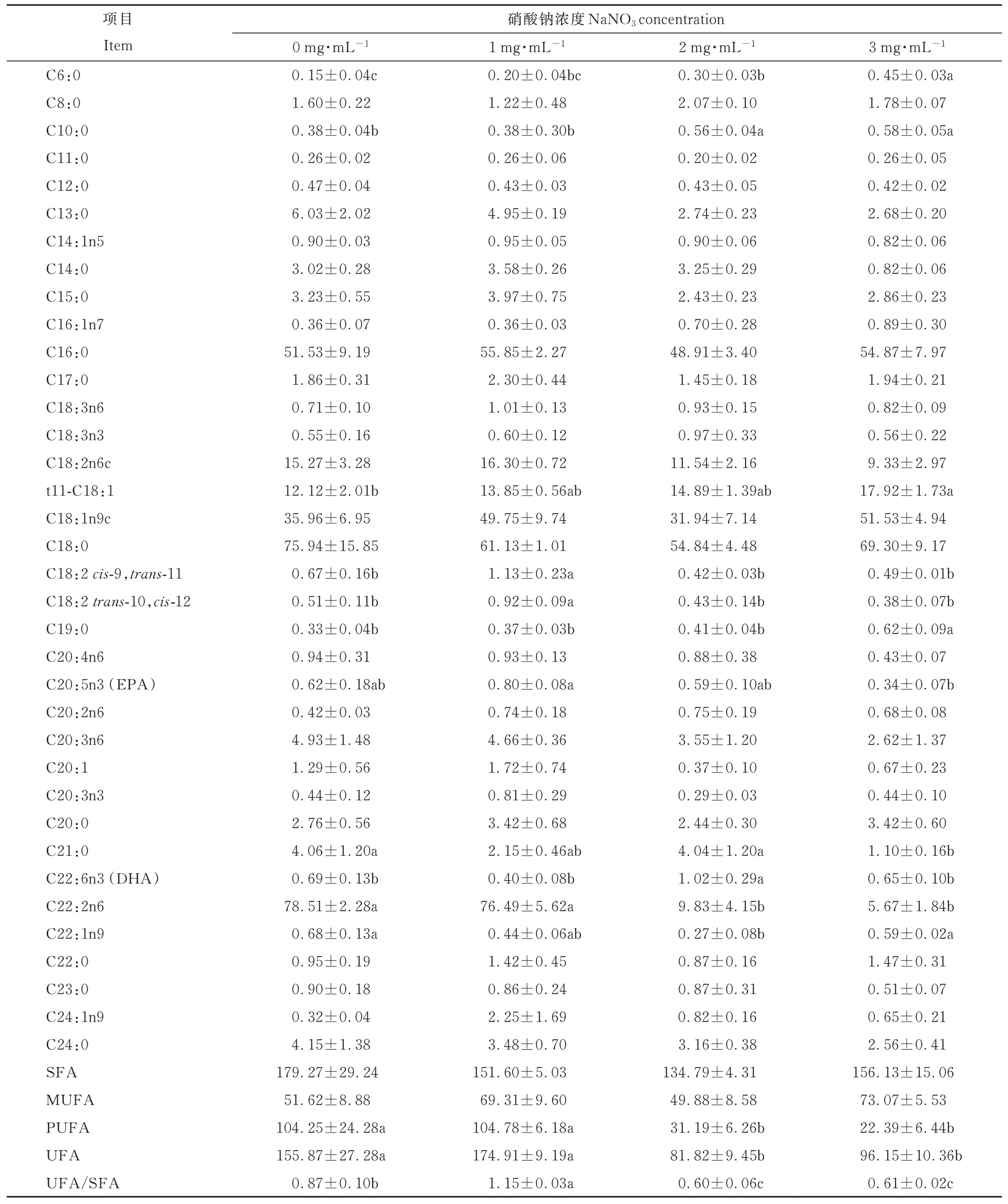
表4 添加不同劑量硝酸鈉對體外發酵瘤胃液脂肪酸濃度的影響Table 4 Effect of adding sodium nitrate of different doses on fatty acid concentration of rumen fluid in vitro(μg·mL-1)
2.3 添加不同劑量硝酸鈉對瘤胃微生物數量的影響
1 mg·mL-1硝酸鈉組瘤胃液的總細菌、真菌、溶纖維丁酸弧菌、蛋白分解丁酸弧菌、非典型丁酸弧菌、亨氏丁酸弧菌數量顯著高于其他組(P<0.05);2、3 mg·mL-1硝酸鈉瘤胃液的產甲烷菌數量顯著低于1 mg·mL-1硝酸鈉組(P<0.05);添加硝酸鈉瘤胃液的原蟲數量顯著低于對照組(P<0.05)(表5)。
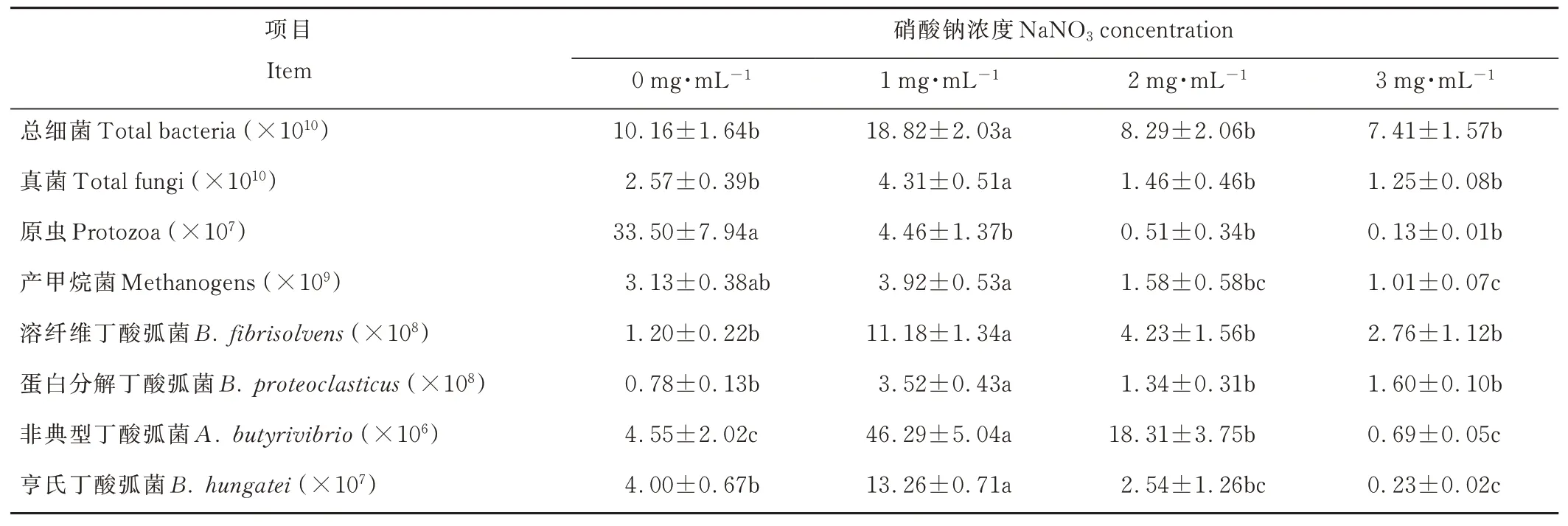
表5 添加不同劑量硝酸鈉對瘤胃微生物數量的影響Table 5 Effects of adding sodium nitrate of different doses on the number of rumen microorganisms(copies·mL-1)
3 討論
瘤胃微生物發酵碳水化合物所產生的乙酸、丙酸和丁酸等揮發性脂肪酸是反芻動物能量的重要來源,其產量及比例可影響反芻動物對營養物質的消化、吸收和利用。硝酸鹽類物質在瘤胃內的代謝途徑與尿素等非蛋白氮相似,可作為非蛋白氮為反芻動物提供氮源。硝酸鹽在瘤胃中先被還原為亞硝酸鹽,亞硝酸鹽再進一步被轉化為氨,此過程消耗氫氣,理論上可降低瘤胃甲烷生成量,并且氨和瘤胃中的有機酸作為營養物質能促進瘤胃微生物菌體蛋白的合成。本試驗中添加1、2、3 mg·mL-1硝酸鈉均顯著降低了甲烷產量,與Nguyen等[18]和Sar等[19]硝酸鹽抑制甲烷產生的結果一致,表明與甲烷菌CO2-H2的還原途徑相比,硝酸根離子較強的氧化性更有利于被氫氣還原。瘤胃液pH值和NH3-N含量顯著升高,TVFA含量沒有顯著變化,各培養液pH值(6.71~6.82)均處在正常范圍內(5.6~7.5),而穩定的pH值是瘤胃內環境和飼料消化的關鍵。瘤胃液pH值主要受到TVFA含量和氨濃度的影響,Sar等[19]報道硝酸鹽的氨化作用提高了氨濃度,pH值隨之升高,本試驗也驗證了此觀點。Zhou等[20]研究發現添加硝酸鹽使丙酸濃度和TVFA含量顯著下降,乙丙酸比例卻隨之增加,而本試驗結果與之不同,原因可能是硝酸鹽的添加量和試驗動物有所不同。硝酸鹽還原過程所需的氫原子同時來自甲烷和丙酸的生成過程[21],所以會存在氫原子競爭,硝酸鈉還原過程可能對甲烷和乙丙酸的利用具有選擇性,該推測有待驗證。
不飽和游離脂肪酸在瘤胃內壽命很短暫,會被瘤胃微生物迅速加氫生成飽和產物,此為生物氫化過程。丁酸弧菌屬細菌在亞油酸氫化過程中起重要作用,有研究報道[22],亞油酸將c12-鍵異構為t11-鍵生成共軛亞油酸C18:2cis-9,trans-11,再氫化成t11-C18:1,溶纖維丁酸弧菌在這兩個過程中起主要作用;而蛋白分解丁酸弧菌和亨氏丁酸弧菌可以實現t11-C18:1氫化為C18:0[23-24]。最后一步氫化過程比之前的步驟慢得多,造成了t11-C18:1在瘤胃中的累積。因此當多種微生物共同作用時,t11-C18:1氫化就成為限速步驟,它控制著整個生物氫化過程的速率。在本試驗中添加硝酸鈉后t11-C18:1含量顯著升高,添加1 mg·mL-1硝酸鈉后瘤胃內C18:2cis-9,trans-11、C18:2trans-10,cis-12、UFA/SFA和丁酸弧菌屬含量顯著升高,表明硝酸鈉作為耗氫化合物可以影響亞油酸氫化途徑,使t11-C18:1形成增多,促進了CLA的增加,低劑量硝酸鈉利于丁酸弧菌的生長和UFA/SFA的提高。這證明溶纖維丁酸弧菌有利于t11-C18:1和CLA的形成,而蛋白分解丁酸弧菌和亨氏丁酸弧菌對t11-C18:1氫化為C18:0的過程沒有影響。也有研究者[25]認為丁酸弧菌不影響脂肪酸生物氫化反應的進行。有研究[26]報道在添加α-亞麻酸條件下,1 mg·mL-1硝酸鈉在抑制甲烷產生的同時能夠降低不飽和脂肪酸的生物氫化程度,提高CLA含量,本試驗結果與之相類似。瘤胃微生物的組成、數量和生物氫化過程受到很多因素的影響,各個過程的氫轉移機制及相互關聯可做進一步探究。
硝酸鈉在瘤胃的還原途徑以異化還原為主,如果反芻動物在短時間內攝入大量硝酸鈉,轉化過程中如亞硝酸鈉含量不能被及時分解利用,超過了微生物將其轉化為氨的能力時,就會對動物機體造成毒害作用,所以必須嚴格控制使用劑量。有研究[27]表明硝酸鈉能降低甲烷產生的主要原因有兩個:競爭氫原子和對瘤胃產甲烷微生物的抑制。事實上,原蟲也是除產甲烷菌以外產生甲烷的主要來源[28]。硝酸鹽通過還原產物亞硝酸鹽對包括原蟲在內的瘤胃微生物產生毒害作用,從而抑制原蟲[29]。在本試驗中添加硝酸鈉后甲烷產量和原蟲數量顯著降低,產甲烷菌數量在添加2、3 mg·mL-1硝酸鈉水平下顯著降低,非典型丁酸弧菌和亨氏丁酸弧菌數量在3 mg·mL-1硝酸鈉水平下顯著降低,也證實了硝酸鈉可以通過抑制產甲烷微生物來降低甲烷產量,并且高劑量硝酸鈉可能對瘤胃微生物產生了不利影響。孫雨坤[30]從肉羊體外試驗得出隨著硝酸鹽濃度的增加,原蟲數量減少,甲烷濃度也隨之降低,本試驗結果與之相似。添加1 mg·mL-1硝酸鈉后瘤胃總細菌、真菌及丁酸弧菌屬細菌數量顯著高于對照組,可以看出低劑量硝酸鈉可以促進瘤胃大多微生物的增加。硝酸鹽有降低甲烷排放和抑制亞油酸氫化的潛力,但需要結合更多的體內試驗總結出硝酸鹽的適宜添加量。
4 結論
體外添加0.25 mg·mL-1亞油酸條件下,1~3 mg·mL-1硝酸鈉均能抑制水牛瘤胃甲烷產生,并不影響TVFA含量。并且1 mg·mL-1硝酸鈉能促進亞油酸生成CLA,升高EPA含量和UFA/SFA,優化脂肪酸組成,并能增加總細菌、真菌、丁酸弧菌等大多數瘤胃微生物的數量。

