微藻原生質體制備技術研究進展
徐曉瑩 史文凱 姜作真 賀加貝 曹亞男 劉燕英
摘 要:總結概括了微藻原生質體制備技術,并對原生質體制備過程中的影響因素進行了深入探討。在此基礎上,論述了原生質體制備技術在微藻中的應用研究進展,展望了該技術的應用前景。
關鍵詞:微藻;原生質體制備;研究進展
中圖分類號:S917
1 原生質體概述
原生質體是指細胞完全去除細胞壁后被細胞膜所包圍的、具活力的細胞。原生質體擔負著細胞的所有生命活動,是細胞生命活動的物質基礎[1]。在原生質體基礎上可進行一系列技術操作,主要包括原生質體再生、原生質體融合和轉基因等培育選育新類型的生物技術等。上述技術的關鍵是對細胞壁進行消化,以形成大量有活力的原生質體,并使原生質體高效地再生細胞壁,恢復到正常細胞狀態。原生質體結構簡單、發育同步性好、遺傳物質易于進入細胞、易于再生分化完整植株等特點[2]使原生質體的研究越來越受到重視。另外,原生質體培養技術與有關分子、細胞和遺傳等學科相互交叉滲透,為高等植物的分子水平和細胞水平遺傳操作提供理想的實驗體系。
2 微藻原生質體制備技術
早在1892年,藻類原生質體首次使用機械法被分離出來,但該機械法靠手工操作,難度大,只限于能廣泛發生質壁分離的組織,對膠質物含量較高的藻類分離效果不佳,原生質體的得率低。后來研究者發現酶液能降解細胞壁[3],開辟了酶法制備原生質體的新途徑。酶具有很強的專一性,同時水解條件十分溫和,在細胞能夠承受的范圍之內,對細胞傷害較小,原生質體的產率較高,可以獲得大量有活力的原生質體,從而為研究提供必要原生質體材料[4]。
早期酶法制備原生質體過程中的酶主要來源于生物體內,如微生物來源的微藻解壁酶(瓊膠酶、褐藻酸酶、卡拉膠酶、甘露聚糖酶、木聚糖酶、紫菜聚糖酶[5-6]等)和動物來源的微藻解壁酶(褐藻酸酶[7]、鮑酶、海螺酶Ⅲ、石鱉酶和笠貝酶[8])。目前,廣泛用于原生質體制備的酶主要有纖維素酶[4]、半纖維素酶、果膠酶[4]、幾丁質酶、蛋白酶、崩潰酶、離析酶等。
3 酶法制備原生質體的影響因素
影響微藻原生質體制備的因素有很多,如酶的種類、濃度、酶解時間、酶解液pH值、藻細胞生長時期等因素。根據不同藻類細胞壁成分的不同,原生質體制備過程中需針對性地采用不同的水解酶。如藍藻的細胞壁含有黏肽,因而可用溶菌酶處理獲得藍藻細胞的原生質體;綠藻的細胞壁主要成分為纖維素,因此可以用纖維素酶處理而獲得原生質體[8-9];而紅球藻細胞壁中含有糖蛋白分子及少量纖維素或幾丁質[10-11],多糖降解酶去壁效果并不好[12]。
酶中往往含有對原生質體有害的物質,因此在去壁過程中,酶濃度并非越高越好,若酶濃度過大,細胞脫壁太徹底甚至對已脫壁的原生質體產生破壞作用,則大大降低原生質體的再生率。另外,實踐表明,控制合適的酶解時間對原生質體的制備也至關重要,如果酶處理時間太短,所獲得的原生質體量少而不能滿足實驗需要,但長時間的酶解又會破壞早期釋放的原生質體膜,導致原生質體破碎或再生率降低,從而影響原生質體的產量和細胞壁再生的能力[13]。
合適的酶解溫度及酶解液pH值是水解酶發揮作用的重要因素。酶解溫度直接影響酶促反應的速度,有研究表明,酶處理一般在10~30 ℃下進行90 min。不同水解酶的最適溫度也存在差異,如果膠酶的最適溫度為25 ℃,而纖維素酶和半纖維素酶的適宜溫度為30 ℃。酶解液pH值不僅影響酶的活力和底物的特性,改變溶壁效果,而且影響已脫壁原生質體的穩定性。所以原生質體制備的最適pH值與制備過程中所用酶的種類以及細胞壁的成分密切相關[14]。
原生質體的制備效率受藻細胞不同生長時期的影響較大,對數期的藻細胞代謝活躍,生長速率高,群體細胞的化學組成、形態及生理特征比較一致,并且細胞壁較薄,因此,使用對數生長期的細胞制備原生質體時產率最高[4]。
藻細胞密度也對酶解效果有一定的影響,通過對不同密度藻細胞進行酶處理相同時間比較發現,在一定范圍內,原生質體的制備率隨著細胞密度的增加而增加,原因可能是藻細胞密度高,相互之間接觸比較頻繁,更有利于酶混合液的消化作用[15]。
眾多研究表明,阻礙微藻原生質體制備技術發展的主要障礙在于微藻細胞壁成分的多樣性和復雜性。各種微藻細胞壁的組成差異巨大,甚至不同藻種、不同生長環境微藻細胞壁組成不盡相同,使得各種微藻原生質體的制備條件也各不相同。因此要結合微藻細胞壁成分,選取一種或多種酶組成的混合酶來高效降解細胞壁,同時酶解時要考慮多重酶解環境因素的共同影響,是解決這一問題的有效途徑。張莉等[16]從煙臺海濱水域分離出一株四爿藻屬(Tetraselmis sp.)的藻株,應用響應曲面設計方法研究了混合酶的比例、濃度、緩沖液pH值等多參數的綜合效應,確定了該藻株原生質體制備的最適條件,得到了81.5%的理論最高制備率,與試驗驗證的80.5%的制備率誤差為1.24%,該研究為優化單細胞微藻原生質體制備條件提供了通用性模式。
4 藻類原生質體制備技術研究進展
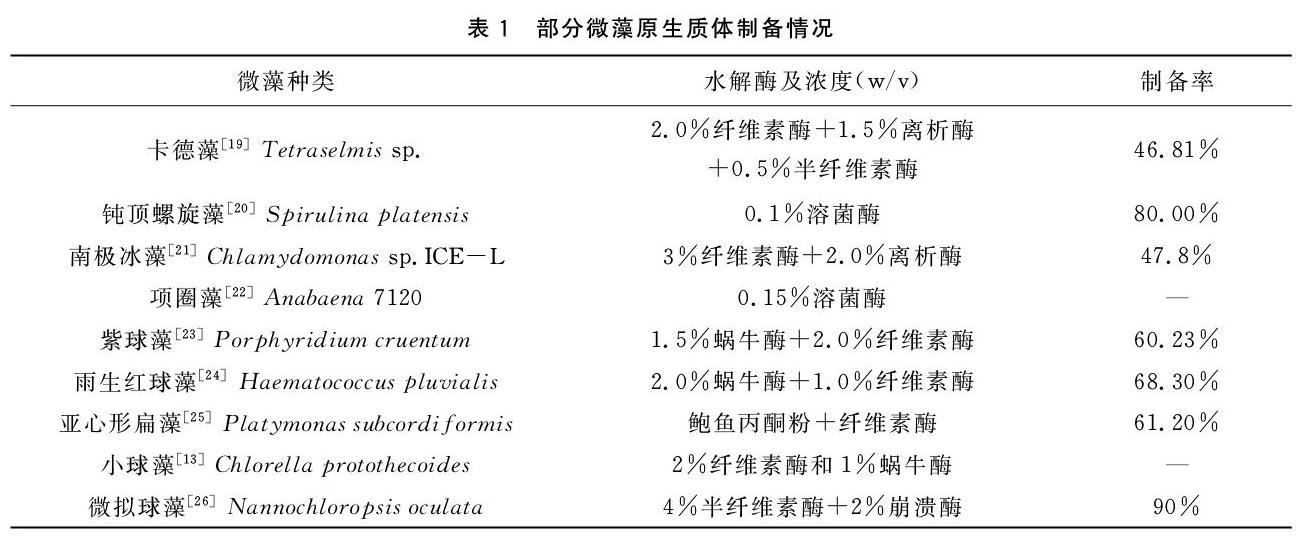
微藻的細胞操作始于20世紀50年代末期,Fushs成功分離得到一種絲狀藍藻——顫藻(Oscillatoria amoena)的原生質體[2]。1976年Berliner等[9]分離得到鼓藻的原生質體;1977年Berliner[17]成功制備小球藻(Chlorella Vulgaris)的原生質體;1989年Davies等[18]制備得到絲狀藍藻(Ulothrix gigas)的原生質體。隨后,其它種類微藻的原生質體也相繼制備成功。其中絕大部分屬于綠藻門(如布朗葡萄藻、衣藻、小球藻、雨生紅球藻、亞心形扁藻等),除此之外,只有少數幾株藍藻門(螺旋藻、項圈藻等)和紅藻門(紫球藻等)的藻株原生質體成功分離。表1列出了2000年以來部分微藻原生質體的制備情況。
隨著越來越多的藻類原生質體被成功分離,研究者對酶解去壁過程以及細胞壁超微結構也進行了詳細的研究。Yamada等[27]利用透射顯微技術和掃描顯微技術對橢圓小球藻(Chlorella ellipsoidea)細胞壁的酶解過程中細胞超微結構進行了較為詳細的研究,試圖解釋藻細胞能夠形成原生質體以及闡述細胞壁結構和細胞穩定性之間的關系。Yamada等[28]的另一研究發現,小球藻的細胞壁結構可以分為三種類型,分別為胞壁外有三層的外層結構、胞壁外有一薄的單層結構和胞壁外沒有外層結構。經酶解實驗表明,只有胞壁外有一薄的單層結構類型細胞壁的小球藻株可以用酶解的方法直接形成原生質體。
對于生活史中多種細胞形態交互變化的雨生紅球藻,其細胞壁是由糖蛋白分子以及少量的纖維素和幾丁質組成,所以Tjahjono等[29]提出以蛋白酶K來制備其原生質體。隨后葉濤等[24]等用酸性緩沖液、EDTA和二硫蘇糖醇配制而成的預處理劑處理雨生紅球藻細胞,然后以纖維素酶、蝸牛酶和酸性緩沖液組成的復合高滲酶溶液來分離得到原生質體,制備率可達68.3%。但是,在雨生紅球藻生活史中存在包括游動細胞和不動細胞等多種細胞類型[30-32],其細胞壁結構及組成均存在較大差異。游動細胞原生質體外僅被透明、凝膠狀的胞外基質所包被,而不動細胞形成了厚而致密的細胞壁[33]。Triki等[34]曾提出用蛋白酶K和纖維素酶分別處理雨生紅球藻游動細胞和不動細胞,但并沒有詳細分析二者的區別。以往這些原生質體制備的研究中并未針對雨生紅球藻生活史中特定細胞,且需要進行破壁預處理,方法繁瑣,耗時較長,所需酶種類較多,這些問題使雨生紅球藻原生質體后續的遺傳等操作受到了極大的限制。直到2017年,Cheng等[35]首次將雨生紅球藻生活史中游動細胞和不動細胞均應用于原生質體制備,結果發現蛋白酶K對于兩種細胞原生質體的釋放均有效,其中游動細胞經蛋白酶K處理后可獲得90%的原生質體釋放效率;而不動細胞酶解過程中同時添加了纖維素酶和蝸牛酶來促進纖維素細胞壁的降解,但因次生細胞壁難以降解,原生質體釋放效率僅為40%。該研究首次報道了酶解液中添加Ca2+能有效提高雨生紅球藻游動細胞的穩定性,進而提高原生質體制備效率。
5 總結與展望
由于微藻復雜多樣的細胞壁組成和結構,微藻原生質體制備的相關技術發展較為緩慢,其應用仍處于發展階段。微藻原生質體的成功制備為其細胞和分子水平的操作提供了良好的實驗操作體系,將帶動由原生質體出發而進行的有關微藻生理、生化、遺傳學等多種實驗技術的發展,對微藻養殖、遺傳育種以及高附加值產物的生產都有重要的意義。
參考文獻:
[1] MURALIDHAR R V,PANDA T.Fungal protoplast fusion-A revisit[J].Bioprocess Engineering,2000,22(5):429-431.
[2] 林學政,沈繼紅,李光友.海藻原生質體融合及雜交技術的研究進展[J].海洋科學,2000,24(8):1-3.
[3] CRAIK J C A.Egg quality and egg pigment content in salmonid fishes[J].Aquaculture,1985,47(1):61-88.
[4] MARCHANT H J,FOWKE L C.Preparation,culture and regeneration of protoplasts from filamentous algae[J].Canadian Journal of Botany-Revue Canadienne De Botanique,1977,55(24):3080-3086.
[5] 韓寶芹,劉萬順,王海,等.海藻解壁酶研究[J].海洋科學,1997(3):47-49.
[6] 韓寶芹,劉萬順,戴繼勛,等.褐藻酸降解菌的發酵培養及褐藻酸酶對褐藻細胞的解離作用[J].海洋科學,1997(2):39-43.
[7] 查向東,KLOAREGE B.裙帶菜配子體原生質體培養[J].安徽農業大學學報,1996,23(4):157-160.
[8] AACH H G,FEYEN S B.Studies on Chlorella protoplasts:Demonstration of proto-plastic nature and regeneration of cell wall [J].Planta,1978,139(3):257-260.
[9] BERLINER M D,WENC K A.Protoplast induction in Micrasterias and Cosmarium[J].Protoplasma,1976,89(3-4):389-393.
[10] ROBERTS K,GRIEF C,HILLS G J,et al.Cell wall glycoproteins:structure and function[J].Journal of Cell Science,1985(S2):105-127.
[11] MATSUDA Y.The Chlamydomonas cell walls and their degrading enzymes[J].Jpn.J.Phycol,1988,36:246-264.
[12] SAGA N,SANBONSUGA Y.Tissue culture and genetic engineering for seaweed aquaculture[J].NOAA Technical Reports NMFS,1988,70:47-54.
[13] LU Y Z,KONG R,HU L.Preparation of protoplasts from Chlorella protothecoides[J].World J Microbiol Biotechnol,2012,28:1827-1830.
[14] LUO Y,DING X,XIA L,et al.Conditions for protoplast preparation of spinosyn-producing strain and the physiological properties of protoplast-regenerated strains[J].Chinese Journal of Biotechnology,2009,25(3):360-7.
[15] 馬曉磊,張琳,楊官品,等.微擬球藻原生質體制備與再生[J].海洋科學,2012,36(2):19-23.
[16] 張莉,丁涓,郝宇晨,等.一株海洋微藻的鑒定及其原生質體制備條件優化[J].中國生物工程雜志,2018,38(11):42-50.
[17] BERLINER M D.Protoplast Induction in Chlorella Vulgaris[J].Plant Science Letters,1977,9(2):201-204.
[18] DAVIES E,KUCZMARSKI D.Effect of light and Triton X-100 on the size of protoplasts from Ulothrix gigas[J].Photochemistry and Photobiology,1989,50(5):591-595.
[19] 林學政,沈繼紅,李光友.復合酶對卡德藻溶壁效果的研究[J].海洋科學,2000,24(7):1-4.
[20] 郭厚良,趙以軍.鈍頂螺旋藻(Spirulina platensis)原生質球制備和液泡分離[J].中國科學基金,2000,14(6):356-358.
[21] LIU S ,LIU C ,HUANG X ,et al.Optimization of parameters for isolation of protoplasts from the Antarctic sea ice alga Chlamydomonas sp.ICE-L[J].Journal of Applied Phycology,2006,18(6):783-786.
[22] ZHAO K,BAI W,MI H.Dielectric spectroscopy of Anabaena 7120 protoplast suspensions[J].Bioelectrochemistry,2006,69(1):49-57.
[23] 王明茲,王世鋒,施巧琴,等.紫球藻原生質體再生育種[J].福建師范大學學報(自然科學版),2007,23(1):65-69.
[24] 葉濤,王明茲,黃建忠,等.雨生紅球藻原生質體制備與再生育種[J].福建師范大學學報(自然科學版),2011,27(4):122-126.
[25] CUI Y,WANG J,JIANG P,et al.Transformation of Platymonas (Tetraselmis) subcordiformis (Prasinophyceae,Chlorophyta) by agitation with glass beads[J].World Journal of Microbiology & Biotechnology,2010,26(9):1653-1657.
[26] 馬曉磊,張琳,楊官品,等.微擬球藻原生質體制備與再生[J].海洋科學,2012,36(2):19-23.
[27] YAMADA T,SAKAGUCHI K.Electron microscopic studies of Chlorella ellipsoidea protoplast formation[J].Journal of General Microbiology,1982,128(JUN):1319-1327.
[28] YAMADA T,SAKAGUCHI K.Comparative studies on Chlorella cell walls:Induction of protoplast formation[J].Archives of Microbiology,1982,132(1):10-13.
[29] TJAHJONO A E,KAKIZONO T,HAYMA Y,et al.Formation and regeneration of protoplast from a unicellular green alga Haematococcus pluvialis[J].Journal of Fermentation and Bioengineering,1993,75(3):196-200.
[30] LEE Y K,DING S Y.Cell cycle and accumulation of astaxanthin in Haematococcus lacustris (chlorophyta)[J].Journal of Phycology,1994,30(3):445-449.
[31] ELLIOT A M.Morphology and life history of Haematococcus pluvialis[J].Arch.Protistenk,1934,82:250-272.
[32] TRIKI A,MAILLARD P,GUDIN C.Gametogenesis in Haematococcus pluvialis Flotow (Volvocales,Chlorophyta)[J].Phycologia,1997,36(3):190-194.
[33] HAGEN C,SIEGMUND S,BRAUNE W.Ultrastructural and chemical changes in the cell wall of Haematococcus pluvialis (Volvocales,Chlorophyta) during aplanospore formation[J].European Journal of Phycology,2002,37(2):217-226.
[34] TRIKI A,MAILLARD P,GUDIN C.Protoplasts from zoospores and cysts of Haematococcus pluvialis alga (Chlorophyta,Volvocales)[J].Russian Journal of Plant Physiology,1997,44(6):809-815.
[35] CHENG T ,XU X ,ZHANG W ,et al.Protoplast preparation from enriched flagellates and resting cells of Haematococcus pluvialis[J].Journal of Applied Microbiology,2017,124(2).
Abstract:The development of microalgae protoplast preparation technology was summarized and the influencing factors during the preparation process was discussed.Moreover,the research progress of protoplast preparation technology in microalgae was also discussed.
Key words:microalgae;protoplast preparation;research progress
(收稿日期:2021-07-15)

