木香烴內酯對乳腺癌SK-BR-3細胞周期分布及凋亡的影響
馬強 陳潔 苗加偉 熊書 龐毅 鄧雪松


中圖分類號 R737.9;R285 文獻標志碼 A 文章編號 1001-0408(2021)17-2073-06
DOI 10.6039/j.issn.1001-0408.2021.17.05
摘 要 目的:研究木香烴內酯(COS)對人乳腺癌SK-BR-3細胞周期分布及凋亡的影響,并探討其機制。方法:將人乳腺癌SK-BR-3細胞分為空白對照組和COS 10、20、30、40、50 μmol/L組,用MTT法檢測COS對細胞增殖的影響。另將細胞分為空白對照組和COS低、中、高濃度組(10、20、30 μmol/L),培養24 h后,采用流式細胞儀檢測細胞周期分布情況,采用Hoechst 33258熒光染色檢測細胞凋亡情況,采用Western blot法檢測抑癌因子p53、胱天蛋白酶3(caspase-3)、B細胞淋巴瘤2(Bcl-2)、Bcl-2相關X蛋白(Bax)、細胞周期依賴性蛋白激酶抑制因子1A(p21)、周期蛋白依賴性激酶2(CDK2)和細胞周期蛋白E(cyclinE)蛋白的表達情況。結果:與空白對照組比較,COS可顯著抑制SK-BR-3細胞的增殖(P<0.05或P<0.01),且呈濃度和時間依賴趨勢。低、中、高濃度的COS均可誘導細胞凋亡并阻滯細胞周期于G1/S期(P<0.05或P<0.01);并可顯著上調p53、caspase-3、Bax、p21蛋白的表達(P<0.05或P<0.01),顯著下調Bcl-2、CDK2、cyclinE蛋白的表達(P<0.01)。結論:COS能抑制人乳腺癌SK-BR-3細胞的增殖,并誘導細胞凋亡和周期阻滯;其作用機制可能與調控p53/Bax/Bcl-2/caspase-3凋亡信號通路有關。
關鍵詞 木香烴內酯;SK-BR-3細胞;細胞增殖;細胞周期;細胞凋亡
Effects of Costunolide on Cell Cycle Distribution and Apoptosis of Breast Cancer SK-BR-3 Cells
MA Qiang1,2,CHEN Jie1,MIAO Jiawei1,XIONG Shu1,PANG Yi1,2,DENG Xuesong1,2(1. Dept. of Basic Medicine, Chongqing Three Gorges Medical College, Chongqing 404120, China; 2. Chongqing Key Laboratory of Development and Utilization of Genuine Medicinal Materials in Three Gorges Reservoir Area, Chongqing 404120, China)
ABSTRACT? ?OBJECTIVE: To study the effects of costunolide (COS) on the cell cycle distribution and apoptosis of human breast cancer SK-BR-3 cells and its mechanism. METHODS: Human breast cancer SK-BR-3 cells were divided into blank control group, and COS groups of 10, 20, 30, 40, 50 μmol/L. MTT assay was used to detect the effects of COS on cell proliferation. SK-BR-3 cells were divided into blank control group, COS low, medium and high concentration groups (10, 20, 30 μmol/L). After cultured for 24 h, flow cytometry was used to detect the distribution of cell cycle. Hoechst 33258 fluorescence staining was used to detect cell apoptosis. Western blot assay was used to detect the expression of p53, caspase-3, Bcl-2, Bax, p21, CDK2 and cyclinE. RESULTS: Compared with blank control group, COS could significantly inhibit the proliferation of SK-BR-3 cells (P<0.05 or P<0.01), and in a dose and time-dependent manner. Low, medium and high concentrations of COS could induce cell apoptosis and arrest cell at G1/S phase (P<0.05 or P<0.01), could significantly up-regulate the protein expression of p53, caspase-3, Bax and p21 (P<0.05 or P<0.01), and could significantly down-regulate the protein expression of Bcl-2, CDK2 and cyclinE (P<0.01). CONCLUSIONS: COS can inhibit the proliferation of human breast cancer SK-BR-3 cells and induce cell apoptosis and cell cycle arrest. The mechanism may be related to the regulation of p53/Bax/Bcl-2/caspase-3 apoptosis signal pathway.
KEYWORDS? ?Costunolide; SK-BR-3 cells; Cell proliferation; Cell cycle; Cell apoptosis
乳腺癌(breast cancer)是女性病死率最高的惡性腫瘤,且發病率呈逐年上升的趨勢,其預防和治療已成為一個重要的公共衛生問題[1]。盡管臨床上有多種乳腺癌的治療手段可選擇,如化療、放療和激素治療等,但上述治療手段存在著導致患者免疫功能下降、消化障礙、炎癥反應等諸多副作用,故乳腺癌的治療仍需要更安全、更有效的臨床策略[2]。由此可見,尋找副作用小且效果顯著的抗癌藥物顯得尤為重要。
從藥用植物中提取分離的天然化合物是抗癌藥物的重要來源,這些天然化合物在各種癌癥及其他相關疾病的治療中已顯現出明顯的優勢[3]。與以單分子為靶點的傳統化療藥物相比,天然化合物能夠靶向同一途徑或多條相關途徑的多個因子,具有更好的治療效果和較低的毒副作用[3]。木香烴內酯(costunolide,COS)就是其中之一。該化合物是從菊科植物木香Aucklandia lappa Decne.中分離提取到的,屬于倍半萜內酯類化合物,具有抗炎、抗真菌感染、抗氧化等多種藥理學活性[4],并對肝癌、白血病、結腸癌等多種腫瘤細胞表現出較為明顯的抑制活性[5-7]。因此,本課題組推測該化合物可能是一種潛在的抗癌治療藥物。盡管目前已有學者在多種人類腫瘤細胞上對COS的抑制作用進行了探索[5-8],但該化合物對人乳腺癌細胞的影響尚未得到證實。基于此,本研究擬初步探討COS對人乳腺癌SK-BR-3細胞周期分布和凋亡的影響,并初步探討其潛在機制,以期為探索乳腺癌的治療方案提供研究基礎和理論依據。
1 材料
1.1 主要儀器
本研究所用的主要儀器包括ELx800型酶標儀(美國BioTek公司),CytoFLEX型流式細胞儀、Allegra-64R型臺式高速冷凍離心機(美國Beckman公司),MCO-15AC型細胞培養箱(日本SANYO公司),ChemiDoc Touch型化學發光成像系統(美國Bio-Rad公司),DMi8A型熒光倒置顯微成像系統(德國Leica公司)等。
1.2 主要藥品與試劑
COS對照品(批號HY-N0036,純度99.84%)購自美國MCE公司,用二甲基亞砜(DMSO)溶解配制成濃度為100 mmol/L的貯備液,分裝后于-20 ℃下保存,備用。
DMEM高糖培養基、0.25%胰酶(批號分別為C11995500BT、25200-056)均購自美國Gibco公司;4%多聚甲醛(批號P1110)購自北京索萊寶科技有限公司;胎牛血清(FBS)、青霉素及鏈霉素雙抗溶液(批號分別為SH30084.03、J130071)均購自美國Hyclone公司;細胞周期檢測試劑盒(批號WLA010a)購自沈陽萬類生物科技有限公司;MTT試劑、DMSO(批號分別為1334MG250、BS087)均購自合肥志宏生物技術有限公司;Hoechst 33258熒光染色試劑盒(批號A3466)購自美國APExBIO公司;ECL化學發光顯色液(批號P10100)購自蘇州新賽美生物科技有限公司;RIPA細胞裂解液、二喹啉甲酸(BCA)蛋白濃度測定試劑盒(批號分別為P0013K、P0012)均購自上海碧云天生物技術有限公司;兔抗人抑癌因子p53多克隆抗體、兔抗人胱天蛋白酶3(caspase-3)多克隆抗體、兔抗人B細胞淋巴瘤2(Bcl-2)多克隆抗體、兔抗人Bcl-2相關X蛋白(Bax)多克隆抗體、兔抗人細胞周期依賴性蛋白激酶抑制因子1A(p21)多克隆抗體、兔抗人周期蛋白依賴性激酶2(CDK2)多克隆抗體、兔抗人細胞周期蛋白E(cyclinE)多克隆抗體、兔抗人β-肌動蛋白(β-actin)多克隆抗體(批號分別為ab32389、ab32351、ab32124、ab32503、ab109520、ab32147、ab33911、ab8227)均購自英國Abcam公司;辣根過氧化物酶(HRP)標記的山羊抗兔免疫球蛋白G(IgG)二抗(批號TJ271921)購自美國Invitrogen公司;其余試劑均為分析純,水為超純水。
1.3 細胞
人乳腺癌SK-BR-3細胞系由中國科學院上海細胞庫提供。
2 方法
2.1 細胞的培養及分組
將SK-BR-3細胞接種于含10%FBS、100 U/mL青霉素和100 μg/mL鏈霉素的DMEM高糖培養基(以下簡稱“完全培養基”)中,置于37 ℃、5%CO2、97%濕度的培養箱中培養(培養條件下同),待細胞融合至85%時用0.25%胰酶消化,再進行傳代培養并用于后續實驗。取對數增殖期的SK-BR-3細胞,隨機分為空白對照組和COS 10、20、30、40、50 μmol/L組。空白對照組僅加入完全培養基(下同),COS組分別加入含COS終濃度為10、20、30、40、50 μmol/L的完全培養基。上述COS的給藥濃度參考文獻[9-10]和本課題組前期預實驗結果設置。
2.2 細胞增殖活性檢測
采用MTT法進行檢測。取對數增殖期的SK-BR-3細胞,用完全培養基重懸,制成密度為6×104 mL-1的懸液,按每孔100 μL接種至96孔板中,培養24 h。按“2.1”項下方法將細胞分組,每組設9個復孔。空白對照組加入完全培養基100 μL,各藥物組加入含相應藥物的完全培養基100 μL;分別于培養24、48、72 h時,加入終質量濃度為0.5 mg/mL的MTT試劑50 μL,繼續培養4 h;吸棄培養基,加入DMSO 150 μL,于搖床上振搖1~2 min后,使用酶標儀于490 nm波長處檢測各孔的光密度(OD)值并計算細胞生長抑制率:細胞生長抑制率=(OD空白對照組-OD檢測組)/OD空白對照組×100%。
2.3 細胞凋亡率檢測
采用Hoechst 33258熒光染色法進行檢測。取對數增殖期的SK-BR-3細胞,用完全培養基重懸,制成密度為5×104 mL-1的懸液,按每孔2 mL接種至含無菌蓋玻片的6孔板中,培養24 h。將細胞隨機分為空白對照組和COS低、中、高濃度組(10、20、30 μmol/L,劑量參考“2.2”項下結果設置),每組設3個復孔。空白對照組加入完全培養基2 mL,各藥物組加入含相應藥物的完全培養基2 mL;培養48 h后,按Hoechst 33258熒光染色試劑盒說明書方法進行固定、染色,并置于倒置熒光顯微鏡下觀察并拍照,并參考文獻[11]方法計算細胞凋亡率:細胞凋亡率=凋亡細胞數/細胞總數×100%。
2.4 細胞周期分布情況檢測
采用流式細胞儀進行檢測。取對數增殖期的SK-BR-3細胞,用完全培養基重懸,制成密度為5×104 mL-1的懸液,按每皿3 mL接種至直徑60 mm的培養皿中,培養24 h。按“2.3”項下方法將細胞分組,每組設3個平行皿。空白對照組加入完全培養基3 mL,各藥物組加入含相應藥物的完全培養基3 mL;培養48 h后,收集細胞,加入70%乙醇于4 ℃下固定過夜,隨后用預冷的磷酸鹽緩沖液(PBS,pH 7.4)洗滌2次,加入RNase A試劑100 μL重懸,于37 ℃水浴中孵育30 min;加入PI染色液500 μL,混勻,于4 ℃避光條件下孵育30 min后,使用流式細胞儀檢測。使用ModFit LT 4.1細胞周期分析軟件處理,記錄各周期的細胞分布情況。
2.5 細胞凋亡和周期相關蛋白表達情況檢測
采用Western blot法進行檢測。取對數增殖期的SK-BR-3細胞,用完全培養基重懸,制成密度為5×106 mL-1的懸液,按每皿3 mL接種至直徑60 mm的培養皿中,培養24 h。按“2.3”項下方法將細胞分組,每組設3個平行皿。空白對照組加入完全培養基3 mL,各藥物組加入含相應藥物的完全培養基3 mL;培養48 h后,加入RIPA裂解液裂解細胞,并收集蛋白,采用BCA法測定蛋白濃度。蛋白經煮沸變性后,取適量行十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳,隨后轉移至PVDF膜上;以5%脫脂奶粉于室溫下封閉2 h,用TBST緩沖液洗滌3次;加入p53、caspase-3、Bcl-2、Bax、p21、CDK2、cyclinE、β-actin一抗(稀釋度均為1 ∶ 1 000),4 ℃孵育過夜;用TBST緩沖液洗滌3次,加入相應二抗(稀釋度為1 ∶ 3 000),室溫孵育2 h;加入ECL化學發光顯色液顯色后,置于化學發光成像系統下成像。使用Quantity One V4.6.6圖像分析軟件對蛋白條帶灰度值進行分析,以目標蛋白與內參蛋白(β-actin)的灰度值比值表示目標蛋白的相對表達量。
2.6 統計學方法
使用SPSS 18.0軟件進行統計分析。數據均以x±s表示,多組間比較采用單因素方差分析,組間兩兩比較采用LSD檢驗。檢驗水準α=0.05。
3 結果
3.1 COS對SK-BR-3細胞增殖的影響
與空白對照組比較,不同濃度的COS均能顯著抑制SK-BR-3細胞的增殖(P<0.05或P<0.01),并呈濃度、時間依賴趨勢,詳見表1。同時,在研究過程中筆者發現,當COS濃度較高(40、50 μmol/L)、作用時間較長(72 h)時,細胞大量死亡、漂浮,而貼壁細胞較少,故最終選擇10、20、30 μmol/L的COS作用48 h作為后續實驗的條件。
3.2 COS對SK-BR-3細胞凋亡的影響
與空白對照組比較,經過低、中、高濃度的COS處理后,細胞的核染色質出現了不同程度的濃染、固縮、邊集等凋亡現象,其凋亡率均較空白對照組顯著升高(P<0.05或P<0.01),且呈濃度依賴趨勢,詳見圖1、表2。
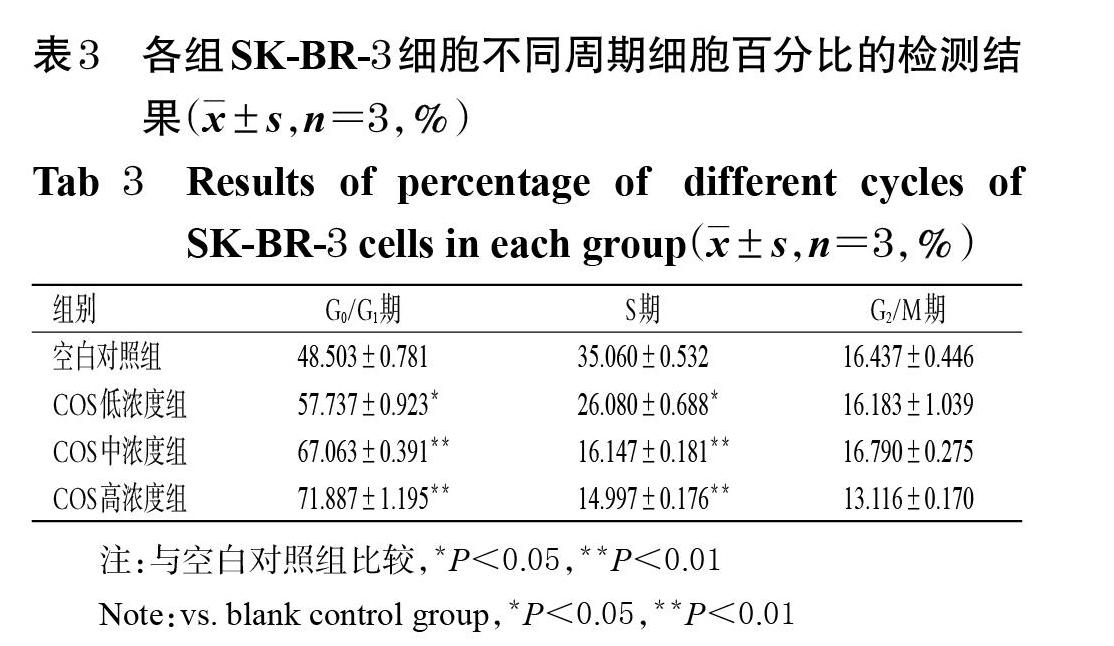
3.3 COS對SK-BR-3細胞周期分布的影響
與空白對照組比較,經過低、中、高濃度的COS處理后,G0/G1期細胞百分比均顯著升高(P<0.05或P<0.01),S期細胞百分比均顯著降低(P<0.05或P<0.01),均呈濃度依賴趨勢;而G2/M期的細胞百分比組間比較,差異均無統計學意義(P>0.05),詳見圖2、表3。
3.4 COS對SK-BR-3細胞凋亡及周期相關蛋白表達水平的影響
與空白對照組比較,經過低、中、高濃度的COS處理后,細胞中p53、caspase-3、Bax、p21蛋白的相對表達量均顯著升高(P<0.05或P<0.01),而Bcl-2、CDK2、cyclinE蛋白的相對表達量均顯著降低(P<0.01),均呈濃度依賴趨勢,詳見圖3、表4。
4 討論
癌癥的發生發展通常由細胞增殖與凋亡之間所處的動態平衡關系來決定,而抗癌藥物所顯現出的抗癌效果也往往是通過抑制腫瘤細胞增殖、誘導腫瘤細胞凋亡等途徑來實現的[12]。COS是一種具有多種生物學活性的倍半萜內酯化合物,已有研究表明其對皮膚癌、卵巢癌、食管癌等不同來源的人腫瘤細胞株具有廣譜的細胞毒性[13-15]。本研究以體外培養的人乳腺癌SK-BR-3細胞為對象,初步探討了COS對其增殖的抑制作用。MTT法檢測結果顯示,不同濃度的COS均能顯著減弱細胞活性,且這種作用呈時間、濃度依賴趨勢。Hoechst 33258熒光染色結果顯示,經不同濃度的COS干預后,SK-BR-3細胞的核染色質出現明顯的固縮、邊集等凋亡現象。以上結果提示,COS具有抑制SK-BR-3細胞增殖、誘導其凋亡的作用。
細胞周期阻滯和凋亡是誘導細胞死亡的兩種機制。有關細胞周期調控的研究顯示,正常細胞的周期進展受到G1、S、G2、M期檢查點的嚴格控制,而細胞周期進展檢查點的改變會導致異常的細胞增殖和腫瘤的發生發展,例如腫瘤細胞常因上述檢查點出現缺陷而導致其無限制增殖[16]。許多抗腫瘤藥物在特定的檢測點誘導細胞周期阻滯,從而誘導細胞凋亡[17]。Hua等[18]的研究顯示,COS可將人肺鱗癌SK-MES-1細胞周期阻滯于G1/S期,從而抑制該細胞的增殖。本研究結果顯示,COS低、中、高濃度組G0/G1期細胞百分比均顯著升高,S期細胞百分比均顯著降低,提示COS可阻滯SK-BR-3細胞于G1/S期,從而抑制細胞的增殖,且這種作用呈濃度依賴趨勢。由此推測,細胞周期G1/S期阻滯可能是COS抑制腫瘤細胞增殖的機制之一。
p53是一種腫瘤抑制蛋白,在調節細胞周期進程、激活檢查點和促進細胞凋亡中起關鍵作用;p21是Clp家族成員之一,位于p53因子下游,也是p53最重要的下游因子之一[19]。p21基因編碼的p21蛋白是目前已知的具有最廣泛激酶抑制活性的細胞周期抑制蛋白,能抑制cyclinE-CDK2復合體的活性;后者會使視網膜母細胞瘤蛋白不能發生磷酸化、轉錄因子E2F不能被釋放,從而使細胞周期停滯在G1期[19-20]。本研究結果顯示,低、中、高濃度的COS均可使p21蛋白(p53的下游靶標)表達上調,同時使CDK2和cyclinE蛋白表達下調;而cyclinE-CDK2復合體的正常表達在細胞G1/S期的轉折中起著重要作用,這些數據進一步解釋了COS導致人乳腺癌細胞G1/S期阻滯的潛在機制。
細胞凋亡是細胞程序性死亡引起組織損傷的一種生理反饋[21]。對于目前癌癥治療常用的絕大多數藥物而言,其發揮抗癌作用的機制主要是通過激活并啟動細胞凋亡途徑以達到殺死腫瘤細胞的目的[22-23]。研究表明,p53是一種腫瘤抑制蛋白,可通過調節凋亡介導蛋白的表達來改變線粒體膜的通透性,從而觸發細胞凋亡[24]。Bcl-2蛋白家族是一個調節線粒體途徑的凋亡調節蛋白大家族,其主要以Bax(促凋亡蛋白)和Bcl-2(抗凋亡蛋白)為代表。其中,Bcl-2蛋白是由控制線粒體的相關凋亡因子所釋放的主要調節因子,可通過調節膜電位而控制線粒體外膜通透性[25-26];Bax一般存在于細胞質中,當接收到凋亡信號時,Bax會重新定位于線粒體表面,在其表面構成跨線粒體膜的孔,導致膜電位降低、膜通透性增加,從而釋放凋亡因子、活化下游caspase,進而激活caspase-3、啟動caspase級聯反應,最終誘發細胞凋亡[27]。因此,為進一步探討COS誘導SK-BR-3細胞凋亡的分子機制,本研究檢測了COS對其凋亡途徑關鍵調控因子p53、Bax、Bcl-2、caspase-3表達的影響。結果顯示,低、中、高濃度的COS均可使p53、Bax、caspase-3蛋白的表達上調,同時使Bcl-2蛋白的表達下調。上述結果表明,p53及線粒體介導的caspase激活途徑在COS誘導的SK-BR-3細胞凋亡中起了關鍵作用。
綜上,COS可有效抑制人乳腺癌SK-BR-3細胞活性,加速細胞凋亡,并使細胞周期阻滯在G1/S期;其作用機制可能與調控p53/Bax/Bcl-2/caspase-3凋亡信號通路有關。
參考文獻
[ 1 ] TZIKAS A K,NEMES S,LINDERHOLM B K. A compa- rison between young and old patients with triple-negative breast cancer:biology,survival and metastatic patterns[J]. Breast Cancer Res Treat,2020,182(10):643-654.
[ 2 ] LEE J E,KWON Y J,BAEK H S,et al. Synergistic induc- tion of apoptosis by combination treatment with mesupron and auranofin in human breast cancer cells[J]. Arch Pharm Res,2017,40(6):746-759.
[ 3 ] GUPTA A K,RATHER M A,JHA A K,et al. Artocarpus lakoocha Roxb. and Artocarpus heterophyllus Lam.? ? ?flowers:new sources of bioactive compounds[J]. Plants (Basel),2020,9(10):1329-1345.
[ 4 ] KIM D Y,CHOI B Y. Costunolide:a bioactive sesquiterpene lactone with diverse therapeutic potential[J]. Int J Mol Sci,2019,20(12):2926-2946.
[ 5 ] LIN X,PENG Z,SU C. Potential anti-cancer activities and mechanisms of costunolide and dehydrocostuslactone[J]. Int J Mol Sci,2015,16(5):10888-10906.
[ 6 ] CAI H,LI L,JIANG J,et al. Costunolide enhances sensitivity of K562/ADR chronic myeloid leukemia cells to doxorubicin through PI3K/Akt pathway[J]. Phytother Res,2019,33(6):1683-1688.
[ 7 ] HU M,LIU L,YAO W. Activation of p53 by costunolide blocks glutaminolysis and inhibits proliferation in human colorectal cancer cells[J]. Gene,2018,678:261-269.
[ 8 ] CHEN J,CHEN B,ZOU Z,et al. Costunolide enhances doxorubicin-induced apoptosis in prostate cancer cells via activated mitogen-activated protein kinases and generation of reactive oxygen species[J]. Oncotarget,2017,8(64):107701-107715.
[ 9 ] ZHANG C,LU T,WANG G D,et al. Costunolide,an active sesquiterpene lactone,induced apoptosis via ROS-mediated ER stress and JNK pathway in human U2OS cells[J]. Biomed Pharmacother,2016,80:253-259.
[10] WANG Z,ZHAO X,GONG X G. Costunolide induces lung adenocarcinoma cell line A549 cells apoptosis through ROS(reactive oxygen species)-mediated endoplasmic reticulum stress[J]. Cell Biol Int,2016,40(3):289-297.
[11] 苗加偉,陳潔,鄧雪松,等.去氫木香內酯抑制人肝癌細胞系HepG2增殖及促凋亡[J].基礎醫學與臨床,2020,40(10):1369-1373.
[12] LI X. The inducers of immunogenic cell death for tumor immunotherapy[J]. Tumori,2017,104(1):1-8.
[13] LEE S H,CHO Y C,Lim J S. Costunolide,a sesquiterpene lactone,suppresses skin cancer via induction of apoptosis and blockage of cell proliferation[J]. Int J Mol Sci,2021,22(4):2075-2091.
[14] YANG Y I,KIM J H,CHOI J H,et al. Costunolide indu- ces apoptosis in platinum-resistant human ovarian cancer cells by generating reactive oxygen species[J]. Gynecol Oncol,2011,123(3):588-596.
[15] HUA P,SUN M,ZHANG G,et al. Costunolide induces apoptosis through generation of ROS and activation of p53 in human esophageal cancer ECA-109 cells[J]. J? ? Biochem Mol Toxic,2016,30(9):462-469.
[16] SUN J M,XU H T,ZHAO L,et al. Induction of cell-cycle arrest and apoptosis in human cholangiocarcinoma cells by pristimerin[J]. J Cell Biochem,2019,120(7):12002- 12009.
[17] XIA L,WEN H,HAN X,et al. Luteinizing hormone inhi- bits cisplatin-induced apoptosis in human epithelial ova- rian cancer cells[J]. Oncol Lett,2016,11(3):1943-1947.
[18] HUA P,ZHANG G,ZHANG Y,et al. Costunolide indu- ces G1/S phase arrest and activates mitochondrial-media- ted apoptotic pathways in SK-MES-1 human lung squamous carcinoma cells[J]. Oncol Lett,2016,11(4):2780- 2786.
[19] LI G,ZHANG R,ZHANG X,et al. Human colorectal cancer derived-MSCs promote tumor cells escape from sene- scence via p53/p21 pathway[J]. Clin Transt Oncol,2020,22(4):503-511.
[20] LIN C P ,LIN C S ,LIN H H ,et al. Bergapten induces G1 arrest and pro-apoptotic cascade in colorectal cancer cells associating with p53/p21/PTEN axis[J]. Environ Toxicol,2019,34(3):303-311.
[21] YU K,YANG X,LI Y,et al. Synthesis of cucurbitacin Ⅱa derivatives with apoptosis-inducing capabilities in human cancer cells[J]. RSC Advances,2020,10(7):3872-3881.
[22] HENGARTNER M O. The biochemistry of apoptosis[J].Nature,2000,407(6805):770-776.
[23] 邵鑫,蔣先虹,王瑞,等.紫草素對人結腸癌細胞HCT116自噬和凋亡的影響[J].中國藥房,2021,32(1):51-55.
[24] CORDANI M,BUTERA G,PACCHIANA R,et al. Molecular interplay between mutant p53 proteins and auto- phagy in cancer cells[J]. Biochim Biophys Acta Rev? ? Cancer,2017,1867(1):19-28.
[25] CAMPBELL K J,TAIT S W G. Targeting Bcl-2 regulated apoptosis in cancer[J]. Open Biol,2018,8(5):180002.
[26] 趙冀安,馬艷榮,聶文佳,等.溴苯基姜黃素對膽管癌細胞凋亡、遷移和侵襲的影響及機制研究[J].中國藥房,2021,32(4):467-474.
[27] MOTAMED H R,SHARIATI M,AHMADI R,et al. The apoptotic effects of progesterone on breast cancer (MCF-7) and human osteosarcoma (MG-636) cells[J]. Physiol Int,2020,107(3):406-418.
(收稿日期:2021-03-04 修回日期:2021-07-27)
(編輯:張元媛)

