對羥基苯甲酸丙酯對食蚊魚(Gambusia affinis)鰓和表皮K+流速的影響
閆小雨,曾鴻鵠,2,3,4,宋曉紅,2,3,*,梁延鵬,2,3,4,黎昕,劉志銳,黃思齊,鄧鴻彬
1. 桂林理工大學(xué)環(huán)境科學(xué)與工程學(xué)院,桂林 541000 2. 廣西環(huán)境污染控制理論與技術(shù)重點實驗室,桂林 541000 3. 巖溶地區(qū)水污染控制與用水安全保障協(xié)同創(chuàng)新中心,桂林 541000 4. 廣西環(huán)境污染控制理論與技術(shù)重點實驗室科教結(jié)合科技創(chuàng)新基地,桂林 541000
對羥基苯甲酸酯是對羥基苯甲酸與烷基形成的一種脂類化合物[1],作為防腐劑被廣泛使用于食品、化妝品和藥品中[2-3]。在眾多對羥基苯甲酸酯化合物中,對羥基苯甲酸丙酯(propylparaben, PrP)在環(huán)境中的檢出頻率和含量較高,地表水、污泥、沉積物和土壤中均有檢出[4-5]。PrP的大量使用導(dǎo)致其廣泛存在于魚類、無脊椎動物、海草、海洋大藻類、紅樹林等動植物體內(nèi)[6],在海洋食物網(wǎng)中有生物累積和放大作用[7]。此外,PrP在魚類的早期發(fā)育階段通過誘導(dǎo)氧化應(yīng)激、DNA雙鏈斷裂、細胞凋亡以及改變脂肪酸代謝等途徑引起機體毒性[8],并具有與雙酚類物質(zhì)相似的雌激素效應(yīng)[9]。
魚類的鰓和皮膚是重要防御組織,當(dāng)魚體暴露于受污染的水體時,某些污染物例如內(nèi)分泌干擾物會通過魚鰓和表皮組織進入魚體[10-11],從而破壞魚鰓細胞和魚體腎臟細胞等細胞的離子平衡[12]。Baldissera等[13]研究發(fā)現(xiàn),銀鯰魚(Clariasbatrachus)在受到豚鼠氣單胞菌(Aeromonascaviae)毒害作用時,魚體腎臟細胞內(nèi)K+穩(wěn)態(tài)會被破壞最終導(dǎo)致魚體腎臟功能受損;Hung等[14]通過測量斑馬魚(Daniorerio)細胞內(nèi)Ca2+流速變化,證實了污染物順鉑對斑馬魚細胞離子穩(wěn)態(tài)的損害。K+是動植物的必需元素,其穩(wěn)態(tài)對維持細胞各項功能正常運轉(zhuǎn)具有重要作用[15],人體血細胞內(nèi)K+含量過高或過低都會引起器官衰竭等病癥[16]。細胞內(nèi)高K+低Na+的環(huán)境是保持細胞離子平衡和新陳代謝的重要基礎(chǔ),K+穩(wěn)態(tài)變化可有效指示污染物的毒害作用,目前關(guān)于PrP對魚體內(nèi)K+平衡影響的研究還未見報道。

食蚊魚(Gambusiaaffinis)分布于我國華南地區(qū)的淡水水體中,體型小、容易捕撈且易于在實驗室飼養(yǎng),因此被廣泛應(yīng)用于環(huán)境毒理學(xué)研究。本文以食蚊魚作為模式生物,通過急性毒性實驗研究了不同濃度PrP暴露下食蚊魚的半致死濃度(LC50),采用非損傷微測技術(shù)檢測魚體表皮和魚鰓的K+流速,分別研究了不同濃度PrP瞬時暴露和96 h暴露后魚體表皮和魚鰓的K+流速變化,探討PrP暴露對魚體表皮和魚鰓細胞K+通道的影響機制,為PrP的毒性評估和環(huán)境監(jiān)測提供科學(xué)依據(jù)。
1 材料與方法(Materials and methods)
1.1 實驗動物
食蚊魚購自廣西荔浦青山水產(chǎn)養(yǎng)殖場,在水生生物養(yǎng)殖系統(tǒng)中適應(yīng)7 d。實驗用水連續(xù)曝氣24 h以上,水溫為24.5℃±0.5℃,pH為7.5±0.1,溶解氧為(5.9±0.5) mg·L-1,保持14 h∶10 h的光暗條件,每天定時投喂2次豐年蟲蟲卵。挑選健康活潑、大小均一的個體作為實驗用魚,平均體質(zhì)量為(0.18±0.04) g,平均體長為(2.7±0.2) cm。
1.2 實驗方法
1.2.1 食蚊魚急性毒性實驗
采用半靜態(tài)法研究PrP對食蚊魚的急性毒性效應(yīng),通過預(yù)實驗獲得96 h無死亡最高濃度(5 mg·L-1)和24 h全部死亡最低濃度(11 mg·L-1),作為正式實驗的濃度區(qū)間。采用等對數(shù)間距法設(shè)置8個濃度組,PrP的濃度分別為5.0、5.6、6.3、7.1、7.9、8.9、10和11 mg·L-1,并設(shè)空白對照組和二甲基亞砜(DMSO)對照組。按實驗所需配制母液,實驗前每次取1 mL母液加入1 L水中,DMSO終濃度為1‰。分別將8條實驗用魚置于配有不同濃度PrP溶液的燒杯中,每個燒杯3 L PrP溶液,每個濃度組設(shè)3個平行。每24 h更換1/2 PrP溶液,測定溶解氧和pH,記錄24、48、72和96 h每個燒杯中食蚊魚的死亡情況。當(dāng)魚失去平衡、腹部向上,用玻璃棒觸碰無反應(yīng),魚鰓無閉合則判定魚體死亡。實驗所用試劑均為分析純,購自Sigma-Aldrich化學(xué)制品有限公司(St.Louis, MO, USA)。
1.2.2 K+流速的測定方法
采用非損傷微測系統(tǒng)(NMT100/200 Series,北京旭月公司,中國)以非損傷性掃描離子選擇微電極測定魚體表皮和魚鰓中K+的含量。基于Nernst方程和Fick’s第一擴散定律計算K+流速,能夠獲得非常細微的信號,流速能夠達到10~12 pmol·(cm2·s)-1,離子流計算結(jié)果為正值時表示K+流出細胞(外排),計算結(jié)果為負值時表示K+流入細胞(內(nèi)流)。
離子選擇微電極使用之前需要校正,校準(zhǔn)結(jié)果如下:校準(zhǔn)液1(1 mmol·L-1K+)電壓為-22.47 mV,校準(zhǔn)液2(0.25 mmol·L-1K+)電壓為-56.26 mV,測試液(0.5 mmol·L-1K+)電壓為-39.89 mV,在測試過程中測試液電壓波動在±10 mV之內(nèi),則滿足校準(zhǔn)要求。在靠近目標(biāo)物的2個位置之間移動微電極,由電腦驅(qū)動的液壓機械手來控制其移動距離和頻率,將目標(biāo)物放置于裝有測試液的7.5 cm一次性無菌培養(yǎng)皿中,在室溫下(26~28 ℃)檢測離子流速。
1.2.3 PrP瞬時暴露食蚊魚K+的流速測定
將實驗室適應(yīng)后的食蚊魚在體式顯微鏡下迅速解剖取出魚體的單邊魚鰓組織,將魚鰓放入裝有測試液的培養(yǎng)皿中,平衡10 min,魚鰓測試液成分為CaCl2(0.1 mmol·L-1)、MgCl2·6H2O(0.98 mmol·L-1)、MgSO4(0.81 mmol·L-1)、KCl(0.5 mmol·L-1)、NaCl(149.4 mmol·L-1)、D-半乳糖(5 mmol·L-1)、丙酮酸鈉(5 mmol·L-1),平衡完成后將培養(yǎng)皿放置于顯微鏡下,利用機械手使傳感器距離魚鰓鰓絲1 μm,選擇測試模式X-30檢測魚鰓的K+流速。每個魚鰓樣品檢測時間為30 min,在檢測第10分鐘時加入PrP暴露液。PrP暴露液濃度由急性毒性實驗得到的96 h-LC50確定,濃度選擇如下:低濃度LC50/10 (0.9 mg·L-1),中濃度LC50/5 (1.8 mg·L-1),高濃度LC50/2 (4.6 mg·L-1)。每個濃度組測定5條魚。
魚體表皮的測試過程與魚鰓一致,魚體表皮的測試液成分為NaCl(151 mmol·L-1)、CaCl2(0.25 mmol·L-1)、MgSO4(0.2 mmol·L-1)、KCl(0.5 mmol·L-1),在上機測試前先用0.4 mg·L-1間氨基苯甲酸乙酯甲磺酸鹽(MS-222)將魚體麻醉20 min,確保魚體在測試過程中處于麻醉狀態(tài)以不影響測試結(jié)果,魚鰓和魚體表皮的檢測過程如圖1所示,魚體表皮測試部位為魚體背鰭往后5 mm。

圖1 魚鰓和魚體表皮K+流速的測試過程 (左:魚鰓,右:魚體表皮;玻璃針為傳感器尖端)Fig. 1 The process of K+ flow velocity test in the fish gills and epidermis (left: fish gills, right: fish epidermis; the glass needle is the sensor tip)
1.2.4 PrP 96 h暴露食蚊魚K+的流速測定
分別將5條食蚊魚暴露于96 h-LC50/10 (0.9 mg·L-1)、96 h-LC50/5 (1.8 mg·L-1)和96 h-LC50/2 (4.6 mg·L-1)3種不同濃度PrP溶液中96 h,并設(shè)空白對照組。用NMT系統(tǒng)檢測K+流速的過程同1.2.3,每個樣品檢測20 min,每測完1條魚魚體表皮后,立即解剖魚鰓,再檢測魚鰓細胞的K+流速。
1.2.5 數(shù)據(jù)處理
實驗結(jié)果采用平均值±標(biāo)準(zhǔn)誤差(Mean±S.E)表示,采用單因素方差分析,以Tukey檢驗法進行兩兩比較,以P>0.05、P<0.01表示差異不顯著。安全濃度按Turubell氏公式求出,計算公式為SC=0.3×48 h-LC50/(24 h-LC50/48 h-LC50)[20]。
2 結(jié)果(Results)
2.1 PrP對食蚊魚的急性毒性效應(yīng)
PrP對食蚊魚的急性毒性實驗結(jié)果如圖2所示,空白組的食蚊魚與實驗開始時相比無明顯變化,低濃度組的食蚊魚的活潑性和存活率與對照組基本相似,隨著濃度的增高,食蚊魚出現(xiàn)中毒現(xiàn)象,表現(xiàn)為反應(yīng)遲緩、游速減慢、身體逐漸失去平衡、腹部朝上。食蚊魚的死亡率隨著暴露濃度的升高而升高,隨著暴露時間的延長而升高,濃度升高至11 mg·L-1時,燒杯內(nèi)食蚊魚全部死亡。PrP暴露后,食蚊魚的24 h-LC50、48 h-LC50、72 h-LC50和96 h-LC50分別為9.70、9.63、9.45和為9.14 mg·L-1,安全濃度為2.85 mg·L-1。本實驗中,24 h-LC50>48 h-LC50>72h-LC50>96 h-LC50,說明隨著實驗時間的延長,PrP對食蚊魚的毒性效應(yīng)提高且呈一定的時間-劑量效應(yīng),PrP的濃度與食蚊魚反應(yīng)之間的關(guān)系屬于“S”型曲線關(guān)系。
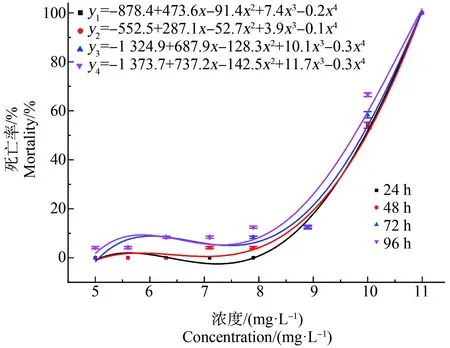
圖2 對羥基苯甲酸丙脂(PrP)暴露對食蚊魚死亡率的影響Fig. 2 Effects of propylparaben (PrP) exposure on the mortality of mosquito fish
2.2 PrP瞬時暴露后食蚊魚K+的流速變化
在圖3和表1中,魚鰓中的K+主要處于外排狀態(tài),其中0.9 mg·L-1PrP暴露前后K+流速差別不顯著(P>0.05),90%的K+流速處于-25~100 pmol·(cm2·s)-1之間(圖3(a));1.8 mg·L-1PrP暴露前后K+流速差別顯著(P<0.01),暴露前魚鰓中的K+流速主要處于0~200 pmol·(cm2·s)-1之間,暴露后90%的K+流速處于0~700 pmol·(cm2·s)-1之間,PrP暴露后K+外排量增大,波動幅度增大(圖3(b));4.6 mg·L-1PrP暴露前后K+流速差別顯著(P<0.01),暴露前魚鰓中的K+通量主要處于-25~200 pmol·(cm2·s)-1之間,暴露后90%的K+通量處于250~1 000 pmol·(cm2·s)-1之間(圖3(c))。圖3(d)中暴露前各濃度組間無顯著差別(P>0.05),暴露后低濃度組與空白對照組無顯著差別(P>0.05),高、中、低3個濃度組間差別顯著(P<0.01),隨著PrP暴露濃度的增加,魚鰓中的K+流速波動幅度增大,K+外排量增加,呈現(xiàn)劑量效應(yīng);加藥后10 min,4.6 mg·L-1暴露組K+外排量分別是0.9 mg·L-1和1.8 mg·L-1暴露組K+外排量的14.03倍和2.10倍,1.8 mg·L-1暴露組K+外排量是0.9 mg·L-1暴露組K+外排量的6.64倍;加藥后20 min,4.6 mg·L-1暴露組K+外排量分別是0.9 mg·L-1和1.8 mg·L-1暴露組K+外排量的18.61倍和2.52倍,1.8 mg·L-1暴露組K+外排量是0.9 mg·L-1暴露組K+外排量的7.37倍。加藥后第14分鐘時,4.6 mg·L-1暴露組K+外排量分別是0.9 mg·L-1和1.8 mg·L-1暴露組K+外排量的21.3倍和2.7倍,1.8 mg·L-1暴露組K+外排量是0.9 mg·L-1暴露組K+外排量的8.2倍,14 min后各濃度組間K+流速差距不再增長趨于穩(wěn)定。

表1 不同PrP暴露方式對食蚊魚K+流速的影響Table 1 Influence of different PrP treatment methods on the K+ flow velocity of mosquito fish
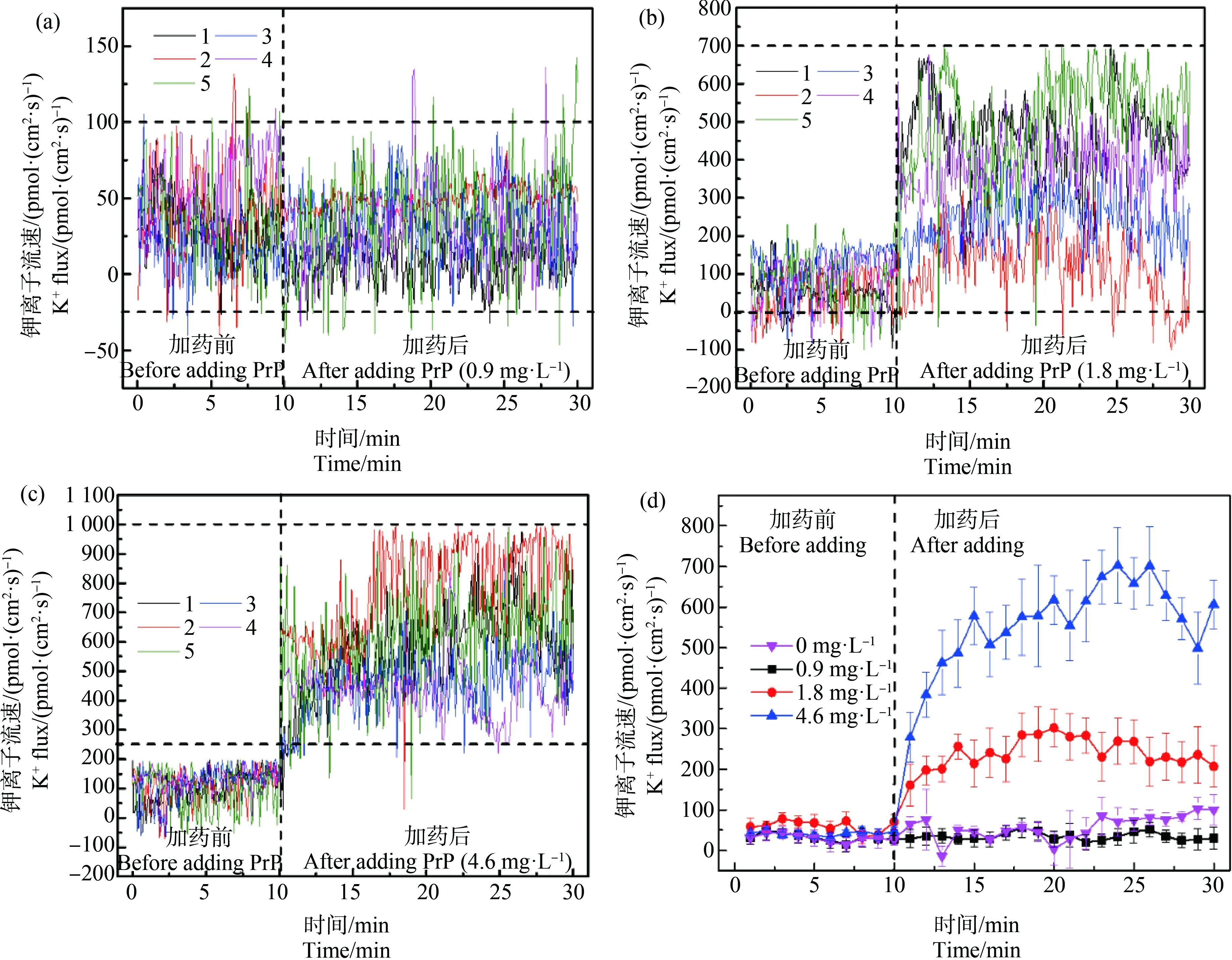
圖3 PrP瞬時暴露后食蚊魚魚鰓K+的流速變化注:(a)、(b)和(c)分別表示不同濃度PrP (0.9、1.8和4.6 mg·L-1)瞬時暴露下魚鰓K+流速的波動情況,圖中不同顏色的折線分別表示5條 魚魚鰓的K+流速情況,(d)中每條折線表示不同PrP暴露組中5條魚魚鰓的K+流速的平均值±標(biāo)準(zhǔn)誤差 (Mean ±S.E);下同。Fig. 3 Changes of K+ flow velocity in the gills of mosquito fish after PrP instantaneous exposureNote: (a), (b) and (c) respectively represent the fluctuation of the gill K+ velocity under the instantaneous exposure of different concentrations of PrP (0.9, 1.8, 4.6 mg·L-1); the polylines with different colors in the figure represent the gills K+ flow velocity of 5 fishes, and each polyline in (d) represents the average values (Mean±SEM) of the K+ flow velocity in 5 fish gills after exposed to different PrP groups; the same as follow.
在圖4和表1中,魚體表皮的K+主要處于內(nèi)流狀態(tài),其中0.9 mg·L-1PrP暴露前后魚體表皮K+流動情況差別不顯著(P>0.05),90%的K+流速處于區(qū)間-400~200 pmol·(cm2·s)-1(圖4(a));1.8 mg·L-1PrP暴露前后差別顯著(P<0.01),暴露前魚體表皮K+流速區(qū)間為-300~100 pmol·(cm2·s)-1,暴露后流速區(qū)間為-600~200 pmol·(cm2·s)-1,暴露后K+內(nèi)流量和外排量均增加,波動較大(圖4(b));4.6 mg·L-1PrP暴露前后差別顯著(P<0.01),暴露前魚體表皮K+流速區(qū)間為-400~100 pmol·(cm2·s)-1,暴露后流速區(qū)間為-600~200 pmol·(cm2·s)-1,K+內(nèi)流量增大幅度大于增加的K+外排量,波動區(qū)間范圍增廣(圖4(c))。圖4(d)中低濃度組與空白對照組無顯著差別(P>0.05),1.8 mg·L-1和4.6 mg·L-1處理組K+流速差異不顯著(P>0.05),但均與0.9 mg·L-1處理組差異顯著(P<0.01),加藥后10 min,4.6 mg·L-1暴露組K+內(nèi)流量是0.9 mg·L-1暴露組K+內(nèi)流量的5.45倍,1.8 mg·L-1暴露組K+內(nèi)流量是0.9 mg·L-1暴露組K+內(nèi)流量的4.59倍;加藥后20 min,4.6 mg·L-1暴露組K+內(nèi)流量是0.9 mg·L-1暴露組K+內(nèi)流量的4.35倍,1.8 mg·L-1暴露組K+內(nèi)流量是0.9 mg·L-1暴露組K+內(nèi)流量的3.73倍。

圖4 PrP瞬時暴露后食蚊魚魚體表皮K+的流速變化Fig. 4 Changes of K+ flow velocity in fish epidermis of mosquito fish after PrP instantaneous exposure
2.3 PrP 96 h暴露后食蚊魚K+的流速變化
在圖5和表1中,PrP 96 h暴露后食蚊魚魚鰓的K+主要處于外排狀態(tài),空白組K+流速主要處于-25~100 pmol·(cm2·s)-1之間(圖5(a));0.9 mg·L-1PrP暴露條件下90%的K+流速處于區(qū)間-25~400 pmol·(cm2·s)-1(圖5(b));1.8 mg·L-1PrP暴露條件下,90%的K+流速處于區(qū)間0~500 pmol·(cm2·s)-1(圖5(c));4.6 mg·L-1PrP暴露條件下,90%的K+流速處于區(qū)間-100~500 pmol·(cm2·s)-1(圖5(d))。在圖5(e)中各濃度組間K+流速差別顯著(P<0.01),K+外排量隨著暴露濃度的增大而增大,測定前10 min時4.6 mg·L-1暴露組K+外排量分別是空白對照組和1.8 mg·L-1暴露組K+外排量的9.70倍和1.21倍,1.8 mg·L-1暴露組K+外排量分別是空白對照組和0.9 mg·L-1暴露組K+外排量的8.03倍和1.93倍,0.9 mg·L-1暴露組K+外排量是空白對照組K+外排量的4.17倍;測定10 min至20 min時4.6 mg·L-1暴露組K+外排量分別是空白對照組和1.8 mg·L-1暴露組K+外排量的10.81倍和1.37倍,1.8 mg·L-1暴露組K+外排量分別是空白對照組和0.9 mg·L-1暴露組K+外排量的7.87倍和3.31倍,0.9 mg·L-1暴露組K+外排量是空白對照組K+外排量的2.38倍。
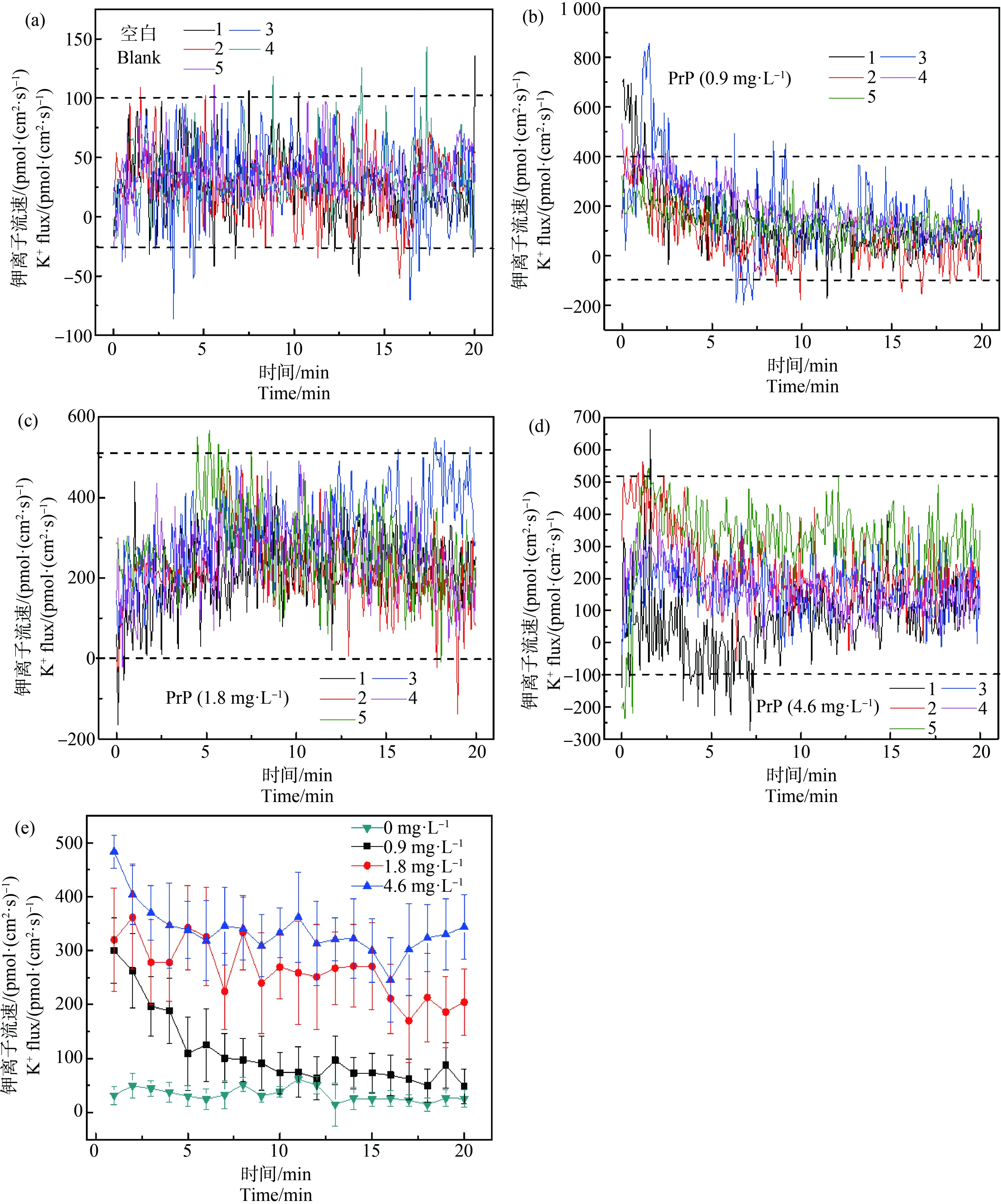
圖5 PrP暴露96 h后魚鰓K+的流速變化注:(a)、(b)、(c)和(d)分別表示空白對照組和不同濃度PrP (0.9、1.8和4.6 mg·L-1)暴露96 h后魚鰓K+流速的波動情況,圖中不同顏色的折線分別 表示5條魚魚鰓的K+流速情況,(e)中每條折線表示空白對照組和不同PrP暴露組中5條魚魚鰓的K+流速的平均值±標(biāo)準(zhǔn)誤差(Mean±S.E);下同。Fig. 5 Changes of K+ flow velocity in the gills of mosquito fish after PrP 96 h exposureNote: (a), (b), (c) and (d) respectively represent the fluctuation of the gill K+ flow velocity under the 96 h exposure of different PrP concentrations (0, 0.9, 1.8, 4.6 mg·L-1); the polylines with different colors in the figure represent the gills K+ flow velocity of 5 fishes, and each polyline in (e) represents the average values (Mean±SEM) of the K+ flow velocity in 5 fish gills after exposed to different PrP groups; the same as follow.
在圖6和表1中,PrP 96 h暴露后食蚊魚魚體表皮的K+主要處于內(nèi)流狀態(tài)。空白組K+流速主要處于-200~150 pmol·(cm2·s)-1之間(圖6(a));0.9 mg·L-1PrP暴露組中,90%的K+流速處于區(qū)間-450~100 pmol·(cm2·s)-1(圖6(b));1.8 mg·L-1PrP暴露組中,90%的K+流速處于區(qū)間-500~150 pmol·(cm2·s)-1(圖6(c));4.6 mg·L-1PrP暴露組中,90%的K+流速處于區(qū)間-650~250 pmol·(cm2·s)-1(圖6(d))。圖6(e)中空白對照組和0.9 mg·L-1PrP暴露組K+流速無顯著差異(P>0.05),其余各組間K+流速差異顯著(P<0.01),K+流速跟暴露濃度出現(xiàn)正相關(guān)性,測定前10 min時4.6 mg·L-1暴露組分別是空白對照組和1.8 mg·L-1暴露組K+外排量的6.50倍和1.27倍,1.8 mg·L-1暴露組K+外排量分別是空白對照組和0.9 mg·L-1暴露組K+外排量的5.11倍和5.03倍;測定10 min至20 min時4.6 mg·L-1暴露組分別是空白對照組和1.8 mg·L-1暴露組K+外排量的7.94倍和1.13倍,1.8 mg·L-1暴露組K+外排量分別是空白對照組和0.9 mg·L-1暴露組K+外排量的7.03倍和7.38倍。
3 討論(Discussion)
3.1 PrP對食蚊魚的急性毒性效應(yīng)
PrP的96 h-LC50為9.14 mg·L-1,表現(xiàn)為中等毒性。這與Dobbins等[21]的研究結(jié)果類似,大型溞(Daphniamagna) PrP的96 h-LC50范圍在4.0~24.6 mg·L-1,黑頭軟口鰷(Pimephalespromelas) PrP的96 h-LC50為3.3~160.0 mg·L-1。Terasaki等[22]的研究表明,PrP對大多數(shù)水生生物都具有急性毒性效應(yīng)。PrP具有親脂性,Ding等[23]推測這種毒性效應(yīng)與水辛醇分配系數(shù)有關(guān),該衍生物越疏水毒性效應(yīng)越強,由此可見,PrP對水生生物的毒性與其親脂性有關(guān),相對于其他對羥基苯甲酸酯類物質(zhì),PrP對水生生物類具有較強的毒性。
3.2 不同濃度PrP暴露對魚鰓K+流速的影響
鈉鉀泵是Na+和K+之間進行交換的一種蛋白質(zhì)載體,通過磷酸化和去磷酸化的過程發(fā)生構(gòu)象的變化,導(dǎo)致與Na+、K+的親和力不同,使細胞外的Na+濃度高于細胞內(nèi),細胞內(nèi)K+濃度高于細胞外,每消耗一個ATP分子,逆電化學(xué)梯度泵出3個Na+和泵入2個K+。通常情況下K+的流入量和流出量是平衡的,K+的流入量增多會出現(xiàn)低鉀血癥,鉀的流出量增多會出現(xiàn)高鉀血癥[24]。鈉鉀泵保持膜內(nèi)高鉀,膜外高鈉的不均勻離子分布,以維持細胞內(nèi)正外負的靜息電位以保證細胞正常的生理活動,細胞內(nèi)外K+濃度變化會導(dǎo)致這種離子平衡機制被破壞從而影響細胞的正常生理活動[25]。
Knudsen和Jensen[26]研究發(fā)現(xiàn),鯉魚(Cyprinuscarpio)在受到亞硝酸鹽的脅迫時K+會從紅細胞和骨骼肌組織中快速外排,導(dǎo)致細胞體積縮小,在該種環(huán)境下長期暴露最終會引發(fā)細胞衰亡。H?rdig等[27]發(fā)現(xiàn),造紙廠廢水暴露會影響魚類血液系統(tǒng),破壞血紅細胞內(nèi)多種離子平衡,K+會從細胞中高速流失到細胞外造成細胞外高鉀血癥。本研究中,魚鰓中的K+在PrP瞬時暴露和96 h暴露后都處于外排狀態(tài),實驗結(jié)果與這些報道一致。Mardones等[19]發(fā)現(xiàn),魚鰓細胞暴露于有害鞭毛藻毒素后,藻毒素與載體蛋白相結(jié)合通過細胞膜的卵磷脂層產(chǎn)生脂質(zhì)過氧化反應(yīng),使K+高速流出。PrP的辛醇水分配系數(shù)為3.04,具有親脂性[28],可與細胞膜內(nèi)載體蛋白相結(jié)合,通過卵磷脂層進入細胞內(nèi)并最終破壞細胞膜內(nèi)鈉鉀泵的功能。本研究中魚鰓對PrP暴露反應(yīng)敏感,可能是由于PrP進入細胞內(nèi)產(chǎn)生脂質(zhì)過氧化反應(yīng)并破壞鈉鉀泵轉(zhuǎn)運的功能,將細胞膜溶解使K+快速排出,具體機制還需進一步探究
PrP瞬時暴露實驗中,魚鰓高、中、低濃度組間K+流速差異顯著,具有劑量效應(yīng),K+外排量隨著PrP濃度的升高和暴露時間的延長增大;96 h PrP暴露后各實驗組魚鰓K+流速差異顯著,呈現(xiàn)劑量效應(yīng)。Flores-Lopes和Thomaz[29]的研究表明,魚鰓有很大的外部接觸面,對水環(huán)境的化學(xué)和物理變化特別敏感,流域水質(zhì)惡化,水中的污染物會引起魚鰓病變,所以魚鰓可做為環(huán)境監(jiān)測的工具。本研究中無論PrP瞬時暴露還是96 h暴露,魚鰓的K+流速變化都呈現(xiàn)出顯著的劑量效應(yīng),說明鰓細胞對環(huán)境中PrP的變化較為敏銳,可有效的指示水環(huán)境中的對羥基苯甲酸酯類污染物。
魚鰓瞬時暴露和96 h暴露后K+流速差異顯著,暴露方式不同對魚鰓K+流速有一定影響。低濃度組中,魚鰓K+流速瞬時暴露后與暴露前無顯著差異,96 h暴露時低濃度組與空白組有顯著差異,說明魚鰓短時間接觸低濃度PrP可能不會引起機體鈉鉀泵損傷,長期接觸低濃度PrP會造成魚鰓鈉鉀泵功能一定程度的受損。Mardones等[19]研究藻毒素對魚鰓細胞系(RTgill-W1)的細胞膜離子轉(zhuǎn)運過程的影響時發(fā)現(xiàn),在加入藻毒素的后10 min內(nèi)魚鰓細胞有明顯的刺激反應(yīng),但隨著檢測的進行,H+和K+流速變化會趨于一個穩(wěn)定值;Lin等[17]也發(fā)現(xiàn)在加入G蛋白偶聯(lián)受體5 min內(nèi),斑馬魚細胞Ca2+流速有明顯的刺激反應(yīng),隨著檢測的進行Ca2+的流速變化亦趨于穩(wěn)定。本研究中,PrP 96 h暴露實驗中各濃度組K+流速在測定過程中相對穩(wěn)定,瞬時暴露實驗中各濃度組K+流速在測定過程中先急速升高后趨于穩(wěn)定,魚鰓在加入PrP后5 min內(nèi)具有一定的應(yīng)激性反應(yīng),隨著測試時間的延長,應(yīng)激性逐漸減弱;并且,魚鰓在適應(yīng)環(huán)境的過程中產(chǎn)生一定的防御機制,緩解了PrP暴露所引起的損傷。
3.3 不同濃度PrP暴露對魚體K+流速的影響
魚體表皮細胞暴露于PrP后,K+內(nèi)流明顯且波動范圍大,這與Horng等[30]的研究結(jié)果一致,魚體皮膚內(nèi)層細胞在受到鹽脅迫時會向外排出K+,但魚體表皮細胞會吸收K+,可能是由于魚體表面的角質(zhì)形成細胞會主動攝取K+,平衡魚鰓和皮膚內(nèi)層細胞對K+的外排。本實驗中,K+內(nèi)流可能是因為魚體表皮通過角質(zhì)形成細胞的途徑攝取K+,魚體皮膚內(nèi)層細胞排出的K+需要角質(zhì)形成細胞從外界大量攝入K+來平衡,說明PrP對魚體表皮細胞造成了一定的影響,導(dǎo)致鈉鉀泵功能紊亂。
PrP瞬時暴露實驗中,1.8 mg·L-1和4.6 mg·L-1處理組魚體表皮K+流速差異不顯著,與0.9 mg·L-1處理組差異顯著,說明PrP濃度變化對魚體表皮K+流速有影響,鈉鉀泵轉(zhuǎn)運功能具有ATP依賴性和飽和性,所以PrP濃度達到一定閾值后,鈉鉀泵對K+的轉(zhuǎn)運達到最大值,PrP的濃度繼續(xù)增大對K+內(nèi)流速度變化影響不大。96 h PrP暴露后魚體表皮K+流速除空白對照組和0.9 mg·L-1PrP暴露組K+流速無顯著差異外,其余各組間K+流速差異顯著,說明低濃度PrP沒有引起魚體表皮細胞損傷。
比較魚體表皮瞬時暴露和96 h暴露的結(jié)果發(fā)現(xiàn),低濃度組差異不顯著,中濃度組和高濃度組差異顯著,此外,低濃度組瞬時暴露前后差異不顯著,96 h暴露前后差異亦不顯著,說明低濃度組PrP短時間暴露和長期暴露都不會引起魚體表皮K+流速的異常,可能是由于魚體表皮具有較好的防御機制,低濃度PrP暴露對魚體表皮細胞的鈉鉀泵功能無明顯干擾。中高濃度組在瞬時暴露時魚體表皮K+流速與對照組無顯著差別,在96 h暴露后卻與對照組差別顯著,說明暴露方式不同,PrP對魚體的損傷程度也不同。
在本實驗中,PrP暴露后魚鰓細胞和魚體表皮細胞的鈉鉀泵功能都受到了一定程度的損傷,不能維持細胞內(nèi)K+的正常轉(zhuǎn)運過程,魚鰓細胞均向外排出K+,魚體表皮細胞向內(nèi)吸收K+,呈現(xiàn)一定的劑量效應(yīng),PrP對K+流速的影響與暴露時間、暴露方式有關(guān)。相比較而言,魚體表皮細胞抵抗PrP損傷的能力更強,魚鰓細胞對PrP引起的損傷更敏感,具有一定的指示作用。

