蔗糖為原料同步糖化發(fā)酵生產(chǎn)乳酸單體
張樺宇,田康明,趙繼華,牛丹丹,MCHUNU Nokuthula Peace,王正祥,*
(1天津科技大學(xué)生物工程學(xué)院,天津300457;2天津科技大學(xué)化工與材料學(xué)院,天津300457;3Biotechnology Platform, Agricultural Research Council, Pretoria South Africa 0001)
0 引言
甘蔗是世界上生物量最大的栽培作物,是蔗糖生產(chǎn)的主要來源,也是我國重要的經(jīng)濟農(nóng)作物[1]。蔗糖作為甘蔗的主要產(chǎn)物,一直以來都是我國重要的生活物資和戰(zhàn)略儲備物資。隨著社會進步與我國淀粉糖產(chǎn)業(yè)的迅猛發(fā)展,近年來蔗糖消費結(jié)構(gòu)與蔗糖作為工業(yè)原料的應(yīng)用領(lǐng)域出現(xiàn)了重大改變。需要拓寬以蔗糖為大宗工業(yè)原料規(guī)模化生產(chǎn)其他大宗工業(yè)品的生產(chǎn)技術(shù)。現(xiàn)有以蔗糖或糖蜜生產(chǎn)活性干酵母和燃料乙醇,可以將蔗糖就地實現(xiàn)大規(guī)模生物轉(zhuǎn)化,但是經(jīng)濟效益有待進一步提高[2-3]。因此,尋求更大規(guī)模的、商業(yè)價值更顯著的其他大宗工業(yè)品或平臺化合物,可以更好地提升甘蔗種植業(yè)與甘蔗產(chǎn)業(yè)的經(jīng)濟效益與社會效益。
近年來,隨著“白色污染”治理需求,生物可降解聚乳酸材料發(fā)展迎來巨量市場需求。聚乳酸生產(chǎn)所需乳酸單體的大規(guī)模工業(yè)化生產(chǎn),已成為聚乳酸產(chǎn)業(yè)鏈中最為關(guān)鍵的一環(huán)[4-6]。前期的研究結(jié)果顯示,以淀粉或生物柴油副產(chǎn)物甘油為原料,通過代謝工程菌生物代謝已實現(xiàn)乳酸單體(D-型乳酸或L-型乳酸)的規(guī)模化生產(chǎn)[7-9]。
進一步尋找乳酸單體生產(chǎn)的大宗發(fā)酵原料(如蔗糖),同樣是實現(xiàn)乳酸單體生產(chǎn)與聚乳酸產(chǎn)業(yè)鏈健康平穩(wěn)發(fā)展的重要內(nèi)容。已有研究結(jié)果表明,郭洋等[10]篩選分離出1株米根霉GY18,能夠利用高濃度的蔗糖(120 g/L)發(fā)酵產(chǎn)L-乳酸114.7 g/L,產(chǎn)酸強度為2.39 g/(L·h),轉(zhuǎn)化率為95.5%。趙錦芳等[7]利用大腸桿菌HBUT-L,以蔗糖和甘蔗糖蜜發(fā)酵產(chǎn)L-乳酸,乳酸濃度為60.0和87.0 g/L,產(chǎn)酸強度分別為0.625和0.389 g/(L·h),光學(xué)純度均達99%,糖酸轉(zhuǎn)化率分別為74.0%和83.5%。Zhou等[11]以大腸桿菌SZ132利用蔗糖發(fā)酵產(chǎn)D-乳酸,乳酸濃度為90 g/L,產(chǎn)酸強度為0.75 g/(L·h),光學(xué)純度高達99.5%,糖酸轉(zhuǎn)化率為90.0%。Lebaka等[12]利用蔗糖發(fā)酵L-乳酸濃度144.2 g/L,產(chǎn)酸強度為3.0 g/(L·h),糖酸轉(zhuǎn)化率為96.13%。Calabia等[13]利用甘蔗糖蜜和甘蔗汁,產(chǎn)D-乳酸濃度為107和120 g/L,糖酸轉(zhuǎn)化率分別為89.9%和90.2%。由于絕大多數(shù)大腸桿菌代謝蔗糖的能力缺失或代謝能力較低,以大腸桿菌重組菌從蔗糖合成乳酸單體的發(fā)酵強度與產(chǎn)酸水平有待進一步提升。
本課題組在前期的研究中,已創(chuàng)建了系列乳酸單體高效生產(chǎn)菌種,實現(xiàn)了以葡萄糖或甘油為原料的L-乳酸規(guī)模化發(fā)酵生產(chǎn)[8-9]。為了實現(xiàn)以蔗糖為原料生產(chǎn)L-乳酸的目標,本文在產(chǎn)L-乳酸重組菌JC31L的基礎(chǔ)上[14-15],試圖建立以蔗糖為原料發(fā)酵生產(chǎn)L-乳酸的高效新工藝,以實現(xiàn)蔗糖為原料的乳酸單體的高效生產(chǎn),也為大宗原料蔗糖轉(zhuǎn)化為大宗需求量乳酸單體的工業(yè)化生產(chǎn)提供重要參考。
1 材料與方法
1.1 菌株
菌株JC31L,為產(chǎn)L-乳酸重組大腸桿菌,為本實驗室前期構(gòu)建和保藏[14-15]。
1.2 儀器和設(shè)備
本研究中所使用的主要儀器和設(shè)備具體如表1所示。

表1 主要儀器和設(shè)備
1.3 培養(yǎng)基
LB培養(yǎng)基[16],固體培養(yǎng)基為在LB液體培養(yǎng)基的基礎(chǔ)上添加2%瓊脂。
M9培養(yǎng)基[16]:十二水磷酸氫二鈉15.11 g/L,磷酸二氫鉀3 g/L,氯化銨1 g/L,氯化鈉0.5 g/L,pH為7.0。接種前加入0.1%硫酸鎂溶液(1 mol/L)、0.1%微量元素溶液。葡萄糖、果糖或蔗糖溶液根據(jù)需要添加。
1.4 蔗糖酶酶活測定
蔗糖酶的酶活測定,參照GB/T 5009.255-2016中的方法進行[17]。蔗糖酶酶活定義:一個蔗糖酶單位(U)在37℃、pH 6.5條件下,每分鐘水解產(chǎn)生1 μmol葡萄糖所需要的酶量定義為一個酶活力單位。
1.5 不同碳源生長與產(chǎn)酸評價
采用M9培養(yǎng)基制備固體平板,分別添加5 g/L的葡萄糖、果糖和蔗糖作為唯一碳源,同時添加氨芐青霉素100 μg/mL。重組菌由甘油凍藏管劃線至M9固體平板,37℃培養(yǎng)15 h,觀察菌落生長情況。搖瓶發(fā)酵工藝和發(fā)酵罐發(fā)酵工藝,均采用實驗室前期建立的發(fā)酵工藝進行[9]。
1.6 蔗糖酶基礎(chǔ)酶學(xué)性質(zhì)分析
蔗糖酶酶制劑采購于江蘇銳陽生物科技有限公司,酶活單位為70000 U/g。將酶粉用無菌水溶解后,過0.22 μm的微孔濾膜進行除菌,分裝后備用。
1.6.1 熱穩(wěn)定性
所試蔗糖酶在30~60℃溫度下熱處理1 h,并測定其殘余酶活,以未經(jīng)保溫處理的酶樣酶活為100%來計算各樣本的相對酶活,確定酶的熱穩(wěn)定性。
1.6.2 pH穩(wěn)定性
所試蔗糖酶在pH 3.0~7.5的條件下放置1 h,并測定其殘余酶活,以未經(jīng)放置1 h處理的酶樣酶活為100%來計算各樣本的相對酶活力,確定酶的pH穩(wěn)定性。
1.6.3 金屬離子對酶活的影響
所試蔗糖酶在5 mmol/L的不同金屬離子溶液(Mg2+、Zn2+、Ni+、K+、Mn2+、Ca2+、Li+、Na+或Fe2+)于4℃條件下放置16 h后,測定樣本的酶活,以添加等體積緩沖液的酶液酶活為100%來計算各樣本的相對酶活力,確定不同金屬離子對蔗糖酶酶活的影響。
1.7 同步糖化發(fā)酵工藝
1.7.1 蔗糖酶添加量的確定
在37℃、pH 7.0和42℃、pH 7.0的發(fā)酵工藝條件下測定蔗糖酶的酶活,并與酶活定義條件下(37℃、pH 6.5)蔗糖酶酶活對比。根據(jù)酶活定義條件下蔗糖酶對蔗糖的水解和單糖碳源發(fā)酵條件下糖的消耗量,確定蔗糖酶的基礎(chǔ)添加量。
1.7.2 同步糖化發(fā)酵試驗
采用前期建立的變溫發(fā)酵工藝加以改進進行[9],以蔗糖替代葡萄糖進行補料發(fā)酵。
1.8 分析方法
1.8.1 糖分的測定
⑴葡萄糖濃度測定:將樣品適當(dāng)稀釋后使用SBA-40C型生物傳感儀進行葡萄糖濃度的測定,取3次平行數(shù)據(jù)的平均值。
⑵果糖濃度測定:用二硝基水楊酸法(DNS)法[18]測定還原糖的濃度,測定值減去其中的葡萄糖濃度即為樣品中果糖的濃度,取3次平行數(shù)據(jù)的平均值。
⑶蔗糖濃度測定:蔗糖濃度用HPLC方法進行測定[19]。
1.8.2 菌體量測定
菌體量通過分光光度計濁光度法測OD600,然后按照1 OD等于0.38 g/L細胞干重的對應(yīng)關(guān)系進行生物量的換算。
1.8.3 L-乳酸及有機酸的測定
發(fā)酵過程采用SBA-40C生物傳感儀酶膜法對L-乳酸濃度進行快速測定。所有數(shù)據(jù)均為3次平行試驗結(jié)果的平均值。同時采用HPLC對樣本中L-乳酸及其他有機酸的準確含量進行測定,色譜檢測條件為:色譜柱為HPX-87H有機酸分析柱,柱溫為65℃,檢測波長為210 nm,流動相為5 mmol/L濃度的硫酸溶液,流速為0.8 mL/min,進樣量為10 μL。
1.8.4 L-乳酸光學(xué)純度的測定
采用HPLC進行,色譜檢測條件為:色譜柱為Astec CLC-L光學(xué)純度分析柱,柱溫為25℃,檢測波長為254 nm,流動相為5 mmol/L濃度的硫酸銅溶液,流速為1 mL/min,進樣量為10 μL。
2 結(jié)果與討論
2.1 乳酸生產(chǎn)菌的碳源代謝能力
將菌株JC31L分別劃線于以5 g/L濃度的葡萄糖、果糖、蔗糖為唯一碳源的M9固體培養(yǎng)基上,37℃培養(yǎng)15 h,觀察菌體生長情況,同步分別以葡萄糖、果糖、蔗糖為唯一碳源進行搖瓶發(fā)酵,分別測定生物量L-乳酸濃度,結(jié)果如圖1所示。菌株JC31L在蔗糖為唯一碳源處未長出菌落,而在葡萄糖、果糖碳源處表現(xiàn)出較好的生長特征;在液體培養(yǎng)條件下,菌株同樣可以利用葡萄糖或果糖為碳源進行生長、發(fā)酵,但不能以蔗糖為碳源進行生長、發(fā)酵。可見,L-乳酸生產(chǎn)菌株JC31L不具有直接利用蔗糖的能力。此菌株能夠很好代謝葡萄糖和果糖,也從另外一個方面說明,蔗糖被水解為葡萄糖和果糖后,可以作為此菌株的碳源。
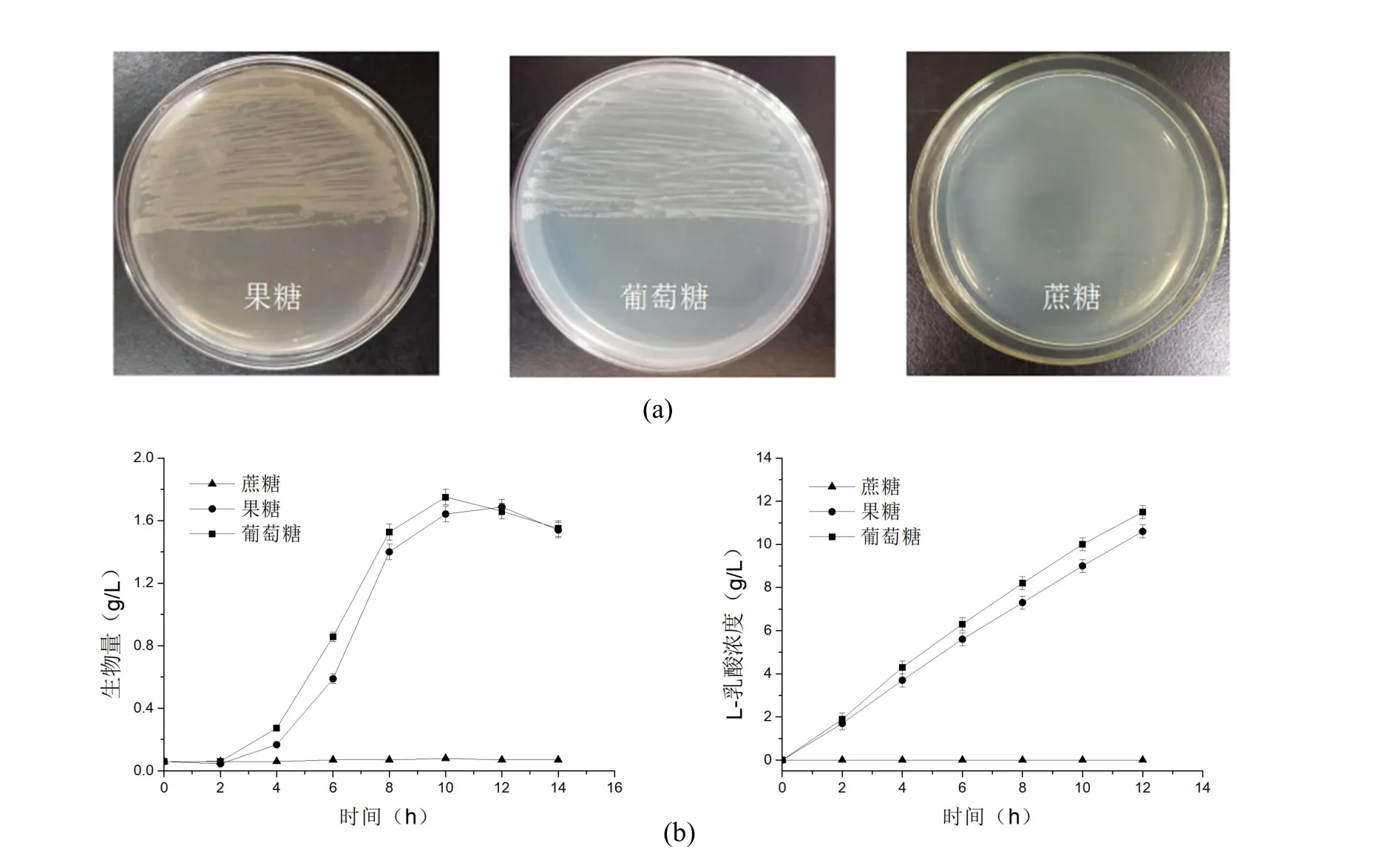
圖1 出發(fā)菌JC31L利用不同碳源的生長和產(chǎn)酸情況
2.2 代謝單糖和轉(zhuǎn)化糖為L-乳酸
在5 L發(fā)酵罐中,分別以葡萄糖、果糖和蔗糖酶解后的轉(zhuǎn)化糖為碳源進行產(chǎn)L-乳酸發(fā)酵,結(jié)果如圖2和表2所示。菌株JC31L能高效利用葡萄糖或果糖進行L-乳酸發(fā)酵生產(chǎn);以轉(zhuǎn)化糖為碳源進行發(fā)酵生產(chǎn)時,葡萄糖和果糖代謝存在葡萄糖效應(yīng),葡 萄糖代謝優(yōu)先于果糖代謝,當(dāng)葡萄糖濃度低于10 g/L時葡萄糖效應(yīng)消除,果糖代謝效率明顯恢復(fù)。可見,優(yōu)化轉(zhuǎn)化糖的生成方式和補加方式,可以實現(xiàn)菌株JC31L從蔗糖直接高效合成乳酸單體。由于蔗糖可以用蔗糖酶快捷水解為轉(zhuǎn)化糖,為此,我們需要進一步探討蔗糖酶的應(yīng)用生化屬性。
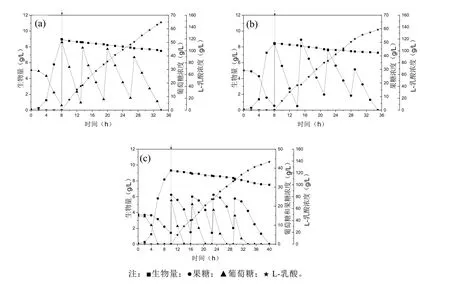
圖2 5 L發(fā)酵罐中出發(fā)菌JC31L利用不同碳源生產(chǎn)L-乳酸
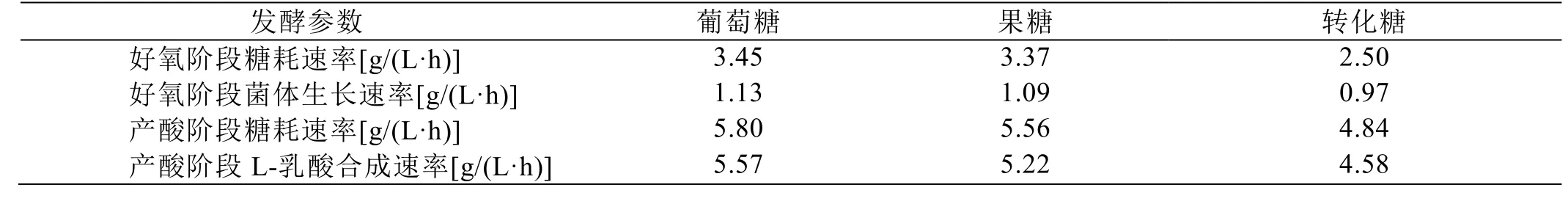
表2 不同碳源L-乳酸發(fā)酵差異
2.3 蔗糖酶在模擬發(fā)酵生產(chǎn)條件下的酶學(xué)特征
2.3.1 熱穩(wěn)定性
在pH 6.5的條件下,將蔗糖酶酶液在不同溫度下保溫1 h,取樣測定殘余酶活,得到蔗糖酶的溫度穩(wěn)定性曲線,結(jié)果如圖3所示。蔗糖酶在37~55℃范圍內(nèi)比較穩(wěn)定。蔗糖酶在37℃下,熱穩(wěn)定性為93%;蔗糖酶在42℃下,熱穩(wěn)定性為95%。可見,其熱穩(wěn)定性適用于發(fā)酵過程的蔗糖水解。
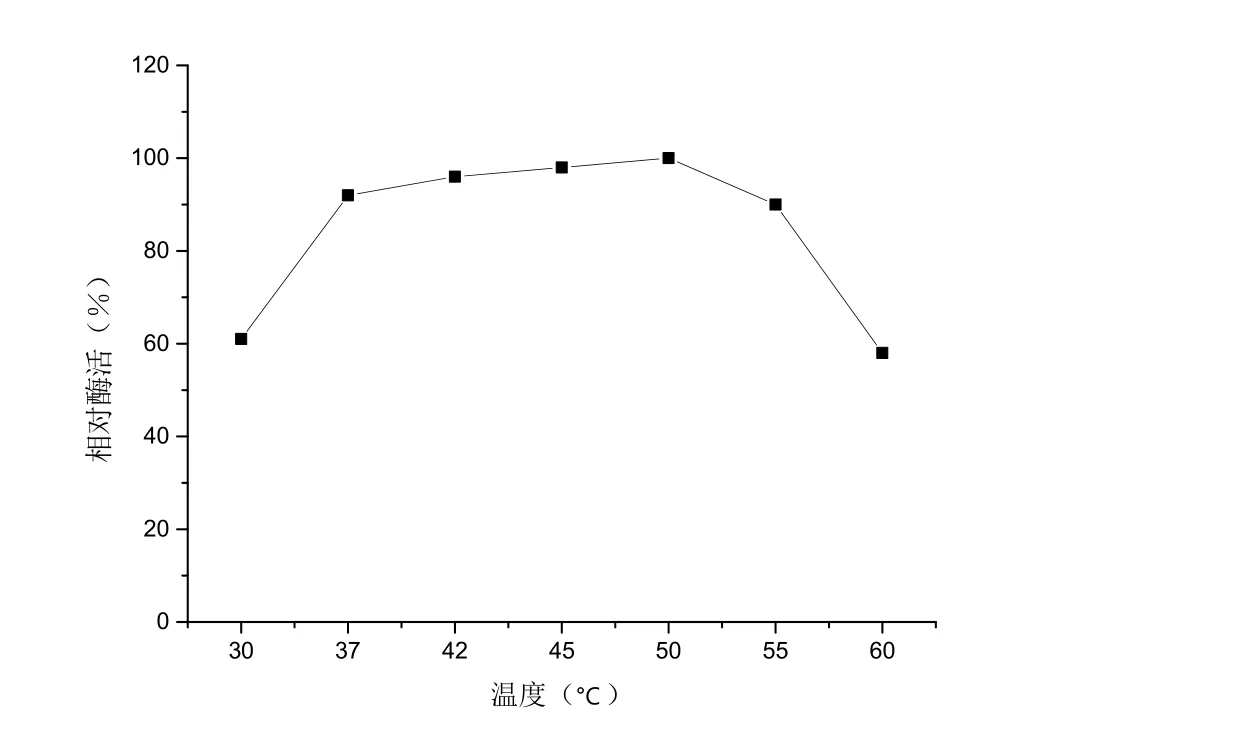
圖3 蔗糖酶在不同溫度下的熱穩(wěn)定性
2.3.2 pH穩(wěn)定性
在37℃條件下,將蔗糖酶酶液在不同pH緩沖液中室溫下放置1 h,取樣測定殘余酶活,得到蔗糖酶的pH穩(wěn)定性曲線,結(jié)果如圖4所示。蔗糖酶在 pH 5.0~7.0范圍內(nèi)比較穩(wěn)定。蔗糖酶在pH 6.5下,穩(wěn)定性為96%;蔗糖酶在pH 7.0下,穩(wěn)定性為90%。可見,此蔗糖酶的作用pH與發(fā)酵工藝pH要求吻合。
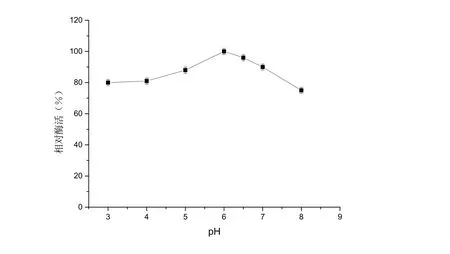
圖4 蔗糖酶在不同pH下的穩(wěn)定性
2.3.3 金屬離子對酶活力的影響
不同金屬離子對酶活的影響結(jié)果如圖5所示。所測試的9種金屬離子在5 mmol/L濃度下對蔗糖酶的酶活力作用不同,Mg2+、K+和Ca2+對蔗糖酶酶活力無明顯作用,Zn2+、Ni+以及Mn2+對蔗糖酶酶活力有微弱抑制作用,F(xiàn)e2+對蔗糖酶酶活力有明顯抑制作用,Li+和Na+對蔗糖酶酶活力有明顯促進作用。發(fā)酵培養(yǎng)基中所含的金屬離子為K+和Na+,厭氧階段用Ca(OH)2來維持發(fā)酵pH,可見,發(fā)酵中培養(yǎng)基的成分和pH調(diào)節(jié)劑對蔗糖酶的酶活力沒有抑制作用。
2.4 同步糖化發(fā)酵合成L-乳酸工藝的建立與優(yōu)化
由單糖發(fā)酵數(shù)據(jù)可知,在5 L發(fā)酵罐中進行乳酸發(fā)酵,好氧生長階段菌株消耗75 g糖所需的時間為8 h,厭氧產(chǎn)酸階段菌株消耗500 g糖所需的時間為26 h。因此,根據(jù)酶活定義選擇好氧階段蔗糖酶的基礎(chǔ)添加量為500 U,選擇厭氧階段蔗糖酶的基礎(chǔ)添加量為1000 U。
在5 L發(fā)酵罐中,考察了蔗糖為碳源同步糖化發(fā)酵生產(chǎn)L-乳酸的情況,結(jié)果如圖6所示。細胞增殖階段,蔗糖水解速率為8.8 g/h,菌體生長9 h后 生物量達到9.2 g/L,菌體生長速率為1.02 g/(L·h);發(fā)酵產(chǎn)酸階段,蔗糖平均水解速率為18.8 g/h,發(fā)酵產(chǎn)酸27.5 h后,L-乳酸的平均生成速率為4.95 g/(L·h),L-乳酸積累量為136 g/L,糖酸轉(zhuǎn)化率為95.2%。在整個發(fā)酵過程中可以看到,葡萄糖始終處于極低水平,蔗糖酶添加量不足應(yīng)該是引起這種現(xiàn)象的主因,連帶也影響了菌體的生長和產(chǎn)酸速率。
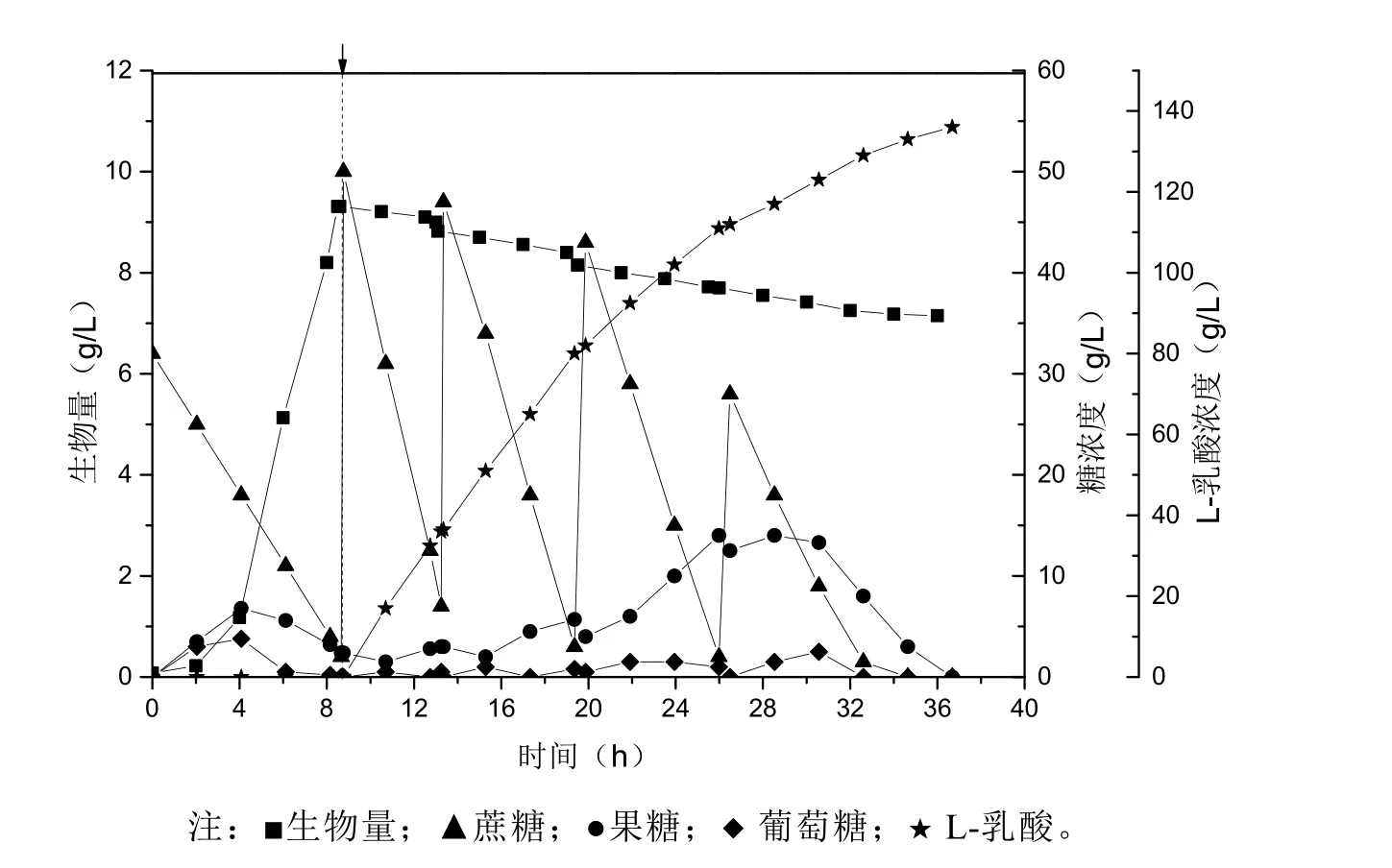
圖6 菌株JC31L以蔗糖為碳源在蔗糖酶存在下的L-乳酸生產(chǎn)
依據(jù)上述發(fā)酵數(shù)據(jù)進行計算與分析得出,菌體生長階段蔗糖酶添加量為750 U,發(fā)酵產(chǎn)酸階段蔗糖酶添加量為1500 U。以此添加量在發(fā)酵過程中添加蔗糖酶,進行上述相似的發(fā)酵試驗,結(jié)果如圖7所示。菌株生長階段,蔗糖水解速率達到12.5 g/h,菌株生長速率為1.19 g/(L·h);發(fā)酵產(chǎn)酸階段,蔗糖平均水解速率為27.7 g/h,L-乳酸的平均生成速率為5.38 g/(L·h),L-乳酸積累量達到140 g/L,糖酸轉(zhuǎn)化率為98%。利用同步糖化發(fā)酵技術(shù),避免了高濃度葡萄糖存在時菌株對果糖代謝的影響,L-乳酸的合成速率比以蔗糖為碳源先糖化后發(fā)酵工藝提高了17.47%,顯著優(yōu)于已有報道[10,20]。
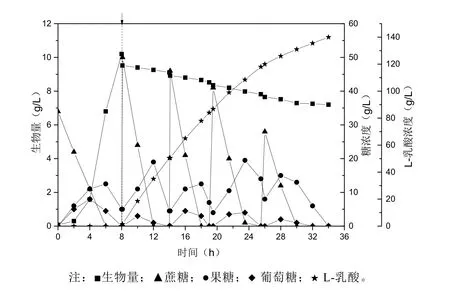
圖7 菌株JC31L以蔗糖為原料同步糖化發(fā)酵生產(chǎn)L-乳酸
3 結(jié)論
本文建立并優(yōu)化了以蔗糖為原料同步糖化發(fā)酵生產(chǎn)L-乳酸的工藝,在此工藝下,L-乳酸的平均產(chǎn)酸速率為5.38 g/(L·h),厭氧產(chǎn)酸階段的糖酸轉(zhuǎn)化率為98%,L-乳酸的積累量為140 g/L,成功實現(xiàn)了蔗糖到聚合級L-乳酸的高效轉(zhuǎn)化。菌株利用同步糖化發(fā)酵技術(shù)避免了高濃度葡萄糖存在時菌株對果糖代謝的影響,L-乳酸的合成速率比以蔗糖為碳源先糖化后發(fā)酵技術(shù)提高了17.47%。
本研究不僅為大宗原料蔗糖轉(zhuǎn)化為大宗需求量乳酸單體的工業(yè)化生產(chǎn)提供了重要參考,也為以蔗糖為主要成分的碳源(甘蔗汁、甘蔗糖蜜、甜菜)為原料進行聚合級L-乳酸的工業(yè)化生產(chǎn)奠定了基礎(chǔ)。這將有助于后續(xù)優(yōu)化蔗糖產(chǎn)業(yè)的結(jié)構(gòu)與豐富聚合級乳酸單體生物制造的原料多樣性。

