外周血中抗雙鏈DNA抗體、抗核小體抗體在系統性紅斑狼瘡伴腎損害患者中的表達及對臨床療效的影響
王小杰,孔凌云
(駐馬店市中醫院 檢驗科,河南 駐馬店 463000)
系統性紅斑狼瘡(sgstemic lupus erythematosus,SLE)病情較為復雜,常累及腎引發腎損害,若不及時治療會導致腎衰竭,增加患者病死風險。潑尼松龍片聯合環磷酰胺是治療SLE伴腎損害的高效方法,能有效改善患者臨床癥狀。但臨床治療實踐發現,仍有部分患者達不到預期的治療效果,預后改善效果不甚理想。有研究表明,抗核小體抗體(anti-nucleosome antibody,ANuA)可導致腎小球基底膜破壞,與腎功能損傷密切相關[1]。也有研究表明,抗雙鏈DNA抗體(anti-double strand DNA,Anti-ds-DNA)與SLE疾病活動度密切相關,參與疾病的發生與發展[2]。鑒于上述指標與SLE腎功能損害及疾病進展的關系,提示二者可能對SLE伴腎損害患者的治療效果產生一定影響。基于此,本研究分析外周血中Anti-ds-DNA、ANuA水平在SLE伴腎損害患者中的表達及對臨床療效的影響。
1 資料與方法
1.1 一般資料回顧性分析,收集2018年1月至2020年12月駐馬店市中醫院收治的60例經階段性治療有效的SLE伴腎損害患者的臨床資料,將其納入治療有效組;另外收集同期收治的60例經階段性治療無效的SLE伴腎損害患者的臨床資料,將其納入治療無效組。
1.2 選取標準(1)納入標準:①符合《系統性紅斑狼瘡診斷及治療指南》[3]中相關標準,且臨床確診出現腎損害[持續性蛋白尿(>0.5 g·d-1或>+),出現血尿或管型尿];②心、肝功能正常;③臨床資料完整;④遵醫囑接受潑尼松龍片聯合環磷酰胺治療。(2)排除標準:①合并惡性腫瘤、血液病、感染性及傳染性疾病;②合并類風濕性關節炎、干燥綜合征以及炎癥性腸炎等其他自身免疫疾病;③入組前接受糖皮質激素、免疫抑制劑治療;④入組前6個月內有重大創傷及手術史。
1.3 評估方法
1.3.1一般資料收集 查閱患者病例資料,明確患者性別(男、女)、年齡、體質量指數、飲酒史(平均酒精攝入量>20 g·d-1,持續5 a)(有、無)、吸煙史(吸煙指數>400)(有、無)以及SLE疾病活動度量表(systemic lupus erythematosus disease activity index,SLEDAI)評分[4]。
1.3.2實驗室指標測定 在患者入院后,治療前空腹狀態下抽取8~10 mL肘靜脈血,分成兩份。一份使用TG16-WS型高速冷凍離心機(江蘇華大離心機制造有限公司)以3 000 r·min-1的離心速率以及10 cm的離心半徑離心15 min后取上清液,以免疫比濁法測定免疫球蛋白(immunoglobin,Ig)G水平,試劑盒購自上海華科生物工程股份有限公司。一份全血抗凝處理后使用 NovoCyteD2040R型流式細胞儀(ACEA生物科技有限公司)測定T淋巴細胞亞群(CD3+、CD4+、CD8+)以及自然殺傷(natural killer,NK)細胞水平,試劑盒購自艾森生物有限公司。采用酶聯免疫吸附試驗測定Anti-ds-DNA及ANuA水平,試劑盒分別購自上海科新生物技術股份有限公司、德國歐蒙公司。
1.3.3臨床療效判定 患者在入院后遵醫囑完成為期3個月的潑尼松龍片聯合環磷酰胺階段性治療方案,結束治療后依據《臨床疾病診斷與療效判斷標準》[5]中相應標準判定患者臨床療效。治療有效:尿蛋白<0.4 g·d-1(連續2次以上)或血白蛋白>35 g·L-1;無活動性尿沉渣異常;血肌酐正常或下降≥基礎值的50%(治療前血肌酐≥221 μmol·L-1);無腎外活動病變。治療無效:尿蛋白>0.2 g·d-1,或下降值<基礎值的50%(起始>4 g·d-1);或血白蛋白≤30 g·d-1;或有活動性尿沉渣異常;或血肌酐下降值≤基礎值的50%。
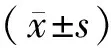
2 結果
2.1 兩組患者一般資料兩組患者性別、年齡、體質量指數、吸煙史、飲酒史、SLEDAI評分以及CD3+、CD4+、CD8+、NK細胞水平比較,差異無統計學意義(P>0.05);與治療有效組相比,治療無效組外周血Anti-ds-DNA、ANuA水平升高,差異有統計學意義(P<0.05)。見表1。

表1 不同臨床療效的SLE伴腎損害患者的 一般資料比較
2.2 logistic回歸分析將SLE伴腎損害患者治療后臨床療效作為因變量(1=治療無效,0=治療有效),經logistic回歸分析顯示,外周血Anti-ds-DNA、ANuA過表達是SLE伴腎損害患者治療無效的風險因子(OR>1,P<0.05)。見表2。

表2 外周血Anti-ds-DNA、ANuA對SLE伴腎損害患者臨床療效的logistic回歸分析
2.3 Anti-ds-DNA、ANuA預測SLE伴腎損害患者治療無效風險的效能分析將SLE伴腎損害患者治療后臨床療效作為因變量(1=治療無效,0=治療有效),繪制ROC曲線(見圖1)結果顯示,外周血Anti-ds-DNA、ANuA單獨及聯合預測SLE伴腎損害患者治療無效風險的AUC均>0.7,具有一定的預測價值,且聯合檢測的預測效能最好。見表3。

表3 外周血Anti-ds-DNA、ANuA預測SLE伴腎損害患者治療無效風險的效能分析

Anti-ds-DNA為抗雙鏈DNA抗體;ANuA為抗核小體抗體;SLE為系統性紅斑狼瘡。
治療無效風險的ROC曲線圖
3 討論
絕大部分SLE伴腎損傷患者在經對癥治療后能取得較好的效果,但該疾病臨床表現復雜,病情進展程度不一,治療后部分患者仍存在治療無效的情況。SLE伴腎損傷治療無效患者可惡化為腎衰竭,是導致SLE患者病死的最主要原因之一。
隨著對SLE伴腎損傷患者疾病的不斷深入研究,發現多種自身抗體與患者疾病發生和發展有一定的關系。本研究結果顯示,與治療有效組相比,治療無效組外周血Anti-ds-DNA、ANuA水平高,提示外周血Anti-ds-DNA、ANuA水平和SLE伴腎損傷患者治療效果有關。且經logistic回歸顯示,外周血Anti-ds-DNA、ANuA過表達是SLE伴腎損害患者治療無效的風險因子,進一步明確外周血Anti-ds-DNA、ANuA水平可影響SLE伴腎損害患者治療效果。分析可能的原因為,Anti-ds-DNA的反應點位于DNA脫氧核糖磷酸框架上,可有效結合腎小球基底膜微血管結構上的原位DNA分子,形成抗原抗體復合物,通過補體活化途徑激活炎癥系統,導致腎組織損傷,進而誘導腎小球免疫負荷物不斷沉積并致使腎功能不斷受損;并且Anti-ds-DNA還可進入腎小球膜細胞,引起腎小球細胞增殖,促進細胞融合和蛋白尿形成,不斷損害腎功能[6-7]。因此,Anti-ds-DNA水平越高,腎功能受損越嚴重,SLE伴腎損傷患者治療無效風險越高。ANuA可刺激機體產生大量蛋白抗體,蛋白抗體可與腎小球基底膜上的硫酸肝素相結合,介導腎免疫損傷;并且ANuA也可與腎小球基底膜上的抗原抗體復合物發生抗原抗體反應,破壞腎小球基底膜的結構與生理功能[8-9]。因此,ANuA水平越高,腎功能受損越嚴重,患者治療無效風險越大。本研究繪制ROC曲線發現,入院時外周血Anti-ds-DNA、ANuA單獨及聯合預測SLE伴腎損害患者治療無效風險均有一定價值,且當二者的cut-off值分別取0.545、66.752 RU·mL-1時,可獲得最佳預測價值。這說明入院時外周血Anti-ds-DNA、ANuA過表達對預測SLE伴腎損害患者治療無效風險有一定價值,未來可考慮通過早期監測SLE伴腎損害患者入院時外周血Anti-ds-DNA、ANuA表達水平來評估患者治療效果。若發現外周血Anti-ds-DNA、ANuA表達異常升高,要采取相應干預措施,可能對降低SLE伴腎損害患者治療無效發生率有一定意義。
綜上所述,SLE伴腎損害患者入院時外周血Anti-ds-DNA、ANuA過表達可能與治療效果有關,對預測治療無效風險有一定價值,入院時二者過表達可能提示治療無效高風險,可指導早期治療方案的合理調整,可能對降低治療無效發生率有一定價值。

