TACE聯(lián)合卡瑞利珠單抗及甲磺酸阿帕替尼治療晚期肝細(xì)胞癌16例
黃 劍, 葛乃建, 徐 偉, 于曉河, 石志勇, 蔡 飛, 張小鋒, 周小琴,楊業(yè)發(fā)
HCC起病隱匿、進(jìn)展迅速且早期診斷困難,大部分患者就診時(shí)即進(jìn)展致中晚期,無法手術(shù)切除或超出肝移植適應(yīng)證[1]。TACE為不可手術(shù)切除HCC患者最佳治療方案[2-3],但單純TACE治療5年生存率僅為8%~43%,且腫瘤伴肝內(nèi)多發(fā)子灶時(shí)治療效果欠佳,且對(duì)肝外轉(zhuǎn)移病灶無效[4]。因此國(guó)內(nèi)外學(xué)者針對(duì)不同抗癌機(jī)制研發(fā)出了諸多抗腫瘤新藥,主要包括針對(duì)血管內(nèi)皮細(xì)胞生長(zhǎng)的靶向藥及免疫抑制劑PD(L)-1[5-6]。靶向藥或PD-1單一用藥腫瘤控制率低,且耐藥率高、藥物不良反應(yīng)較大,因此迫切需要研究針對(duì)不同抗癌機(jī)制的系統(tǒng)性聯(lián)合治療以減少HCC的耐藥率及提高聯(lián)合治療的療效[2]。
有研究表明我國(guó)自主研發(fā)的卡瑞利珠單抗聯(lián)合甲磺酸阿帕尼對(duì)消化系統(tǒng)惡性腫瘤有較高的治療價(jià)值[7]。本課題遂采用傳統(tǒng)的TACE聯(lián)合卡瑞利珠單抗及甲磺酸阿帕替尼治療晚期HCC,評(píng)估其安全性和療效,為臨床晚期肝細(xì)胞癌的綜合性系統(tǒng)治療提供臨床循證依據(jù)。
1 材料與方法
1.1 病例選擇
回顧性分析我科2019年1月至2020年12月接受TACE聯(lián)合卡瑞利珠單抗和甲磺酸阿帕替尼治療的晚期HCC患者的臨床資料。研究對(duì)象納入標(biāo)準(zhǔn):①經(jīng)組織病理學(xué)或影像學(xué)臨床確診HCC;②符合中國(guó)HCC分期方案CNLCⅢa/Ⅲb(2019版《肝細(xì)胞癌診療規(guī)范》)及BCLC C期;③Child-Pugh A/B;④體力狀況評(píng)分(PS)0~2分;⑤腫瘤總體積占全肝比例小于70%。排除標(biāo)準(zhǔn):①肝功能嚴(yán)重障礙(Child-Pugh C級(jí)),包括黃疸、肝性腦病、難治性腹水或肝腎綜合征;②凝血功能嚴(yán)重減退,且無法糾正;③門靜脈主干被癌栓完全栓塞,且側(cè)支血管形成少;④合并活動(dòng)性肝炎或嚴(yán)重感染且不能同時(shí)治療;⑤美國(guó)東部腫瘤協(xié)作組(ECOG)評(píng)分大于2分、惡液質(zhì)或多器官功能衰竭;⑥腫瘤總體積占全肝體積>70%;⑦腎功能障礙指肌酐>175 μmol/L或者肌酐清除率<30 mL/min;⑧化療藥物或其它藥物引起的外周血白細(xì)胞和血小板顯著減少,白細(xì)胞<3.0×109/L、血小板<50×109/L且不能糾正;⑨合并肺部、腎臟、心腦血管等其他嚴(yán)重疾病而無法接受TACE+靶向藥+PD1聯(lián)合治療[3]。
1.2 方法
1.2.1 聯(lián)合治療方案
1.2.1.1 TACE治療:①采用Seldinger方法經(jīng)皮穿刺股動(dòng)脈途徑插管,將導(dǎo)管置于腹腔干、肝總動(dòng)脈行DSA造影,造影圖像釆集包括動(dòng)脈期、實(shí)質(zhì)期及靜脈期,部分患者必要時(shí)加做腸系膜上動(dòng)脈、右腎動(dòng)脈及右膈動(dòng)脈等造影尋找腫瘤側(cè)支供血。②采用微導(dǎo)管超選腫瘤供血?jiǎng)用},根據(jù)動(dòng)脈造影結(jié)果需依次超選所有腫瘤供血?jiǎng)用}。③主要化療藥物包括鹽酸表柔比星40~80 mg、羥基喜樹堿10~20 mg及奧沙利鉑100 mg,先經(jīng)微導(dǎo)管灌注一部分,再將另一部分表柔吡星及羥基喜樹堿與碘油混合成乳劑,同時(shí)交替注射顆粒性栓塞劑(聚乙烯醇顆粒及明膠海綿顆粒)進(jìn)行聯(lián)合性栓塞。栓塞完全后再次造影,明確腫瘤是否完全栓塞,如有局部欠缺則繼續(xù)栓塞至造影示腫瘤完全栓塞。巨大腫瘤及左右葉多發(fā)腫瘤為防止肝腎功能衰竭,分2次進(jìn)行TACE治療。
1.2.1.2 阿帕替尼治療:TACE治療栓塞后綜合征緩解后,1周即開始口服甲磺酸阿帕替尼(250 mg,每日1次)治療。后續(xù)TACE治療前3 d暫停甲磺酸阿帕替尼治療。當(dāng)患者不良反應(yīng)較大時(shí),阿帕替尼劑量減小或隔天口服用藥。當(dāng)無法耐受藥物不良反應(yīng)時(shí)則停止用藥。
1.2.1.3 卡瑞利珠單抗治療:TACE治療栓塞后綜合征緩解后2周內(nèi)開始進(jìn)行卡瑞利珠單抗(200 mg,靜脈滴注),后每3周重復(fù)用藥1次。
首次聯(lián)合治療后1個(gè)月進(jìn)行第1次影像學(xué)評(píng)估(推薦增強(qiáng)MRI)、肝功能評(píng)估及血清AFP、異常凝血酶原(PIVKA)水平測(cè)定。如肝內(nèi)仍有活性腫瘤病灶,則補(bǔ)做1次TACE治療。后每3個(gè)月進(jìn)行一次上述評(píng)估,如有新生腫瘤且無TACE JSH定義的TACE失敗或抵抗,則可繼續(xù)行TACE治療。治療期間因非疾病進(jìn)展的原因停止聯(lián)合治療時(shí),則結(jié)束聯(lián)合治療時(shí)進(jìn)行一次評(píng)估。患者出現(xiàn)腫瘤進(jìn)展且聯(lián)合治療不再獲益、不可耐受的不良反應(yīng)及其他任何原因無法聯(lián)合治療時(shí)則視為聯(lián)合治療終止。
1.2.2 結(jié)局評(píng)價(jià)指標(biāo)
1.2.2.1 安全性評(píng)估:依據(jù)NCI-CTCAE v5.0(National Cancer Institute’s Common Terminology Criteria for Adverse Events)標(biāo)準(zhǔn)對(duì)聯(lián)合治療后的不良反應(yīng)進(jìn)行評(píng)估,不良事件(1、2級(jí))及嚴(yán)重不良事件(3~5級(jí))[8]。TACE治療栓 塞后綜合 征指TACE治療后因腫瘤組織缺血壞死引起的惡心、嘔吐、腹痛、發(fā)熱、食欲下降等一系列臨床癥狀。高膽紅素癥指總膽紅素(TBIL)>51 μmol/L,高轉(zhuǎn)氨酶血癥指ALT>200 IU/mL、AST>200 IU/mL。
1.2.2.2 療效評(píng)估:依據(jù)改良實(shí)體瘤評(píng)價(jià)標(biāo)準(zhǔn)(mRecist)及RECICL version 5標(biāo)準(zhǔn)評(píng)估腫瘤完全緩解(CR)、部分緩解(PR)、穩(wěn)定(SD)、腫瘤進(jìn)展(PD)、疾病控制率(DCR)、無進(jìn)展生存期(PFS)及總生存期(OS)[9-10]。PD指無法繼續(xù)聯(lián)合治療或聯(lián)合治療不再獲益,包括肝內(nèi)腫瘤病灶較基線增大超過50%、肝功能惡化至Child-Pugh C級(jí)、腫瘤侵犯門靜脈主干或下腔靜脈及肝外轉(zhuǎn)移,還包括JSH定義的TACE失敗/抵抗(JSH-LCSGJ criteria 2014 update)[4]。DCR的定義為CR、PR、SD之和。PFS指從接受聯(lián)合治療開始至腫瘤進(jìn)展或任何原因引起死亡的時(shí)間。OS指患者從聯(lián)合治療開始至末次隨訪時(shí)間或任何原因致患者死亡的時(shí)間。
1.3 統(tǒng)計(jì)學(xué)方法
所有結(jié)果數(shù)據(jù)均采用SPSS 23.0(SPSS,Chicago,IL,USA)進(jìn)行統(tǒng)計(jì)學(xué)分析。無進(jìn)展生存時(shí)間及總生存時(shí)間以中位數(shù)表示,研究結(jié)果百分?jǐn)?shù)均計(jì)算95%CI。
2 結(jié)果
2.1 一般患者臨床資料
患者詳細(xì)臨床資料及腫瘤特征如表1所示。16例患者均為BCLC C期,其中CNLCⅢa10例,CNLCⅢb6例。JSH-LCSGJ共識(shí)腫瘤直徑>4 cm及、瘤個(gè)數(shù)>7個(gè)及腫瘤散發(fā)于左右肝葉均提示TACE療效均欠佳。腫瘤侵犯門靜脈共10例,其中累及門靜脈主干5例,僅累及右側(cè)門靜脈3例,僅累及左側(cè)門靜脈2例。腫瘤累及下腔靜脈2例,僅累及肝靜脈3例。9例患者合并肝外轉(zhuǎn)移,其中合并肺轉(zhuǎn)移5例,合并腹腔內(nèi)淋巴結(jié)轉(zhuǎn)移3例,合并腹腔內(nèi)轉(zhuǎn)移1例。截至最后一次隨訪16例患者行TACE手術(shù)共39例/次,1次TACE 3例(18.8%)、2次TACE 7例(43.7%)、3次TACE 3例(18.8%)、4次TACE 2例(12.5%)、5次TACE 1例(6.2%)。
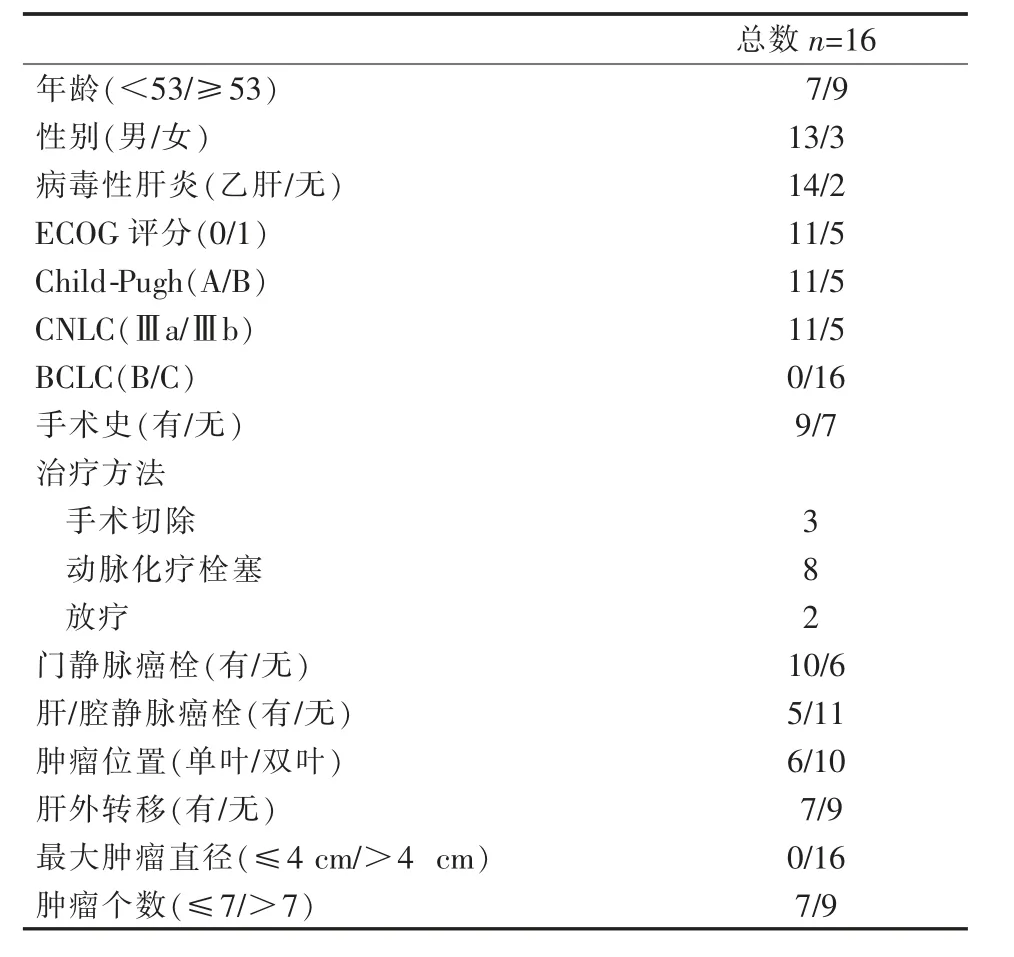
表1 患者一般臨床資料及腫瘤特征 n
2.2 聯(lián)合治療相關(guān)不良事件
16例患者聯(lián)合治療后相關(guān)并發(fā)癥具體如表2。16例(100%)患者首次TACE治療后均出現(xiàn)TACE栓塞后綜合征,13例(81.25%)出現(xiàn)術(shù)后ALT、AST升高,經(jīng)對(duì)支持治療好均好轉(zhuǎn)。1例患者TACE術(shù)后出現(xiàn)肝膿腫,后行經(jīng)皮肝膿腫穿刺引流后好轉(zhuǎn)。聯(lián)合治療過程中14(87.5%,95%CI,69.3%~100%)例出現(xiàn)靶向藥及PD-1相關(guān)不良事件,其中1例患者出現(xiàn)少見的免疫性垂體炎,乏力明顯,經(jīng)甲強(qiáng)龍逐步遞減治療后好轉(zhuǎn),各項(xiàng)指標(biāo)均正常。6例(37.5%,95%CI,10.9%~64.1%)出現(xiàn)3級(jí)嚴(yán)重不良事件,包括2例(12.5%,95%CI,0~30.7%)手足綜合征,3例(18.75%,95%CI,0~40.2%)嚴(yán)重腹瀉和1例(6.25%,95%CI,0~19.6%)免疫性肺炎,經(jīng)臨床對(duì)癥支持治療后均好轉(zhuǎn)。所有患者均未出現(xiàn)4、5級(jí)嚴(yán)重不良事件及導(dǎo)致患者死亡的嚴(yán)重不良反應(yīng)。

表2 16例患者聯(lián)合治療過程中相關(guān)不良事件 n(%)
2.3 聯(lián)合治療腫瘤反應(yīng)及預(yù)后
16例患者中位隨訪時(shí)間11個(gè)月(3~24個(gè)月)。2例(12.5%,95%CI,0~30.7%)達(dá)到CR(圖1),10例(62.5%,95%CI,35.9%~89.1%)PR,2例(12.5%,95%CI,0~30.7%)SD,14例(87.5%,95%CI,69.3%~100%)患者聯(lián)合治療3個(gè)月后復(fù)查達(dá)到DCR(表3)。中位PFS長(zhǎng)達(dá)9個(gè)月(95%CI,5.58~13.29),中位OS 12個(gè)月(95%CI,9.0~16.1個(gè)月)(表3)。截至末次隨訪3例(18.8%)患者死亡,1例聯(lián)合治療6個(gè)月后腫瘤進(jìn)展,再次行TACE治療后出現(xiàn)肝膿腫,遂停止聯(lián)合治療,后腫瘤全身多發(fā)轉(zhuǎn)移致多臟器功能衰竭死亡。2例(12.5%,95%CI,0~30.7%)聯(lián)合治療無效,腫瘤迅速進(jìn)展致肝功能衰竭死亡。

圖1 TACE聯(lián)合卡瑞利珠單抗及阿帕替尼治療HCC伴肺轉(zhuǎn)移前后對(duì)比

表3 患者聯(lián)合治療預(yù)后
3 討論
TACE已成為不可切除中晚期HCC的最佳治療方案,其在阻斷腫瘤血供的同時(shí)還于瘤體內(nèi)聚集高濃度的化療藥,最大限度地殺滅腫瘤細(xì) 胞[1,3]。HCC多次TACE治療后隨著原供血血管閉塞、側(cè)支毛細(xì)血管生長(zhǎng)及腫瘤細(xì)胞對(duì)化療藥物的耐受,腫瘤即進(jìn)入TACE耐受或TACE失敗期[4]。HCC伴肝內(nèi)多發(fā)轉(zhuǎn)移,特別是腫瘤位于肝左右葉時(shí),TACE可能損傷無腫瘤肝組織致肝功能損傷,甚至因大面積肝組織缺血致肝功能衰竭死亡[4]。腫瘤個(gè)數(shù)4~6、7~10和>10個(gè)時(shí),TACE無效率分別達(dá)到23%、32%和42%,因此當(dāng)TACE療效不佳、腫瘤多發(fā)或合并肝外轉(zhuǎn)移時(shí),則需及時(shí)調(diào)整治療 方 案[2,11]。
TACE可導(dǎo)致栓塞組織細(xì)胞缺血缺氧,刺激殘存病中的VEGF表達(dá),從而促使腫瘤血管再生并導(dǎo)致腫瘤復(fù)發(fā)和轉(zhuǎn)移[4-5]。有效抑制腫瘤區(qū)血管新生即可抑制腫瘤細(xì)胞的生長(zhǎng)及減少腫瘤轉(zhuǎn)移發(fā)生率,因此TACE聯(lián)合靶向藥理論上不僅可有效抑制腫瘤生長(zhǎng),還可有效防止HCC肝內(nèi)或肝外轉(zhuǎn)移[5,12]。目前臨床上治療HCC抗血管生成靶向藥物主要有索拉非尼、侖伐替尼、阿帕替尼、瑞戈非尼、卡博替尼及克唑替尼等[5]。肝臟的長(zhǎng)期慢性炎性反應(yīng)可上調(diào)PD-1受體,促進(jìn)免疫細(xì)胞自發(fā)凋亡而誘導(dǎo)HCC的發(fā)生與發(fā)展,因此免疫治療被認(rèn)為是HCC治療的新方向[13]。目前用于HCC的PD-1抑制劑主要包括nivolumab、pembrolizumab、bevacizumab、卡瑞利珠單抗等[5,13]。雖然PD-1免疫治療在HCC的治療中己顯示出良好療效,但單用時(shí)有效率仍不足20%[5]。一項(xiàng)pembrolizumab聯(lián)合lenvatinib治療HCC的研究結(jié)果顯示靶向藥聯(lián)合PD-1療效要優(yōu)于單一用藥[14],TACE聯(lián)合靶向藥及PD-1將成為不可切除HCC的治療新趨勢(shì)。
雖然靶向藥及PD-1的出現(xiàn)給不可切除HCC帶來了新的希望,但兩種藥物的不良反應(yīng)也受到臨床關(guān)注,因此TACE聯(lián)合靶向藥及PD-1聯(lián)合治療的并發(fā)癥也需進(jìn)一步深入研究[13]。一項(xiàng)卡瑞利珠單抗聯(lián)合甲磺酸阿帕尼治療晚期肝細(xì)胞癌及胃癌的Ⅰ期臨床研究中,出現(xiàn)27例次3級(jí)治療相關(guān)不良事件,但僅1例患者因膽紅素升高而停止治療,所有患者均無治療相關(guān)的不良事件,且無患者出現(xiàn)血管內(nèi)皮增生癥[7]。另外一項(xiàng)研究PD-(L)1聯(lián)合osimertinib治療肺癌的研究中,41例患者僅有6(95%CI 7%~29%)例出現(xiàn)3~4級(jí)不良事件,其中只有1例4級(jí)肝炎,且對(duì)癥治療后均好轉(zhuǎn)出院[15]。說明靶向藥聯(lián)合PD-1治療HCC還是相對(duì)較安全的。本研究中僅1例患者TACE后出現(xiàn)肝膿腫3級(jí)不良事件,穿刺引流后好轉(zhuǎn)。聯(lián)合治療過程中僅6例(37.5%,95%CI 10.9%~64.1%)出現(xiàn)卡瑞利珠單抗聯(lián)合甲磺酸阿帕尼治療相關(guān)3級(jí)不良事件,所有患者均未出現(xiàn)4、5級(jí)不良事件。說明TACE聯(lián)合卡瑞利珠單抗及甲磺酸阿帕尼治療HCC嚴(yán)重不良事件發(fā)生率低,安全性可靠。
Park等[16]研 究TACE聯(lián) 合 索 拉 菲 尼 治 療 不 可切除HCC,6個(gè)月腫瘤無進(jìn)展率高達(dá)52%,腫瘤中位無進(jìn)展時(shí)間長(zhǎng)達(dá)7.1個(gè)月,且患者無明顯嚴(yán)重不良事件。陳成等[17]meta分析TACE聯(lián)合阿帕替尼治療HCC疾病客觀緩解率及疾病控制率明顯高于單純TACE,且患者6個(gè)月、12個(gè)月生存期聯(lián)合治療明顯優(yōu)于單純TACE組。Zhu等[14]研究pembrolizumab治療靶向藥失敗的HCC,腫瘤客觀緩解率18%,其中1例患者達(dá)到CR,DCR也高達(dá)44%。Xu等[7]開展的一項(xiàng)卡瑞利珠單抗聯(lián)合甲磺酸阿帕尼治療不可手術(shù)消化道腫瘤的研究,晚期肝癌的PR高達(dá)50%[9]。鑒于上述靶向藥及PD-(L)1在HCC治療中的價(jià)值,本研究即開展了TACE聯(lián)合卡瑞利珠單抗及甲磺酸阿帕尼的探索性研究。14例(87.5%,95%CI 69.3%~100%)患者聯(lián)合治療3個(gè)月后達(dá)到DCR,說明對(duì)于晚期HCC患者聯(lián)合治療可有效提高患者的腫瘤控制率。值得一提的是2例HCC伴肺轉(zhuǎn)移患者達(dá)到CR,肝內(nèi)腫瘤及雙肺轉(zhuǎn)移瘤均完全消失,聯(lián)合治療為HCC伴全身多發(fā)轉(zhuǎn)移患者提供了根治的希望。本研究中16例患者均為BCLC C期及CNLCⅢ期,治療困難且預(yù)后不佳,但中位PFS高達(dá)9個(gè)月(95%CI 5.58~13.29個(gè)月)及中位OS高達(dá)12個(gè)月(95%CI 9.04~16.09),說明TACE聯(lián)合靶向藥及PD-1可有效延長(zhǎng)患者生存期,使患者生存獲益。但我們觀察到患者中位OS較中位PFS僅延長(zhǎng)3個(gè)月,我們的研究中2例未獲得DCR患者即因腫瘤短期內(nèi)進(jìn)展致肝功能衰竭死亡,可能為HCC患者一旦TACE聯(lián)合靶向藥及PD-1治療失敗后,很難提供其他有效的治療方案,腫瘤即迅速進(jìn)展致患者死亡。
本研究也有一定的局限性,首先樣本量較小,不排除數(shù)據(jù)結(jié)果的偏倚。其次隨訪時(shí)間較短,大部分患者OS未觀察到終點(diǎn)事件,我們預(yù)期如進(jìn)一步延長(zhǎng)患者隨訪時(shí)間,中位OS可能會(huì)進(jìn)一步延長(zhǎng)。再次本研究為單樣本觀察,缺乏相應(yīng)的對(duì)照組,實(shí)驗(yàn)結(jié)果說服力有待進(jìn)一步提高。我們參與了騰皋軍教授牽頭的課題“TACE聯(lián)合卡瑞利珠單抗和甲磺酸阿帕替尼對(duì)比TACE治療中晚期肝癌的隨機(jī)對(duì)照、開放、多中心臨床研究”,將會(huì)為HCC聯(lián)合治療獲取更為可靠的循證依據(jù)。
綜上所述,TACE聯(lián)合卡瑞利珠單抗及甲磺酸阿帕尼治療晚期HCC嚴(yán)重不良事件發(fā)生率低,腫瘤控制率較高,可有效延長(zhǎng)患者生存期,值得進(jìn)一步研究及臨床推廣。
- 介入放射學(xué)雜志的其它文章
- 《創(chuàng)傷骨科手術(shù)技術(shù)》出版:脊柱椎間孔鏡手術(shù)在腰椎間盤突出癥治療中的應(yīng)用探討
- 《孕婦護(hù)理與禁忌》出版:健康教育在孕婦護(hù)理管理中的應(yīng)用
- 《臨床醫(yī)學(xué)概論》出版:醫(yī)學(xué)護(hù)理在臨床醫(yī)學(xué)中的作用
- 《護(hù)理管理學(xué)(第4版)》出版:護(hù)理管理理論研究與實(shí)踐
- 《骨關(guān)節(jié)磁共振影像解剖圖譜》出版:比較MRI與CT在椎間盤突出的診斷價(jià)值差異及其臨床應(yīng)用價(jià)值分析
- LACbes?左心耳封堵系統(tǒng)結(jié)構(gòu)特征與應(yīng)用要點(diǎn)

