奧沙利鉑注射劑質(zhì)量分析及探索性研究
馬利娟,鄧 博
(西安萬(wàn)隆制藥股份有限公司,陜西 西安 710000)
奧沙利鉑作為第三代鉑類抗腫瘤藥物,其由瑞士德彪(Debiopharm)公司研發(fā),由法國(guó)賽菲諾(Sanofi Winthrop)公司于1996年上市[1]。我國(guó)引進(jìn)該藥物是在1999年,上市是在2000年[2]。在2004年,該藥物被美國(guó)食品藥物管理局(Food and Drug Administration,F(xiàn)AD)批準(zhǔn)用于治療晚期結(jié)腸癌,并列為一線治療方案。該藥物主要被用于治療卵巢癌、非小細(xì)胞癌、淋巴癌、直腸癌以及結(jié)腸癌等疾病中[3-4]。我國(guó)將該藥物列為國(guó)家基本藥物,并在《中國(guó)藥典》(2015第2版)中收錄。在應(yīng)用該藥物時(shí),其會(huì)對(duì)胃腸道系統(tǒng)、血液系統(tǒng)等產(chǎn)生不良反應(yīng)。其中,胃腸道系統(tǒng)不良反應(yīng)主要包括惡心、嘔吐、腹瀉以及黏膜炎等;血液系統(tǒng)不良反應(yīng)主要包括血小板及中性粒細(xì)胞減少等[5]。除此之外,在用該藥物進(jìn)行治療時(shí),還會(huì)對(duì)神經(jīng)系統(tǒng)產(chǎn)生影響,如導(dǎo)致外周感覺(jué)神經(jīng)病變等。因此,該藥物注射劑被我國(guó)列為國(guó)家食品藥品監(jiān)督管理局(State Food and Drug Administration,SFDA)藥品質(zhì)量評(píng)價(jià)性抽檢計(jì)劃的一個(gè)重要品種[6]。當(dāng)前,在我國(guó)國(guó)家局?jǐn)?shù)據(jù)庫(kù)中,生產(chǎn)該注射劑的企業(yè)達(dá)22家,批準(zhǔn)文號(hào)達(dá)30個(gè)。該注射劑的劑型主要有兩種,第一種為注射用無(wú)菌粉末;第二種為注射液。其中,注射液又可分為大輸液和小水針兩類。在此次研究中,選取13家生產(chǎn)企業(yè)共55批次該注射劑,基于法定檢驗(yàn)法,并結(jié)合探索性研究,以對(duì)該注射劑的質(zhì)量予以分析,并提出質(zhì)量控制建議。
1 樣本情況
55批次該注射劑樣品涉及企業(yè)13家,涉及省市自治區(qū)達(dá)21個(gè),批準(zhǔn)文號(hào)達(dá)16個(gè)。在13家生產(chǎn)企業(yè)中,10家是注射用無(wú)菌粉末,3家是注射液。其中,2家為大輸液,1家為小水針。在樣本抽樣的過(guò)程中,經(jīng)營(yíng)性與醫(yī)療機(jī)構(gòu)抽樣批次為35批次,生產(chǎn)企業(yè)批次為20批次。抽樣樣品確認(rèn)率為100.00%,均標(biāo)示企業(yè)產(chǎn)品。
2 標(biāo)準(zhǔn)檢驗(yàn)及標(biāo)準(zhǔn)評(píng)價(jià)
2.1 標(biāo)準(zhǔn)檢驗(yàn)
在對(duì)抽樣樣品進(jìn)行檢驗(yàn)的過(guò)程中,對(duì)于注射用的無(wú)菌粉末主要是按照以下標(biāo)準(zhǔn)予以檢測(cè),即《中國(guó)藥典》或企業(yè)注冊(cè)標(biāo)準(zhǔn)。而對(duì)于注射液的檢驗(yàn)標(biāo)準(zhǔn),其則主要以國(guó)家藥品注冊(cè)標(biāo)準(zhǔn)為依據(jù)。在對(duì)55批次的抽樣樣品進(jìn)行檢測(cè)時(shí),鑒于生產(chǎn)企業(yè)的不同,因此共依據(jù)10個(gè)不同的標(biāo)準(zhǔn)展開檢驗(yàn)。經(jīng)法定檢驗(yàn),結(jié)果顯示,其合格率為100.00%。
2.2 標(biāo)準(zhǔn)評(píng)價(jià)
對(duì)于注射用無(wú)菌粉末,其以《中國(guó)藥典》或企業(yè)注冊(cè)標(biāo)準(zhǔn)為依據(jù)進(jìn)行標(biāo)準(zhǔn)評(píng)價(jià)。盡管各評(píng)價(jià)標(biāo)準(zhǔn)在項(xiàng)目設(shè)置上基本一致,但執(zhí)行依據(jù)尚不統(tǒng)一且不明確,且部分項(xiàng)目方法和限度也存在差異。例如,酸度、溶液澄清度與顏色因方法濃度的不同,其致使限度制定不一致。在雜質(zhì)檢查時(shí),采用3~4個(gè)高效液相色譜(high performance liquid chromatography,HPLC)法,但對(duì)于已知雜質(zhì)和未知雜質(zhì)的限度、結(jié)果計(jì)算方式也是不統(tǒng)一的。
對(duì)于注射液,其采用的標(biāo)準(zhǔn)也較為滯后,現(xiàn)行的檢測(cè)方法均采用1個(gè)HPLC法,其不僅具有較差的專屬性,而且在色譜條件方面也較為簡(jiǎn)單。與此同時(shí),其僅要求總雜質(zhì)的限度,對(duì)于已知雜質(zhì)和未知雜質(zhì)均不明確。因此,在檢測(cè)時(shí),該方法是難以完全將各個(gè)雜質(zhì)檢出的,并且未能控制已經(jīng)明確藥理毒性的已知雜質(zhì),大輸液未控制摩爾滲透壓濃度。
3 探索性研究
3.1 注射液的有關(guān)物質(zhì)
盡管該注射劑在我國(guó)已上市多年,但其作為鉑的配位化合物,其在穩(wěn)定性方面還比較差。同時(shí),其對(duì)于溫度、酸堿度、氧化劑、鹽以及金屬離子等比較敏感。因此,對(duì)于該注射劑的重點(diǎn)關(guān)注內(nèi)容應(yīng)是其穩(wěn)定性、影響因素以及質(zhì)量控制方法。基于現(xiàn)行標(biāo)準(zhǔn)檢驗(yàn)結(jié)果,并圍繞藥品安全性和有效性等展開了探索性研究。
其中,經(jīng)對(duì)比分析《中國(guó)藥典》中注射用無(wú)菌粉末雜質(zhì)檢驗(yàn)法與美國(guó)藥典USP37-NF32注射液雜質(zhì)檢驗(yàn)法,以《中國(guó)藥典》雜質(zhì)檢查中的3個(gè)HPLC為依據(jù),建立了強(qiáng)專屬性的注射液雜質(zhì)檢驗(yàn)法。經(jīng)研究顯示,該檢驗(yàn)方法可以有效檢出奧沙利鉑需要重點(diǎn)控制的草酸、雜質(zhì)及其他雜質(zhì),并且雜質(zhì)檢出數(shù)和檢出量均明顯增加。
3.2 雜質(zhì)譜的相關(guān)研究
經(jīng)雜質(zhì)譜研究顯示,奧沙利鉑共檢出已知雜質(zhì)5種,如表1所示。為探究此類注射劑之間的差異,對(duì)注射劑的雜質(zhì)譜、雜質(zhì)來(lái)源等進(jìn)行歸屬,并經(jīng)統(tǒng)計(jì)學(xué)分析,以對(duì)所選生產(chǎn)企業(yè)的情況進(jìn)行了解和掌握。55批次該注射劑雜質(zhì)檢驗(yàn)結(jié)果,如表1所示。

表1 奧沙利鉑雜質(zhì)譜情況
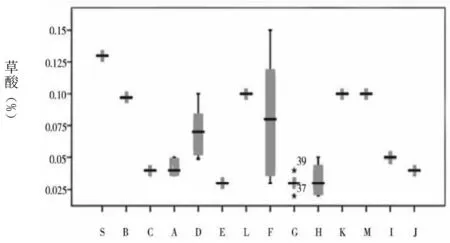
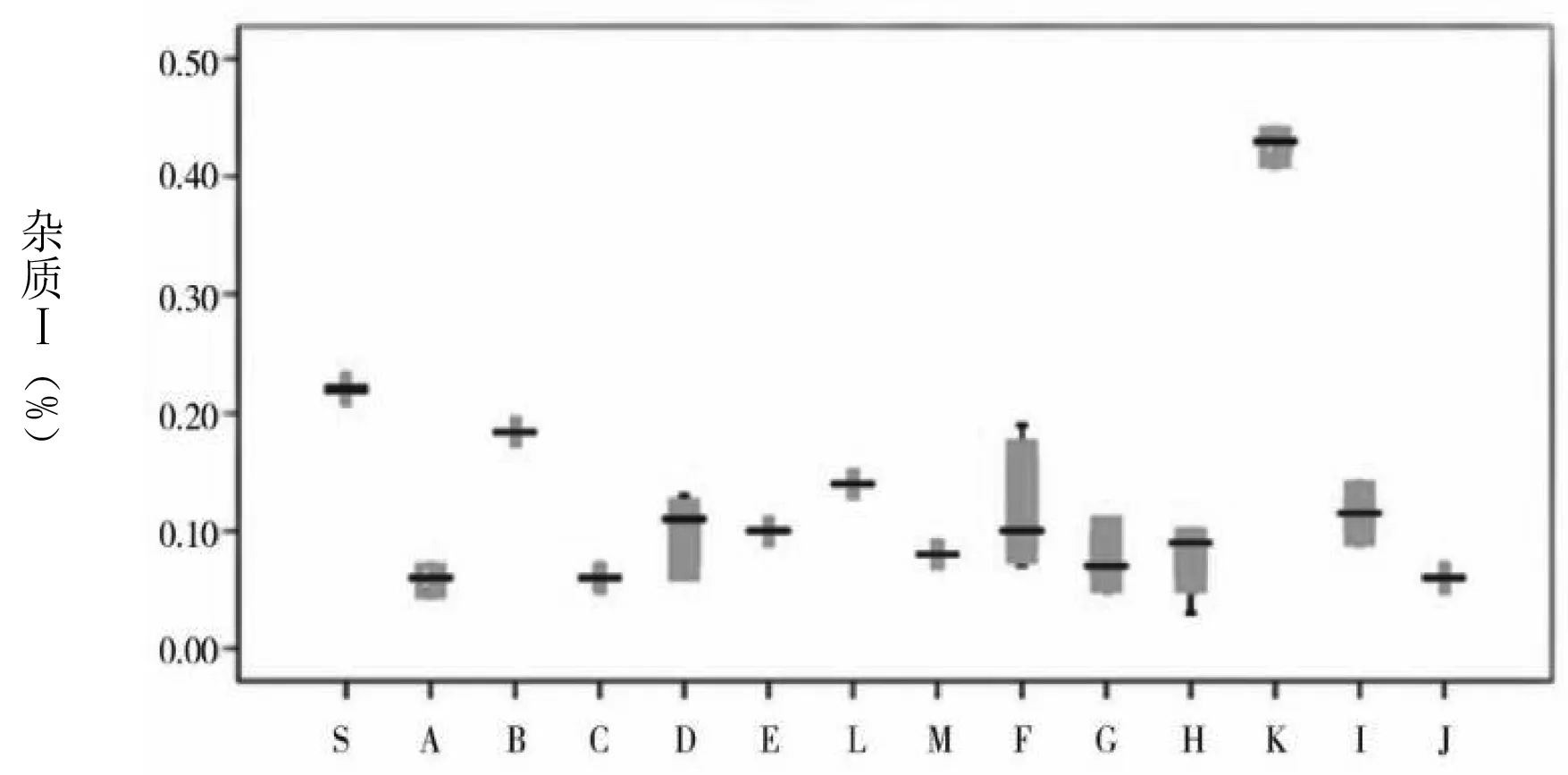

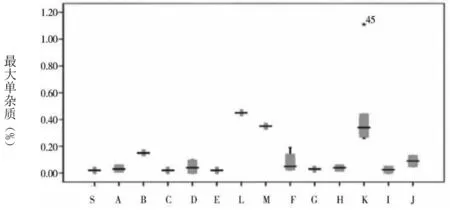

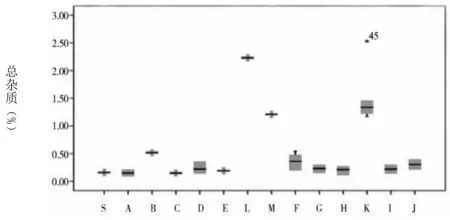
圖1 各雜質(zhì)及企業(yè)情況
通過(guò)圖1可知,草酸的含量最大值和均值分別為0.15%、0.08%。注射用和注射液中的草酸含量均處于較低水平,且三者之間不存在統(tǒng)計(jì)學(xué)差異。雜質(zhì)Ⅰ含量的均值為0.15%。其中,注射用、小水針、大輸液的均值分別為0.09%、0.10%、0.45%。經(jīng)統(tǒng)計(jì)學(xué)分析顯示,相比于注射用和大輸液含量,小水針含雜質(zhì)Ⅰ的量更高,且存在統(tǒng)計(jì)學(xué)差異。雜質(zhì)Ⅱ僅在K企業(yè)中檢出,其均值為0.02%,屬于小水針。雜質(zhì)Ⅲ最大值及均值分別為0.73%、0.05%。注射用、小水針、大輸液的均值分別為0.03%、0.06%、0.65%。在統(tǒng)計(jì)學(xué)分析下,顯示相比于注射用和小水針含雜質(zhì)Ⅲ的含量,大輸液含該雜質(zhì)的含量更高,且均存在統(tǒng)計(jì)學(xué)差異。左旋異構(gòu)體中僅在C企業(yè)和K企業(yè)中檢出,含量分別為0.01%、0.04%。其中,C企業(yè)屬于注射用。注射用最大單雜質(zhì)均值為0.05%,其他雜質(zhì)均值為0.08%,總雜質(zhì)均值為0.27%。B企業(yè)注射用劑型中總雜質(zhì)含量為0.51%,F(xiàn)企業(yè)含量為0.36%,均較其他企業(yè)高。小水針、大輸液的總雜質(zhì)含量則均較注射用高。其中,K企業(yè),即小水針,其對(duì)應(yīng)的上述3個(gè)指標(biāo)分別為0.45%、0.83%、1.50%;大輸液對(duì)應(yīng)的指標(biāo)則為0.44%、1.25%、2.22%。經(jīng)統(tǒng)計(jì)學(xué)分析表明,與注射液相比,注射用更佳。
3.3 大輸液滅菌工藝考察
利用擬定的雜質(zhì)檢驗(yàn)方法,在115℃下進(jìn)行滅菌,時(shí)間為30min,對(duì)各雜質(zhì)及其含量的變化情況展開觀察。經(jīng)分析顯示,相比于滅菌前,滅菌后樣品雜質(zhì)Ⅰ的含量未發(fā)生變化,但草酸、雜質(zhì)Ⅲ、最大單雜質(zhì)、其他雜質(zhì)總和則分別增加0.25%、0.20%、0.26%、0.49%。奧沙利鉑的含量下降1.19%。也就是說(shuō),滅菌工藝會(huì)對(duì)該注射液的穩(wěn)定性產(chǎn)生影響。
3.4 大輸液質(zhì)量影響因素試驗(yàn)
在影響因素分析的過(guò)程中,對(duì)常溫狀態(tài)下、高溫狀態(tài)下大輸液雜質(zhì)及其含量的變化情況展開了分析。在第1天、第5天以及第10天進(jìn)行取樣檢測(cè),表明伴隨時(shí)間的延長(zhǎng),雜質(zhì)Ⅲ、最大單雜質(zhì)、其他雜質(zhì)總和中雜質(zhì)含量的趨勢(shì)是上升的。相比于常溫狀態(tài)下,在高溫狀態(tài)下,即當(dāng)溫度為(40±2)℃時(shí),雜質(zhì)增加幅度更高。也就是說(shuō),貯藏時(shí)間、溫度會(huì)對(duì)其穩(wěn)定性產(chǎn)生影響。
3.5 包材中金屬離子遷移試驗(yàn)
包裝材料中的金屬離子遷移也會(huì)影響該注射劑的含量,且會(huì)將其他雜質(zhì)的含量增加[7]。利用電感耦合等離子體質(zhì)譜檢測(cè)包材中的金屬離子含量,結(jié)果顯示,Li、Mg及AL等金屬元素的檢出量均處于較低水平。也就是說(shuō),包材金屬離子對(duì)于該注射劑的影響是比較小的。
3.6 探索性研究結(jié)果
經(jīng)探索性研究,結(jié)果顯示,相比于注射用,注射液中雜質(zhì)檢出量更高,其原因主要在于奧沙利鉑的水溶液不穩(wěn)定。小水針中則缺乏穩(wěn)定劑,從而影響其穩(wěn)定性。大輸液在115℃下,其穩(wěn)定性會(huì)受到貯藏時(shí)間、溫度以及滅菌方式的影響。因此,對(duì)于該注射劑進(jìn)行質(zhì)量管控時(shí),應(yīng)注重貯藏條件和生產(chǎn)工藝的管控。
4 奧沙利鉑注射劑總體質(zhì)量評(píng)價(jià)及建議
經(jīng)對(duì)抽檢的55批次樣品予以綜合研究,顯示奧沙順鉑總體質(zhì)量為“較好”,而該注射劑總體質(zhì)量則為“一般”,尤其是小水針和大輸液。因此,為確保該注射劑質(zhì)量,從評(píng)價(jià)標(biāo)準(zhǔn)方面來(lái)說(shuō),應(yīng)對(duì)小水針、大輸液的評(píng)價(jià)標(biāo)準(zhǔn)進(jìn)行修訂,如增加相關(guān)檢查和滲透壓控制項(xiàng)等。而對(duì)于注射用無(wú)菌粉末的評(píng)價(jià)標(biāo)準(zhǔn),則應(yīng)注重統(tǒng)一化,并對(duì)執(zhí)行方式予以明確。從生產(chǎn)企業(yè)的角度來(lái)說(shuō),應(yīng)注重加強(qiáng)生產(chǎn)安全過(guò)程中的風(fēng)險(xiǎn)管控,并對(duì)可能影響該注射劑穩(wěn)定性的因素予以合理控制。同時(shí)還應(yīng)對(duì)產(chǎn)品的說(shuō)明書等予以嚴(yán)格規(guī)范,如標(biāo)明貯藏條件等,以確保質(zhì)量。

