lncRNA SNHG3 靶向調控miR-514a-5p對骨肉瘤細胞增殖、凋亡、遷移和侵襲的影響
譚曉謙 梅海波 伍江雁 嚴 安
湖南省兒童醫院骨科,湖南長沙 410007
骨肉瘤是骨腫瘤中常見的一種惡性腫瘤,具有侵襲性極高、惡性程度高、預后不良等特點,超過15%的患者在確診時已經發現有遠處轉移[1-3]。骨肉瘤的治療主要以手術切除和手術期化療為主,其中未發生遠處轉移的骨肉瘤患者的5 年生存率高達70%,但是轉移性和復發性骨肉瘤患者的5 年生存率低于20%[4-5]。近年研究結果顯示,長鏈非編碼RNA 在骨肉瘤中通過參與細胞分化、細胞增殖、細胞凋亡和轉移等生物學過程,發揮著重要的作用[6-8]。核仁小分子RNA 宿主基因3(small nucleolar RNA host gene 3,SNHG3)位于人染色體1p35.3 位置上,在多種腫瘤中異常表達。研究發現SNHG3 在骨肉瘤組織中高表達,與不良預后顯著相關;SNHG3 靶向作用miRNA-151a-3p 上調AB22A 表達促進骨肉瘤細胞的侵襲和遷移[9]。微小RNA(microRNA,miRNA)在多種腫瘤中起到抑癌或促癌的作用,miR-514a-5p 在多種癌細胞中表達下調,但miR-514a-5p 在骨肉瘤的作用機制尚不明確。因此,本研究探討SNHG3 通過靶向調控miR-514a-5p對骨肉瘤細胞增殖、侵襲、遷移的作用,為骨肉瘤疾病的診斷、治療提供參考。
1 材料與方法
1.1 細胞與主要試劑
成骨細胞hFOB1.19 和骨肉瘤細胞SW-1353、HOS、U-2OS、Saos-2 購于中國科學院上海細胞庫;胎牛血清(9735212)、DMEM 培養基(91249142)購于美國Gibco 公司;si-NC、si-SNHG3、miR-NC、miR-514a-5p、anti-miR-NC 和anti-miR-514a-5p 購于廣州瑞博生物公司;引物由上海吉瑪公司設計合成;LipofectamineTM2000 轉染試劑盒(10652-011)、Trizol 試劑盒(10153-023)購于美國Invitrogen 公司;熒光定量試劑盒(RR246B)、反轉錄試劑盒(452237152)購于大連Takara 公司;CCK-8 試劑盒(32021)購于日本同仁公司;凋亡試劑盒(C0948)購于碧云天生物研究所;c-Myc 抗體(3097T)、Bax 抗體(0265T)、MMP-2 抗體(4026T)購于美國CST 公司;Transwell 小室(3564314 13324)購于美國Corning 公司;Matrigel 基質膠(3124523)購于美國BD 公司;雙熒光素酶試劑盒(D0132)購于北京索萊寶公司。
1.2 細胞培養與轉染
將成骨細胞hFOB1.19 和骨肉瘤細胞SW-1353、HOS、U-2OS、Saos-2 常規復蘇后,進行細胞培養,置于含10%胎牛血清的DMEM 培養基,在37℃、5%CO2中培養。細胞的密度融合至75%~85%時,加入胰蛋白酶消化。
取對數生長期的U-2OS 細胞,根據LipofectamineTM2000 轉染試劑盒說明書進行轉染,將其分為si-NC 組(轉染si-NC)、si-SNHG3 組(轉染si-SNHG3)、miR-NC 組(轉染miR-NC)、miR-514a-5p 組(轉染miR-514a-5p)、si-SNHG3+anti-miR-NC 組(共轉染si-SNHG3和anti-miR-NC)和si-SNHG3+anti-miR-514a-5p 組(共轉染si-SNHG3 和anti-miR-514a-5p)。
1.3 qRT-PCR 檢測細胞中SNHG3 和miR-514a-5p表達
使用Trizol 試劑盒提取各組細胞的總RNA,在紫外分光光度計檢測RNA 濃度和純度。按照反轉錄試劑盒反轉錄合成cDNA,以cDNA 為模板,通過熒光定量試劑盒進行PCR 擴增。反應條件為95℃預變性2 min;95℃變性30 s,60℃退火30 s,72℃延伸30 s,共40 個循環。分別以GAPDH 和U6 為內參,通過2-△△Ct法計算SNHG3 和miR-514a-5p 的表達。SNHG3 正向引物:5’-GACTTCCGGGCACTTCGTAA-3’,反向引物:5’-TGCTCCAAGTCTGCCAAAGA-3’;GAPDH 正向引物:5’-AATGGGCAGCCGTTAGGAAA-3’,反向引物:5’-GCGCCCAATACGACCAAATC-3’。miR-514a-5p正向引物:5'-TCACTACTCTGGAGAGTGACAAT-3’,反向引物:5’-GTGCAGGGTCCGAGGT-3’;U6 正向引物:5’-TGCGGGTGCTCGCTTCGGCAGC-3’,反向引物:5’-CCAGTGCAGGGTCCGAGGT-3’。
1.4 CCK-8 法檢測細胞活力
離心后收集沉淀的細胞,加入磷酸鹽緩沖液制備細胞懸液,接種于96 孔板中,培養48 h 后,在每孔內加入10 μL CCK-8 溶液,繼續培養2 h,使用酶標儀及在450 nm 波長處測量吸光值。細胞活力=實驗組吸光度值/空白對照吸光度值×100%。
1.5 流式細胞術檢測細胞凋亡
取各組離心后收集的細胞,加入500 μL 結合緩沖液,通過凋亡試劑盒說明書,分別加入5 μL Annexin-V FITC 和PI 溶液,避光反應20 min,在流式細胞儀上檢測細胞凋亡率。
1.6 Western blot 檢測c-Myc、Bax 和MMP-2 蛋白表達
采用BCA 法檢測定量蛋白,同時取45 μg 的蛋白樣品在聚丙烯酰胺凝膠電泳處理后,轉膜,封閉,加入相應的一抗,過夜孵育,次日加入二抗,孵育2 h 后行顯影處理(化學發光液),GAPDH 作為內參,采用Image J 對蛋白條帶的灰度值進行分析,計算蛋白表達。
1.7 Transwell 小室檢測細胞遷移和侵襲
1.7.1 遷移實驗 取各組細胞加入不含胎牛血清的DMEM 培養基內,稀釋細胞濃度為2×105個/mL。在Transwell 小室上層加入100 μL 細胞懸液,下層加入500 μL 含10 %胎牛血清的DMEM 培養基,培養24 h,從培養箱中取出小室,使用棉簽輕輕擦拭上層細胞,加入甲醇固定30 min,結晶紫染色10 min,顯微鏡下選擇3 個視野拍照,觀察細胞數目,計數取平均值。
1.7.2 侵襲實驗 在Transwell 小室上層鋪稀釋Matrigel基質膠,烘干后,其余步驟同“1.7.1”項下。
1.8 雙熒光素酶驗證SNHG3 與miR-514a-5p 關系
Starbase 在線數據庫顯示SNHG3 和miR-514a-5p 存在結合位點。構建SNHG3 野生型(SNHG3 wild type,SNHG3-WT)和SNHG3 突變型(SNHG3 mutant,SNHG3-MUT)雙熒光素酶報告載體,分別轉染miRNC 和miR-514a-5p 至U-2OS 細胞。轉染48 h,采用雙熒光素酶試劑盒檢測熒光素酶活性。
1.9 統計學方法
采用SPSS 22.0 統計學軟件進行數據分析,計量資料用均數±標準差()表示,多組間比較采用單因素方差分析,組間兩兩比較采用LSD-t 檢驗;兩組間比較采用t 檢驗。以P <0.05 為差異有統計學意義。
2 結果
2.1 SNHG3 和miR-514a-5p 在不同細胞中的表達水平比較
骨肉瘤細胞SW-1353、HOS、U-2OS、Saos-2 中SNHG3 表達高于成骨細胞hFOB1.19,miR-514a-5p表達低于成骨細胞hFOB1.19,差異有統計學意義(P <0.05)。見表1。
表1 SNHG3 和miR-514a-5p 在不同細胞中的表達水平比較(,n=9)
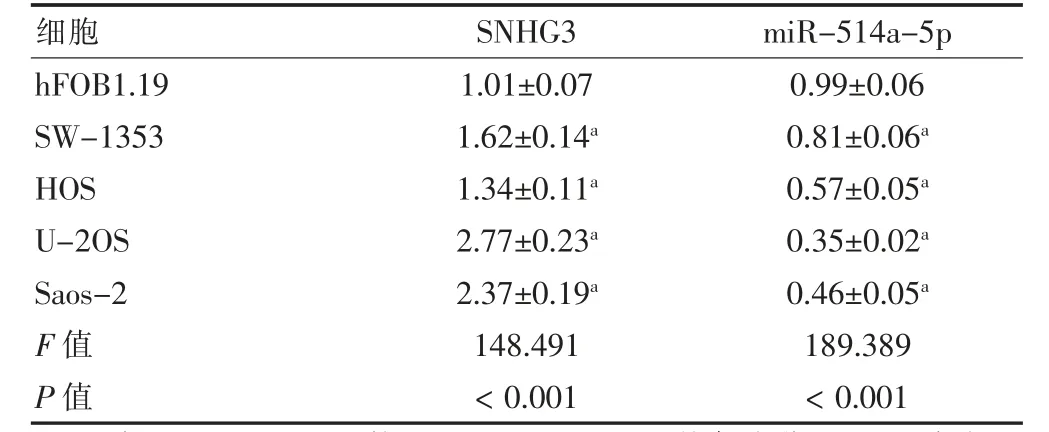
表1 SNHG3 和miR-514a-5p 在不同細胞中的表達水平比較(,n=9)
注:與hFOB1.19 組比較,aP <0.05。SNHG3:核仁小分子RNA 宿主基因3
2.2 敲低SNHG3 后U-2OS 細胞增殖、凋亡及c-Myc、Bax 蛋白表達比較
si-SNHG3 組的SNHG3 表達、細胞活力、c-Myc蛋白表達低于si-NC 組,細胞凋亡率、Bax 蛋白高于si-NC 組,差異有統計學意義(P<0.05)。見圖1、表2。
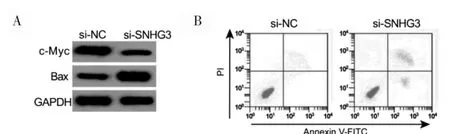
圖1 敲低SNHG3 后U-2OS 細胞凋亡及c-Myc、Bax 蛋白表達比較
表2 敲低SNHG3 后U-2OS 細胞增殖、凋亡及c-Myc、Bax 蛋白表達比較(,n=9)
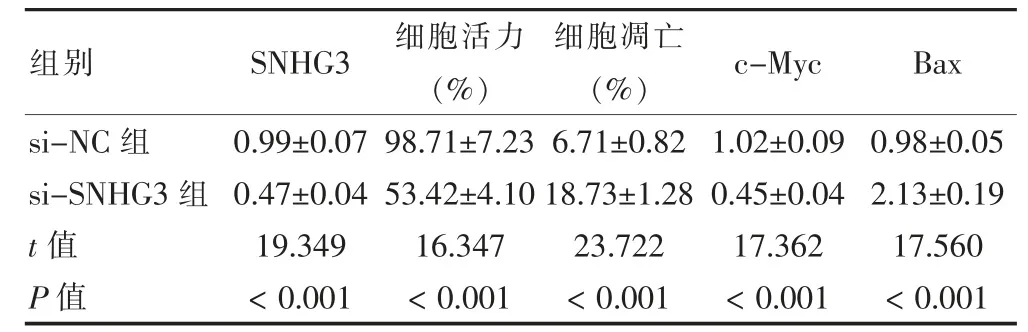
表2 敲低SNHG3 后U-2OS 細胞增殖、凋亡及c-Myc、Bax 蛋白表達比較(,n=9)
注:SNHG3:核仁小分子RNA 宿主基因3
2.3 敲低SNHG3 后U-2OS 細胞遷移和侵襲及MMP-2 蛋白表達比較
si-SNHG3 組遷移細胞、侵襲細胞和MMP-2 蛋白表達低于si-NC 組,差異有統計學意義(P <0.05)。見圖2、表3。
表3 敲低SNHG3 后U-2OS 細胞遷移和侵襲及MMP-2 蛋白表達比較(,n=9)
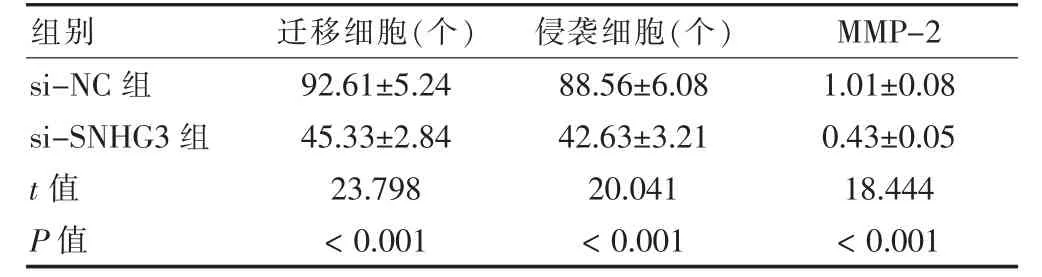
表3 敲低SNHG3 后U-2OS 細胞遷移和侵襲及MMP-2 蛋白表達比較(,n=9)
注:SNHG3:核仁小分子RNA 宿主基因3
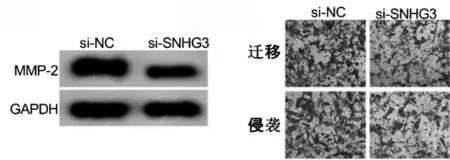
圖2 敲低SNHG3 后U-2OS 細胞遷移和侵襲及MMP-2 蛋白表達比較
2.4 雙熒光素酶驗證結果
SNHG3 與miR-514a-5p 存在互補的結合位點,見圖3。miR-514a-5p 組SNHG3-WT 熒光素酶活性低于miR-NC 組,差異有統計學意義(P <0.05);miR-514a-5p 組與miR-NC 組SNHG3-MUT 熒光素酶比較,差異無統計學意義(P >0.05)。見表4。
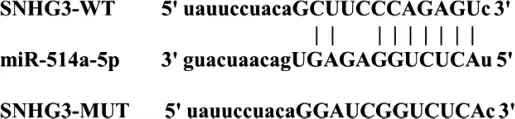
圖3 SNHG3 和miR-514a-5p 結合位點
表4 雙熒光素酶驗證結果(,n=9)
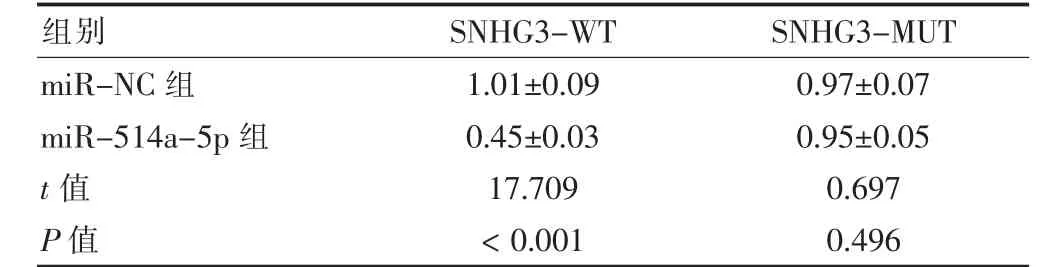
表4 雙熒光素酶驗證結果(,n=9)
注:SNHG3-WT:SNHG3 野生型;SNHG3-MUT:SNHG3 突變型;SNHG3:核仁小分子RNA 宿主基因3
2.5 過表達miR-514a-5p 后U-2OS 細胞增殖、凋亡、遷移、侵襲及c-Myc、Bax 和MMP-2 蛋白表達比較
miR-514a-5p 組miR-514a-5p 表達、細胞凋亡率、Bax 蛋白表達高于miR-NC 組;細胞活力、遷移細胞、侵襲細胞、c-Myc 和MMP-2 蛋白表達低于miRNC 組,差異有統計學意義(P <0.05)。見圖4、表5。
表5 過表達miR-514a-5p 后U-2OS 細胞增殖、凋亡、遷移、侵襲及c-Myc、Bax 和MMP-2 蛋白表達比較(,n=9)
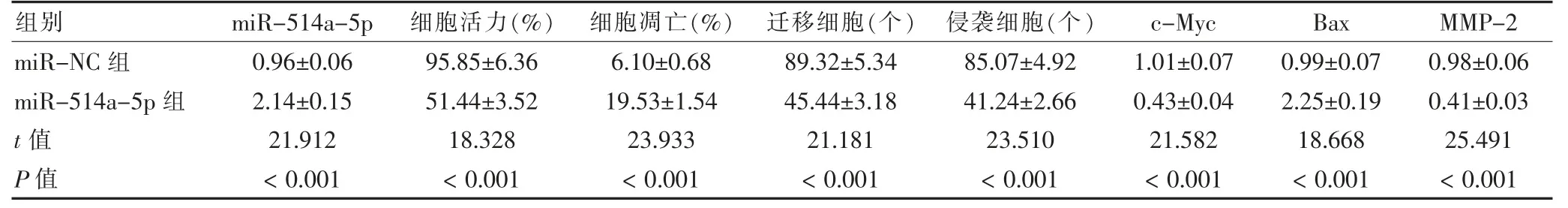
表5 過表達miR-514a-5p 后U-2OS 細胞增殖、凋亡、遷移、侵襲及c-Myc、Bax 和MMP-2 蛋白表達比較(,n=9)
注:SNHG3:核仁小分子RNA 宿主基因3
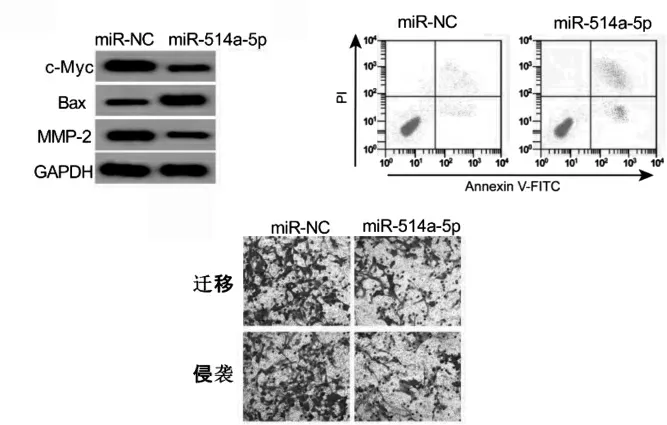
圖4 過表達miR-514a-5p 對U-2OS 細胞增殖、凋亡、遷移和侵襲的影響
2.6 抑制miR-514a-5p 后敲低SNHG3 對U-2OS 細胞增殖、凋亡、遷移、侵襲及c-Myc、Bax 和MMP-2蛋白表達比較
si-SNHG3+anti-miR-514a-5p 組的miR-514a-5p 表達、細胞凋亡率、Bax 蛋白表達低于si-SNHG3+anti-miR-NC 組;細胞活力、遷移細胞、侵襲細胞、c-Myc 和MMP-2 蛋白表達高于si-SNHG3+antimiR-NC 組,差異有統計學意義(P <0.05)。見圖5、表6。
表6 抑制miR-514a-5p 后敲低SNHG3 對U-2OS 細胞增殖、凋亡、遷移、侵襲及c-Myc、Bax 和MMP-2 蛋白表達比較(,n=9)
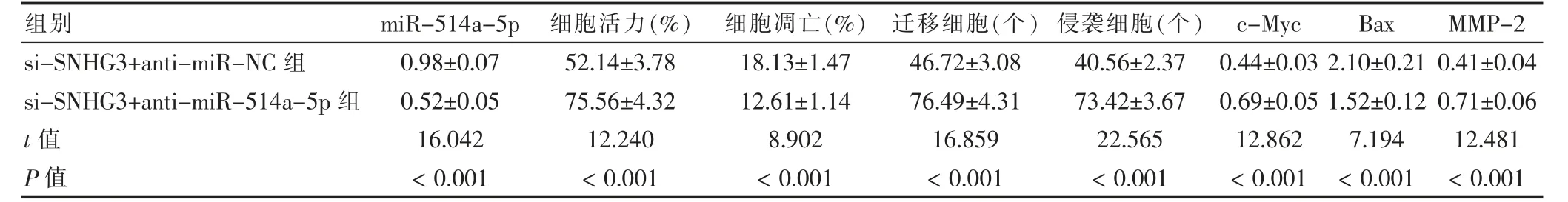
表6 抑制miR-514a-5p 后敲低SNHG3 對U-2OS 細胞增殖、凋亡、遷移、侵襲及c-Myc、Bax 和MMP-2 蛋白表達比較(,n=9)
注:SNHG3:核仁小分子RNA 宿主基因3
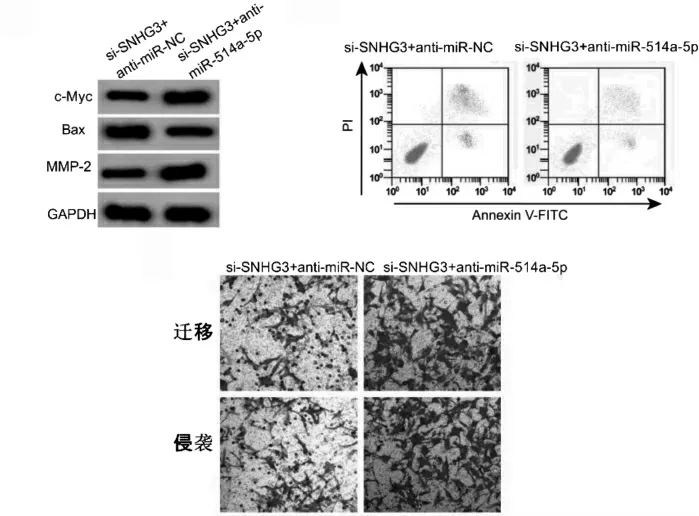
圖5 抑制miR-514a-5p 后敲低SNHG3 對U-2OS 細胞增殖、凋亡、遷移和侵襲的影響
3 討論
隨著醫學治療水平的進步,新的輔助治療骨肉瘤方法已經取得了明顯的作用效果,但是仍會出現復發、轉移等不良后果[11-12]。LncRNA 是一種非編碼RNA分子自身沒有編碼蛋白質的功能,但是可以通過轉錄或轉錄后調控基因的表達[13-14]。Ju 等[15]研究結果顯示,SNHG5 在骨肉瘤細胞中表達上調,抑制SNHG5 表達,可以明顯抑制骨肉瘤細胞的增殖、遷移和侵襲。Xu 等[16]研究結果顯示,SNHG4 在骨肉瘤組織和細胞中表達上調,其高表達與腫瘤大小和預后不良有關,SNHG4 可以海綿化miR-224-3p 調節骨肉瘤細胞的增殖和轉移。Chen 等[17]研究結果顯示,SNHG3 在骨肉瘤組織中表達上調,與患者預后和腫瘤大小有關,抑制SNHG3表達,可以明顯抑制骨肉瘤細胞的增殖,與本研究結果相似。本研究結果顯示,在骨肉瘤細胞中SNHG3 表達上調,敲低SNHG3 可以抑制U-2OS 細胞增殖、遷移和侵襲,并誘導細胞凋亡,提示SNHG3 可以作為骨肉瘤潛在生物標志物。
miRNA 是一種具有高度保守的非編碼RNA 分子,可以通過調控靶向mRNA 表達參與腫瘤細胞增殖、凋亡、遷移和侵襲等生物學過程[18-19]。miRNA 在骨肉瘤細胞中起著抑癌或促癌的作用,其中miR-1284、miRNA-206、miR-493-5p、miR-501-3p 和miR-502-5p 等已證實[20-21]。miRNA-708 在骨肉瘤細胞中表達下調,miRNA-708 通過CUL4B 調節骨肉瘤細胞的增殖和凋亡[22]。Wang 等[23]研究結果顯示,miR-423-5p 在骨肉瘤組織和細胞中表達下調,miR-423-5p 通過靶向STMN1 抑制骨肉瘤細胞增殖、轉移。Wu 等[24]研究結果顯示,miR-17 在骨肉瘤細胞中表達上調,miR-17可以上調SASH1 的表達,對于骨肉瘤細胞增長、遷移有一定抑制作用,同時還可以促進細胞凋亡,與本研究結果相反。miR-514a-5p 在肝癌、鼻咽癌等癌癥中表達下調[25],在腫瘤細胞中起著抑癌的作用。本研究結果顯示,在骨肉瘤細胞中miR-514a-5p 表達下調,過表達miR-514a-5p 可以抑制骨肉瘤細胞的增殖、遷移和侵襲,并誘導細胞凋亡。進一步實驗結果顯示,SNHG3 可以靶向miR-514a-5p 的表達,而抑制miR-514a-5p 逆轉了敲低SNHG3 對U-2OS 細胞的增殖、凋亡、遷移和侵襲的作用,提示敲低SNHG3 可以通過調控miR-514a-5p 發揮在骨肉瘤細胞中的作用。
綜上所述,SNHG3 在骨肉瘤細胞中表達上調,敲低SNHG3,或有效調控miR-514a-5p 表達,可以明顯抑制骨肉瘤細胞增長、遷移、侵襲作用,同時促進細胞凋亡,為骨肉瘤臨床治療提供新的作用靶點。

