氧化還原反應五規律
■侯晨鷂
一、性質強弱規律

具有較強氧化性的氧化劑跟具有較強還原性的還原劑反應,生成具有較弱還原性的還原產物和具有較弱氧化性的氧化產物。氧化性的強弱順序:氧化劑>氧化產物。還原性的強弱順序:還原劑>還原產物。
該規律常用于:①判斷物質氧化性或還原性的相對強弱;②判斷某氧化還原反應能否正常發生。
例1根據反應式:①2Fe3++2I-2Fe2++I2,②Br2+2Fe2+2Br-+2Fe3+,可判斷出離子的還原性從強到弱的順序是( )。
A.Br-、Fe2+、I-B.I-、Fe2+、Br-
C.Br-、I-、Fe2+D.Fe2+、I-、Br-
解析
反應①中還原劑是I-,還原產物是Fe2+,故還原性I->Fe2+;反應②中還原劑是Fe2+,還原產物是Br-,故還原性Fe2+>Br-。綜合起來可知還原性I->Fe2+>Br-。
答案:B
二、電子守恒規律
氧化還原反應中得電子總數與失電子總數相等(即電子轉移守恒)。表現在氧化還原反應中,氧化劑元素化合價降低總數與還原劑元素化合價升高總數相等。
該規律常用于:①氧化還原反應方程式的配平;②氧化還原反應的相關計算。
例2足量銅與一定量濃硝酸反應,得到硝酸銅溶液和NO2、N2O4、NO 的混合氣體,將這些氣體與1.68LO2(標準狀況)混合后通入水中,所有氣體完全被水吸收生成硝酸。若向所得硝酸銅溶液中加入5mol·L-1NaOH 溶液至Cu2+恰好完全沉淀,則消耗NaOH 溶液的體積是( )。
A.60mL B.45mL
C.30mL D.15mL
解析
由題意可知,Cu 足量則HNO3完全反應,反應中Cu 失去的電子給了 HNO3,生成了還原產物(NO2、N2O4、NO),但最終這些還原產物(NO2、N2O4、NO)又被氧化為HNO3,即相當于Cu失去的電子最終給了O2,且Cu失去的電子數與O2得到的電子數相等。故n(Cu)=2(O2)=2 ×=0.15mol。又根據NaOH 和Cu(NO3)2的反應可得關系式n(NaOH)=2n[Cu(NO3)2]=2n(Cu)=0.3mol,則V(NaOH)==0.06L=60mL。
答案:A
三、價態性質規律
根據元素的價態可以判斷物質的氧化性、還原性。例如N 元素:在中只有還原性,在中只有氧化性,在中既有氧化性又有還原性。同種元素具有多種價態時,處于最低價時只有還原性,處于最高價時只有氧化性,處于中間可變價時既有氧化性又有還原性,總結為“高價氧化,低價還,中間價態兩邊轉”。另外注意元素處于最低價時只有還原性,但還原性不一定強,如F-的還原性極弱;元素處于最高價時只有氧化性,但氧化性不一定強,如Na+的氧化性極弱。
該規律常用于判斷所給微粒的性質及其在氧化還原反應中所對應的可能產物。
例3下列物質中,按只有氧化性、只有還原性、既有氧化性又有還原性的順序排列的一組是( )。
A.F2、K、HCl B.Cl2、Al、H2
C.NO2、Na、Br2D.O2、SO2、H2O
解析
F 元素沒有正價,所以F2只有氧化性,金屬元素沒有負價,所以金屬單質(K、Al)只有還原性;HCl中只有氧化性,只有還原性,所以HCl既有氧化性又有還原性;H2O 中只有氧化性,只有還原性,所以H2O 既有氧化性又有還原性;NO2中和SO2中處于中間價態,既可以得到電子表現氧化性,又可以失去電子表現還原性;H2中、Cl2中和Br2中均處于中間價態,既可以得到電子表現氧化性,又可以失去電子表現還原性。
答案:A
四、價態轉化規律
含同種元素不同價態的物質間發生氧化還原反應時,該元素價態的變化基本都遵循“高價+低價→中間價”的規律。這里的中間價可以相同(謂之“靠攏”),也可以不同——但此時必是高價轉變成較高中間價,低價轉變成較低中間價(謂之“不交叉”),總結為“價態相鄰能共存,價態相間能歸中;歸中價態不交錯,低升高降只靠攏”。另外注意同種元素相鄰價態間不發生氧化還原反應。
該規律常用于:①判斷同種元素不同價態的物質間發生氧化還原反應的可能性;②根據化合價及性質判斷某反應體系中的氧化劑、還原劑、氧化產物及還原產物。
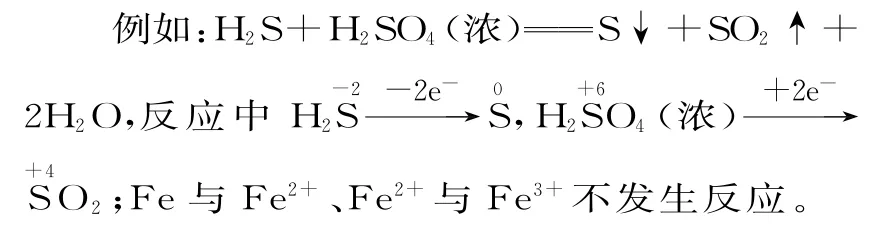
例4下列關于反應HCl+KClO3KCl+Cl2↑+H2O(未配平)的說法正確的是( )。
A.反應中每生成1 molCl2轉移電子6mol
B.Cl2是氧化產物,KCl是還原產物
C.氧化劑和還原劑的物質的量之比為1∶5
D.方程式配平的系數分別為5、1、1、3、3
解析
解本題的關鍵是找準氧化劑和還原劑、氧化產物和還原產物,根據價態轉化規律可知KClO3是氧化劑,HCl是還原劑,Cl2既是氧化產物又是還原產物,KCl不是還原產物,B 項錯;每生成3molCl2轉移電子5mol,A 項錯;方程式配平的系數分別為6、1、1、3、3,D 項錯。由,根據得失電子守恒可知氧化劑和還原劑的物質的量之比為1∶5,C項正確。
答案:C
五、強先弱后規律
在濃度相差不大的溶液中,同時含有幾種還原劑時,若加入氧化劑,則它優先與溶液中還原性最強的還原劑作用,如Cl2與FeBr2溶液的反應先考慮Cl2氧化Fe2+,再考慮Cl2氧化Br-;Cl2與FeI2溶液的反應先考慮Cl2氧化I-,再考慮Cl2氧化Fe2+;同理,同時含有幾種氧化劑時,若加入還原劑,則它優先與溶液中氧化性最強的氧化劑作用,如在含有Fe3+、Cu2+、H+的溶液中加入鐵粉,因為氧化性Fe3+>Cu2+>H+,所以鐵粉先與Fe3+反應,然后依次與Cu2+、H+反應。
該規律常用于判斷微粒發生氧化還原反應的先后順序和判斷離子方程式書寫的正誤。
例5向含有FeBr2、FeI2的溶液中緩緩通入一定量的氯氣后,再向溶液中滴加KSCN 溶液,溶液變為紅色,若只從反應順序角度考慮反應情況,則下列敘述不正確的是( )。
A.通入氯氣后的溶液中一定不存在I
B.通入氯氣之后原溶液中的Fe2+全部被氧化
C.原溶液中的Br-可能被氧化
D.若取少量所得溶液,再加入CCl4溶液充分振蕩、靜置、分液,下層溶液呈紫紅色
解析
溶液中離子的還原性強弱順序為I->Fe2+>Br-。溶液變為紅色說明Fe2+被氧化成Fe3+,則I-全部被氧化,故溶液中一定不存在I-,A 項正確;Fe2+可能全部被氧化,也可能是部分氧化,B項錯誤;溶液變為紅色只能說明Fe2+被氧化成Fe3+,而Br-可能被氧化,C 項正確;根據題意知有I2生成,I2易溶于有機溶劑,則下層溶液呈紫紅色,D 項正確。
答案:B
感悟與提高
1.已知SO2、I-、Fe2+、H2O2、Cl-在酸性溶液中均有還原性,且它們的還原性依次減弱,則下列反應不能發生的是( )。
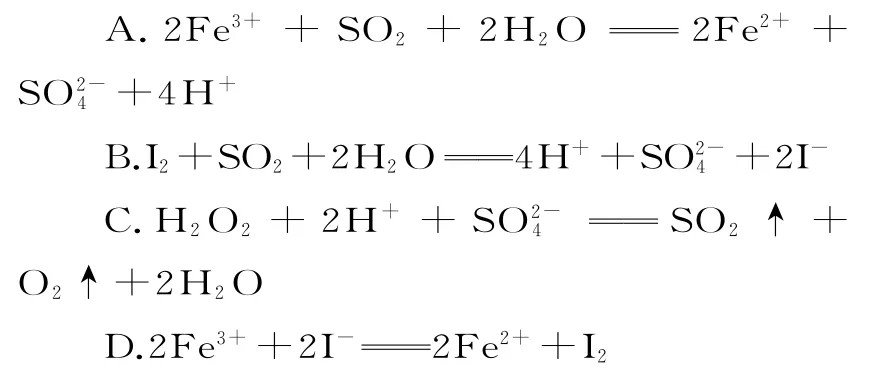
2.硫酸銨在強熱條件下分解,生成氨、二氧化硫、氮氣和水。反應中生成的氧化產物和還原產物的物質的量之比是( )。
A.1∶3 B.2∶3
C.1∶1 D.4∶3
3.工業廢水中的NaNO2可用鋁粉除去,已知此體系中包含Al、NaAlO2、NaNO2、NaOH、NH3、H2O 六種物質。該反應的化學方程式為____。
4.已知G、Q、X、Y、Z均為含氯元素的化合物,在一定條件下有下列轉化關系(未配平):

這五種化合物中Cl元素化合價由低到高的順序是( )。
A.G、Y、Q、Z、X B.X、Z、Q、G、Y
C.X、Z、Q、Y、G D.G、Q、Y、Z、X
5.今有下列三個氧化還原反應:
①2FeCl3+2KI2FeCl2+2KCl+I2
②2FeCl2+Cl22FeCl3
③2KMnO4+16HCl2KCl+2MnCl2+8H2O+5Cl2↑
若某溶液中有Fe2+、I-和Cl-共存,要氧化除去I-而又不除去Fe2+和Cl-,可加入的試劑是( )。
A.Cl2B.KMnO4
C.FeCl3D.HCl
參考答案
1.C 提示:C 項反應中氧元素的化合價升高,硫元素的化合價降低,則H2O2為還原劑,還原性強弱為H2O2>SO2,與已知的還原性強弱不一致,反應不能發生。

3.2 Al+NaNO2+NaOH+2H2O2NaAlO2+NH3·H2O 提示:分析該體系可知,只有Al和N 元素化合價發生變化,金屬鋁只有還原性,在NH3中只有還原性,且還原性Al>N,而亞硝酸鈉具有較強的氧化性,所以發生的反應是亞硝酸鈉和金屬鋁之間的反應,即2Al+NaNO2+NaOH+2H2O2NaAlO2+NH3·H2O。
4.A 提示:由①得出價態Q 高于G,因為G 必介于Q 和-1價的Cl之間,-1價為氯元素的最低價。將該結論引用到③,Y介于Q與G之間,故有價態Q高于Y,價態Y高于G。分析②:H2O中的H化合價降低,則Q 中的氯元素轉變為X 中的氯元素,化合價必升高,則得出價態X 高于Q。最后分析④:Z介于Q、X 之間,則價態X 高于Z,價態Z高于Q。

