吸入用鹽酸溴己新溶液處方及工藝研究概述
楊亞偉 陳健 李運嬋 孫樹玲 馮義


摘要:目的:通過對吸入用鹽酸溴己新溶液的處方篩選及工藝研究,制定質量穩定可靠的生產工藝。方法:以性狀、pH值、含量和有關物質為考察指標,通過影響因素實驗,比較各處方的優劣。結果:選出制備吸入用鹽酸溴己新溶液的最佳處方及工藝。結論:經過實驗,處方及工藝穩定可行。
關鍵詞:鹽酸溴己新;吸入用溶液;處方;工藝
【中圖分類號】R-09 ? ? ? ? ? ? 【文獻標識碼】A ? ? ? ? ? ? 【文章編號】2107-2306(2021)07-113-01
鹽酸溴己新可直接作用于支氣管腺體,促使粘液分泌細胞的溶酶體釋出,分化裂解痰中粘多糖纖維。還可抑制粘液腺和杯狀細胞中酸性糖蛋白的合成,使其分泌出粘滯性較低的小分子糖蛋白,降低痰液粘稠度,促進咳痰。同時還能夠刺激胃粘膜反射性地引起呼吸道腺體分泌增加,稀釋痰液[1]。臨床主要用于急性及慢性支氣管炎、肺氣腫、哮喘等危重急癥。
吸入用鹽酸溴己新溶液最早由勃林格殷格翰開發上市,1963年在西班牙上市,1991年在日本上市,商品名Bisolvon?。國內目前沒有吸入制劑上市。
1處方設計
根據原研說明書中提到處方中的輔料為羥苯甲酯和酒石酸。
1.1設計思路
鹽酸溴己新在在水中極微溶解以及羥苯甲酯的溶解性較差,配制溶液時采用80℃注射用水進行溶解。相關資料顯示鹽酸溴己新的水溶液在光照條件下不穩定,同時配制不同pH值處方(2.0,2.5,3.0,3.5,4.0,5.0),考察穩定性進而確定處方。
1.2過程及結果
鹽酸溴己新2.0g,羥苯甲酯1.0g,酒石酸1.0g,用水溶解并稀釋至1L,分別用0.1mol/L鹽酸溶液和1mol/L氫氧化鈉溶液調pH,放置影響因素[2],根據試驗結果對處方進行比較,確定處方組成。結果如下:
處方1的pH值過低,不適于臨床應用;處方5-處方6含量和有關物質較差;處方2-處方4的pH值在文獻pH范圍內,最終選定處方3為最優處方。
2工藝研究
供霧化器用的液體制劑使用依從性較好,其被動吸入特性與其他主動吸入制劑相比較,使用難度較低,患者依從度較好,更適合于兒童和老年人。此類品種的生產過程與部分注射劑/滴眼液生產工藝類似,屬于常規的無菌生產工藝[3]。在工藝研究方面著重對配液溫度、物料加入順序進行考察。
2.1配液溫度考察
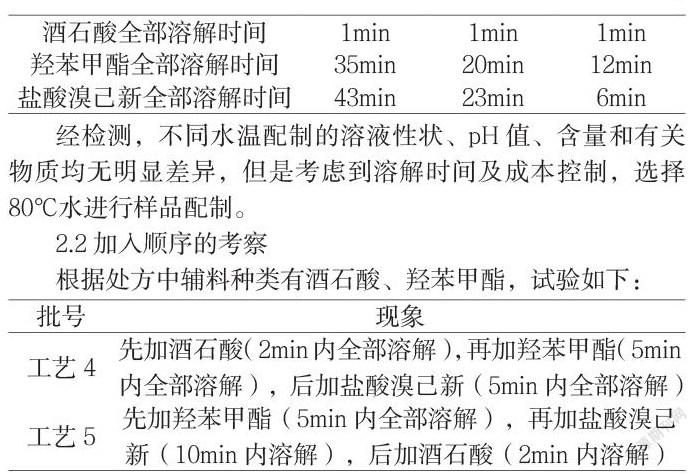
根據鹽酸溴己新原料的性質,在水中極微溶解,以及羥苯甲酯易溶于熱水的性質,考察40℃、60℃、80℃的水溫對鹽酸溴己新的影響,按照先加入酒石酸,再加入羥苯甲酯,最后加入鹽酸溴己新的順序試驗現象如下:
經檢測,不同水溫配制的溶液性狀、pH值、含量和有關物質均無明顯差異,但是考慮到溶解時間及成本控制,選擇80℃水進行樣品配制。
2.2加入順序的考察
根據處方中輔料種類有酒石酸、羥苯甲酯,試驗如下:
經檢測,按照兩種不同的加入順序配制的樣品各項指標無明顯差別。結合生產工藝,先加入鹽酸溴己新溶解時間較長,最終選擇工藝4。
2.3包材選擇
根據鹽酸溴己新溶液光照條件下變色的情況,在包材進行選擇時一并考察棕色玻璃瓶與無色玻璃瓶,并放置影響因素。結果表明,棕色瓶經放置后有關物質明顯優于無色瓶。
2.4滅菌參數選擇
根據中國藥典2020年版四部通則0111吸入制劑要求,吸入噴霧劑和吸入液體制劑應為無菌制劑[4]。保證F0值≥8的情況下,最終確定滅菌條件為121℃,12min。
3 小試放大
根據上述試驗篩選出最佳工藝流程為:①按照處方用量稱取原、輔料,加入80%的注射用水,將酒石酸、羥苯甲酯、鹽酸溴己新依次溶解;②定容,經0.45μm、0.22μmPES濾膜過濾;③用棕色瓶灌裝,封口;④經121℃12min高壓滅菌。根據最終確定處方及工藝步驟在實驗室試制三批樣品,檢測結果表明,三批小試放大樣品數據平行,重復性好。
4 討論
經過對吸入用鹽酸溴己新溶液的處方篩選和工藝研究,確定合理的工藝并與原研藥的關鍵質量指標進行對比,結果表明,按照此工藝制備的樣品放置穩定性實驗后,含量及雜質控制水平同原研一致。
參考文獻:
[1] 鹽酸溴己新對慢性阻塞性肺疾病發作期療效觀察,臨床醫藥文獻雜志,2019,6(1): 87- 88.
[2] 國家食品藥品監督管理總局,化學藥物(原料藥和制劑)穩定性研究技術指導原則(2015年第3號)[S],2015.
[3] 供霧化器用的液體制劑(溶液型)仿制藥藥學研發的一般考慮,新藥注冊與審評技術,2019,28(18):2197-2199.
[4] 國家藥典委員會,中華人民共和國藥典[S],2020年版,北京:中國醫藥科技出版社,2020.

