乳腺癌CSCO 2020分子分型與術后復發的相關性分析
張睿馨 徐可佩 方曉政 王世威 許茂盛
2020年,全球新發確診乳腺癌病例約230萬,死亡率約6.9%[1]。局部或遠端復發是乳腺癌診治中面臨的巨大挑戰,乳腺癌術后復發多在術后2~3年,復發率為10%~41%[2-3],導致復發的因素包括年齡、絕經、腫瘤的大小、淋巴結轉移、手術方式、病理類型、腫瘤的分子生物學特征及微環境等。本研究旨在探討不同乳腺癌分子分型標準與術后復發的因素,以及乳腺癌分子分型2020版與術后復發的相關性,為臨床個體化治療提供更多的參考。
1 對象與方法
1.1 研究對象 回顧性收集2013年1月至2017年12月在本院行手術治療并經病理確診的乳腺癌患者。(1)納入標準:具有完整的臨床及隨訪資料;均經病理學診斷、分子分型;無其他部位癌癥病史;確診時無遠處轉移;隨訪時間≥2年。(2)排除標準:合并腦、肝等多器官功能障礙;術后隨訪資料不完整;失訪患者。
1.2 資料收集 (1)臨床資料:包括乳腺癌患者的年齡、月經、生育史、腫瘤大小、淋巴結轉移及手術方式等。(2)病理資料:采用免疫組化法檢測患者ER、PR、HER2及Ki67等指標,均經病理科醫師診斷。按照2020 CSCO指南及2013 St Gallen會議乳腺癌分子分型標準將患者進行分類,見表1。
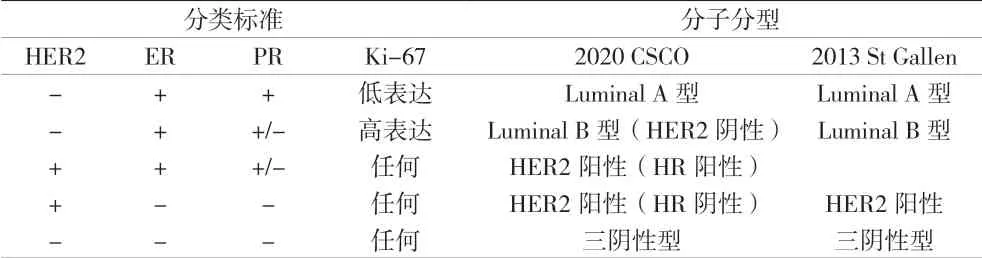
表1 乳腺癌分類標準與分子分型
1.3 乳腺癌術后復發判定標準 術后的前2年,每6個月進行一次隨訪,連續觀察2年以上。(1)區域內復發:指局限于同側的乳房內或胸壁,同側的腋窩、腋下軟組織內或腋下的淋巴結。(2)遠端復發:指轉移到身體的其他部位。所有患者均是通過磁共振檢查發現可疑復發的病灶,并通過穿刺活檢或切除活檢以證實復發。
1.4 統計學方法 采用SPSS 22.0統計軟件。采用Kapla-Meier法進行生存分析,組間比較采用Log-rank檢驗,將單因素分析中P≤0.1的變量納入Cox比例風險模型進行多因素分析。以P<0.05為差異有統計學意義。
2 結果
2.1 乳腺癌術后復發風險單因素分析 共收集到726例乳腺癌患者,因各種原因未入組共279例,包括術后隨訪資料不完整或失訪256例,合并其他部位癌癥病史或遠處轉移14例,同時存在心、肺等多器官功能障礙9例。最終納入研究的乳腺癌患者共447例,其中復發患者60例,均為女性,年齡24~85歲,平均年齡(53±11)歲。按照CSCO 2020版乳腺癌分子分型:Luminal A型55例,復發患者3例(5.5%);Luminal B型(HER2陰性)患者55例,復發患者10例(18.2%);HER2陽性型(HR陽性)患者197例,復發患者23例(11.7%);HER2陽性型(HR陰性)患者107例,復發17例(15.9%);三陰型患者33例,復發患者7例(21.2%)。Log-rank檢驗結果顯示,CSCO 2020與2013 St Gallen不同乳腺癌分子分型標準與乳腺癌術后復發風險的相關性存在差異,但差異無統計學意義(P>0.05),見表2。
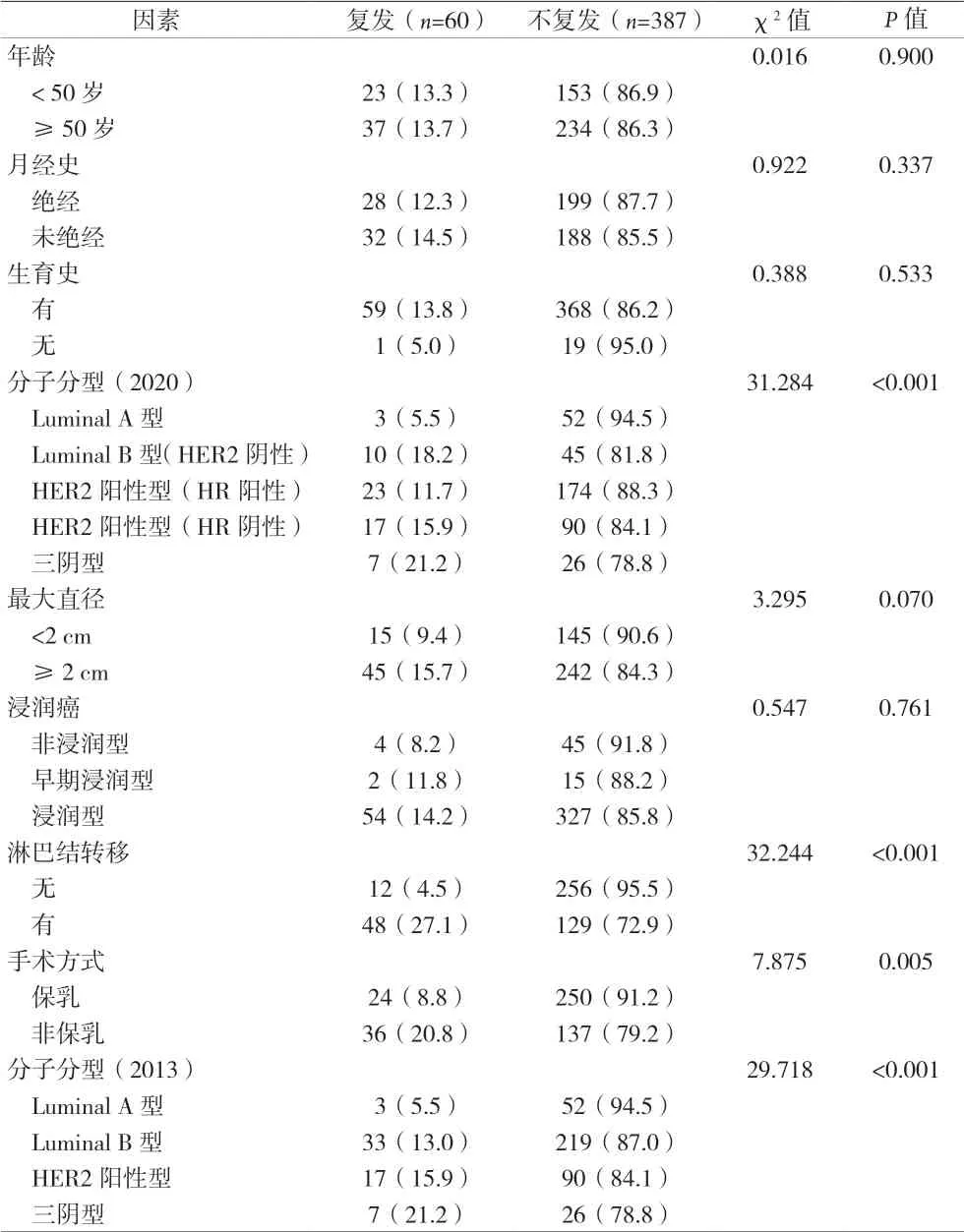
表2 乳腺癌患者術后復發單因素生存分析[n(%)]
2.2 乳腺癌術后復發風險多因素Cox比例風險分析 將單因素分析中有統計學意義的變量納入Cox比例風險模型進行多因素分析,結果顯示CSCO 2020中新增Luminal B(HER2陰性)及三陰型是乳腺癌復發的高危因素,2013 St Gallen中三陰型是乳腺癌復發的高危因素;乳腺癌淋巴結轉移及手術方式是乳腺癌術后復發的獨立高危險因素。見表3和表4。
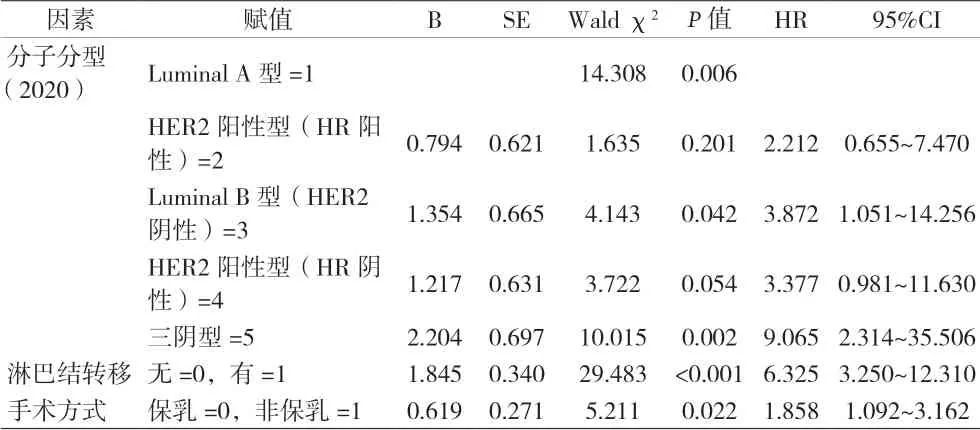
表3 乳腺癌患者術后復發多因素Cox比例風險模型(2020版)
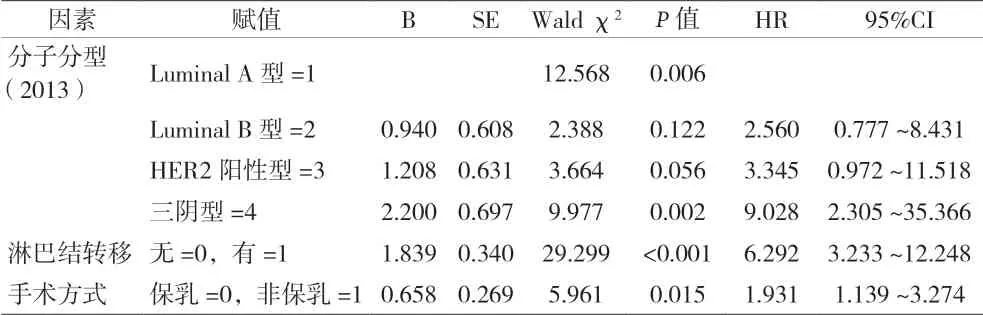
表4 乳腺癌患者術后復發多因素Cox比例風險模型(2013版)
3 討論
2000年,PEROU等專家首次依照基因表達模式的差異,將乳腺癌分為Luminal A型、Luminal B型、HER2過表達型及基底細胞樣型等四個主要亞型[4]。2001年,GALLEN提出將雌激素受體(ER)、孕激素受體(PR)、人表皮生長因子受體2(HER2)、Ki67的表達結果作為乳腺癌分子分型的標準。2013年,GALLEN又將PR≤20%的患者歸入Luminal B型,并將Luminal B型的兩種亞型加以區分重新定義為Luminal B型(HER2陰性)和HER2陽性(HR陽性),表明Luminal B型乳腺癌更具侵襲性及異質性。CSCO 2020版明確將乳腺癌分為Luminal A型、Luminal B型(HER2陰性)、HER2陽性(HR陽性)、HER2陽性(HR陰性)及三陰型[5]。乳腺癌由于其遺傳特性及分子功能的細胞亞群,導致其腫瘤異質度高[6-7],細化的乳腺癌分子分型可為其治療及預后評估提供更精準的信息[8-9]。目前,乳腺癌分子分型研究與臨床應用最多的仍是2013 St Gallen分型,更加精準的分子分型雖然有助于患者的治療及預后評價,但同時也增加了乳腺癌患者臨床診治的復雜性。本研究通過比較兩種乳腺癌分子分型標準的差異,進一步結合臨床資料、腫瘤病理分型及免疫組化等相關指標綜合分析影響乳腺癌患者術后復發的相關因素,以期幫助臨床有效決策乳腺癌的治療方案,合理優化使用醫療資源,提高乳腺癌患者的治療效果和生活質量。
本組分子分型不同的乳腺癌患者術后復發的風險存在差異。Luminal A型、Luminal B型(HER2陰性)、HER2陽性型(HR陽性)、HER2陽性型(HR陰性)及三陰型的風險比(HR)分別為1、3.872、2.212、3.377、9.065。其中,Luminal A型乳腺癌患者的復發率最低,此分子分型中Ki67低表達表明腫瘤細胞的增殖水平較低,預后更好。三陰型患者的復發率及復發風險均最高,即激素受體(ER、PR)和HER2均為陰性的乳腺癌患者,具有侵襲性高、預后差、5年復發率較高等風險。本研究發現,CSCO 2020中新增分子分型 Luminal B(HER2陰性)型也是乳腺癌復發的高危因素。通過分析Luminal B(HER2陰性)型患者的臨床數據,發現該類患者入組例數少,但復發多,復發率為18.2%,僅次于三陰型乳腺癌患者的復發率,且入組患者免疫組化Ki67值均大于30。由于本研究為回顧性分析,且患者隨訪時間較長,失訪例數較多,所以復發率相對較高,可能存在一定的誤差。PRAT等[10]分析了Ki67在腋窩淋巴結陰性乳腺癌患者中的預后效果及Ki67的表達與患者臨床資料的關系,多變量分析表明Ki67是乳腺癌死亡的獨立預測因子。Ki67反映乳腺癌的侵襲性,同時與無病生存期和總體生存率相關,可用于評估乳腺癌和其他惡性腫瘤的臨床預后[11-12]。由此推斷,Ki67可能成為Luminal B(HER2陰性)型患者具有較高復發率及Luminal B(HER2陰性)型為乳腺癌復發高危因素的主要原因。可見,CSCO 2020將2013GALLEN Luminal B型的兩種亞型加以區分單獨分組有一定的合理性。
目前,已發現乳腺癌分子分型的相關參數可以預測乳腺癌預后[13],但目前的預后評估標準尚不足以預測死亡率高的患者。不同乳腺癌分子分型患者的治療手段和預后不盡相同,尋找最適合于臨床診療的指標在乳腺癌患者的治療及預防復發中至關重要。本研究通過對乳腺癌患者術后分子分型以及首診年齡、絕經、生育史、腫瘤最大直徑、淋巴結是否轉移、手術方式、乳腺癌病理分型等諸多因素進行Log-rank檢驗,結果表明分子分型、淋巴結轉移及手術方式與乳腺癌術后復發均有相關。與此同時,將單因素分析有統計學意義變量,分子分型、最大直徑、淋巴結轉移、手術方式等納入Cox比例風險模型進行多因素分析,結果表明CSCO 2020新增Luminal B型(HER2陰性)、三陰型乳腺癌、與淋巴結轉移是乳腺癌患者術后復發的獨立高危因素。此外,結果還提示非保乳手術復發的風險是保乳手術的1.858倍,可能是由于行保乳手術的乳腺癌患者較多且病情輕、腫塊體積小、未見明顯淋巴結轉移,而非保乳術患者例數少且腫塊體積大、病灶侵襲性強,同時伴隨淋巴結轉移等影響乳腺癌復發的高危因素。淋巴結轉移是乳腺癌復發的危險因素[14],術中發現乳腺癌患者存在淋巴結轉移,表明腫瘤的浸潤程度較高,已出現擴散、脫落等現象,累及淋巴結,會加大治療難度,復發率也隨之升高,因此臨床應對該類患者給予更多重視,鼓勵患者積極參與治療。
綜上所述,與2013 St Gallen版分子分型比較,CSCO 2020版中新增分型Luminal B型(HER2陰性)乳腺癌有較高的復發率,該分型也是預測乳腺癌患者術后復發風險的獨立高危因素。CSCO 2020版乳腺癌分子分型可指導乳腺癌治療個性化方案的準確決策。

