褐藻膠寡糖對D-半乳糖誘導的小鼠腎臟衰老的保護作用及機制
潘 慧,鄭曉月,王 珊,陳 茗,毛擁軍
(青島大學附屬醫院老年醫學科,山東 青島 266000)
衰老引起的器官功能退行性改變是誘發各種年齡相關性疾病的主要危險因素。盡管衰老過程本身不會導致腎臟疾病,但結合年齡相關危險因素的累積影響,最終會引發腎臟的諸多病理改變。腎臟衰老是機體衰老的一部分,主要表現為功能性腎單位數量逐漸減少,腎小球萎縮、囊腔擴張,腎小管水腫、空泡化,腎間質纖維化[1-2],導致腎臟對應激損傷更加敏感,進而使老年人腎功能障礙的發病率和死亡率明顯增加。因此,積極尋找抗衰老的天然化合物并探討其延緩腎臟衰老的機制有重要意義。
自噬是大多數真核細胞降解受損或變性大分子物質的質量控制機制[3]。衰老可引起腎臟自噬功能紊亂,腎臟組織中自噬活性降低,可導致腎小球硬化、足細胞缺失,而上調自噬水平可減少足細胞和腎小管細胞凋亡并促進細胞再生,這對維持衰老腎臟組織穩態和緩解衰老相關損傷至關重要[4]。腺苷酸活化蛋白激酶(AMPK)和雷帕霉素靶蛋白(mTOR)是調控自噬的重要信號分子[5]。Liu等[6]研究表明,金絲桃苷可通過調控AMPK-ULK1信號介導的自噬減弱D-半乳糖(D-gal)誘導的腎臟老化和損傷。Yamamoto等[7]關于近端腎小管特異性自噬缺陷小鼠的研究表明,腎臟衰老損傷的發病機制與以微管相關蛋白1輕鏈3(LC3)和程序性死亡受體1(Beclin1)的變化為特征的自噬功能障礙相關。因此,上調自噬水平被認為是治療年齡相關性腎損傷的一種有益策略。
褐藻膠是從海洋褐藻中提取的天然海藻多糖,褐藻膠寡糖(AOS)是由海藻酸鹽解聚而形成的一種酸性多糖,具有水溶性、無毒、無免疫原性等多種獨特優勢。研究表明,AOS具有抗氧化、抗炎、免疫調節等多種藥理活性,已被廣泛應用于食品、藥品等領域[8]。本課題組前期研究顯示,AOS可以延緩D-gal誘導的C57BL/6j小鼠白內障進程[9],緩解野百合堿誘導的大鼠肺動脈高壓[10]。然而,AOS在腎臟衰老過程中的作用研究甚少。基于既往研究及預實驗結果,本課題組推測AOS可能通過激活AMPK/mTOR信號通路上調自噬水平延緩腎臟衰老。本研究旨在探討AOS對D-gal誘導的小鼠腎臟衰老的保護作用及其可能機制。
1 材料與方法
1.1 實驗材料
1.1.1實驗動物 30只雄性C57BL/6j小鼠,6-8周齡,體質量(20±2)g,購自北京維通利華實驗動物繁育有限公司,飼養在青島大學醫學部SPF級實驗動物中心,溫度(22±2)℃、相對濕度(50±10)%、明暗周期12 h ∶12 h。整個實驗過程中,所有小鼠均可自由獲得標準飼料和飲用水。本研究中所有動物實驗相關操作均獲得青島大學動物福利和倫理管理委員會批準(批號:QYFYWZLL25840)。
1.1.2主要藥物及試劑 D-gal(貨號:G0750)購自美國Sigma公司;AOS購于青島博智匯力生物技術有限公司。SQSTM1/p62(貨號:23214)、Beclin1(貨號:3495)、LC3-Ⅰ/Ⅱ(貨號:12741)、AMPK(貨號:2532)及p-AMPK(貨號:2535)抗體購自美國Cell Signaling Technology公司;p16(貨號:ab232402)購自美國Abcam公司;mTOR(貨號:66888-1-Ig)、p-mTOR(貨號:67778-1-Ig)抗體購于武漢Proteintech公司;GAPDH(貨號:ENM0215)、山羊抗兔(貨號:E-AB-1003)和山羊抗鼠(貨號:E-AB-1001)二抗購于武漢Elabscience公司。尿素氮(BUN)、血肌酐(SCr)試劑盒購于南京建成生物技術有限公司;BCA蛋白濃度測定試劑盒購于北京索萊寶公司。除另有說明外,所有其他試劑均購自標準商業供應商。
1.2 實驗方法
1.2.1動物分組及處理 適應性喂養1周后,將小鼠隨機分成3組:對照組(Control)、模型組(D-gal)、AOS治療組(D-gal + AOS),每組10只。D-gal組和D-gal + AOS組小鼠通過頸背部皮下注射D-gal(200 mg·kg-1·d-1)8周建立腎臟衰老模型,Control組小鼠同步注射等體積無菌生理鹽水;從D-gal注射的第5周開始,D-gal + AOS組小鼠予以AOS(200 mg·kg-1·d-1)灌胃4周[11],Control和D-gal組小鼠同步予以等體積滅菌蒸餾水。
1.2.2腎功能測定 藥物處理結束后,通過眼眶靜脈收集血樣,4 ℃、3 000 r·min-1離心15 min后,收集血漿于-80 ℃保存。采用試劑盒嚴格按照說明書操作,分別檢測小鼠BUN和SCr水平。
1.2.3組織學檢查 小鼠采血后麻醉并處死,迅速分離腎臟組織,大量生理鹽水沖洗后,置于4%多聚甲醛中固定24 h,制成石蠟切片用于HE染色及Masson染色,顯微鏡下觀察腎臟組織結構改變和纖維化程度。
1.2.4Western blot 取新鮮腎臟組織稱重,并加入適量含有蛋白酶抑制劑和磷酸酶抑制的RIPA裂解液,4 ℃、12 000 r·min-1離心20 min后收集上清液,BCA試劑盒測定蛋白濃度。等量蛋白于適宜濃度的凝膠上電泳分離后,電轉至PVDF膜上,隨后用5%脫脂牛奶室溫封閉90 min,TBST洗膜后,分別加入相應一抗,4 ℃孵育過夜后TBST洗膜,隨后加入相應二抗在室溫下孵育1 h。采用ECL化學發光液曝光,凝膠成像系統成像后采用Quantity One軟件分析條帶灰度值。將GAPDH蛋白表達作為內參照。
1.2.5實時熒光定量PCR(qRT-PCR) 取新鮮腎臟組織稱重,并加入適量TRIzol提取總RNA,紫外分光光度計測定RNA純度和濃度。采用Roche逆轉錄試劑盒,根據說明書操作合成cDNA。Klotho引物序列:F:5′-TGGGTCACTGGGTCAATCTCTGG-3′,R:5′-GCCTTTCAGCCGCCCTAAAC-3′;GAPDH引物序列:F:5′-CCTTCCGTGTCCCCACT-3′,R:5′-GCCTGCTTCACCACCTC-3′。根據qRT-PCR說明書在95 ℃ 10 min,95 ℃ 10 s、60 ℃ 10 s,72 ℃ 15 s,40次循環的條件下擴增cDNA。反應結束后,記錄PCR儀上的擴增曲線顯示的Ct值,目的基因的相對表達量采用比較2-△△Ct法計算。
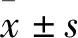
2 結果
2.1 AOS對D-gal誘導衰老小鼠腎功能的影響結果如Fig1所示,D-gal組小鼠BUN和SCr水平明顯高于Control組,AOS處理4周后,其水平恢復至低于D-gal組,提示AOS可以減輕D-gal誘導衰老小鼠的腎功能損害(P<0.05,P<0.01)。
2.2 AOS改善D-gal誘導衰老小鼠的腎臟組織病理改變HE染色和Masson染色結果如Fig2所示,與Control組相比,注射D-gal 8周后,小鼠腎臟中功能腎小球數量明顯減少,腎小球嚢腔擴張,腎小管上皮細胞水腫、變性,空泡形成;腎間質可見明顯藍染膠原纖維,這些病理變化在AOS處理4周后明顯緩解(P<0.01)。結果表明AOS可以改善D-gal誘導的衰老小鼠腎臟病理損傷,并緩解其纖維化程度。
2.3 AOS對D-gal誘導的小鼠腎臟組織中衰老相關蛋白表達的影響Western blot結果顯示,衰老相關蛋白p16在D-gal組表達明顯增加,與D-gal組相比,AOS處理促進了p16蛋白表達下調(P<0.05)(Fig3)。
2.4 AOS上調了D-gal誘導的衰老小鼠腎臟組織中Klotho的基因表達為探討AOS是否調控Klotho在腎臟中的表達,采用qRT-PCR檢測Klotho基因表達水平。結果如Fig4所示,與Control組相比,D-gal組小鼠腎臟組織中Klotho表達明顯降低,而AOS給藥4周后,Klotho表達明顯增加(P<0.01)。我們的結果表明Klotho基因可能參與了AOS改善D-gal誘導的腎臟衰老過程。
2.5 AOS上調了D-gal誘導的衰老小鼠腎臟的自噬水平如Fig5中結果顯示,與Control組相比,D-gal組小鼠腎臟組織中LC3-Ⅱ/Ⅰ和Beclin1蛋白表達明顯下降,p62表達增加,AOS處理明顯上調了LC3-Ⅱ/Ⅰ和Beclin1的表達,下調了p62的表達(P<0.01)。
2.6 AOS激活了D-gal誘導的衰老小鼠腎臟中AMPK/mTOR信號通路為了進一步探討AOS是否通過激活AMPK/mTOR信號通路上調自噬水平,進而延緩D-gal誘導的小鼠腎臟衰老,我們采用Western blot方法檢測各組腎臟組織中AMPK/mTOR信號通路蛋白的表達情況。實驗數據顯示,與Control組相比,D-gal誘導衰老小鼠腎臟組織中p-AMPK表達降低,p-mTOR表達增加;與D-gal組相比,AOS處理后p-AMPK表達增加,而p-mTOR表達明顯降低(P<0.01)(Fig6)。

Fig 1 Kidney function improved by AOS in D-gal-induced aging mice n=10)A:The level of BUN;B:The level of SCr.**P<0.01 vs control group;#P<0.05 ,##P<0.01 vs D-gal group.

Fig 2 Kidney histological alterations prevented by AOS in D-gal-induced aging mice n=10)A:Morphological changes were assessed by HE staining (×400);B:The degree of kidney fibrosis was investigated by Masson trichrome staining (×400);C:The corresponding quantitative data of (B).**P<0.01 vs control group;##P<0.01 vs D-gal group.

Fig 3 Expression of aging markers down-regulated by AOS in D-gal-induced aging mice n=10)A:The protein expression of p16 was measured by Western blot;B:The corresponding quantitative data of (A).**P<0.01 vs control group;#P<0.05 vs D-gal group.

Fig 4 Expression of Klotho gene up-regulated by AOS in D-gal-induced aging mice n=10)The expression of the antiaging gene Klotho was measured by RT-qPCR.**P<0.01 vs control group;##P<0.01 vs D-gal group.

Fig 5 The autophagy level up-regulated by AOS in D-gal-induced aging mice n=10)(A,C)The protein expression of LC3-Ⅱ/Ⅰ,Beclin1 and p62 was determined by Western blot.(B,D)The corresponding quantitative data of (A ,C).**P<0.01 vs control group;##P<0.01 vs D-gal group.

Fig 6 AMPK/mTOR signaling pathway activated by AOS in kidney of D-gal-induced aging mice n=10)A:The protein expression of AMPK,p-AMPK,mTOR and p-mTOR was determined by Western blot;B:The corresponding quantitative data of (A).**P<0.01 vs control group;##P<0.01 vs D-gal group.
3 討論
隨著老齡人口的持續增長,年齡相關性腎臟疾病的發病率和死亡率不斷增加[12],因此,明確腎臟衰老相關機制以及探索有效抗衰老藥物對延緩腎臟衰老、治療衰老相關腎損傷具有重要意義。本實驗以D-gal誘導C57BL/6j小鼠的腎臟衰老模型為研究對象,探討AOS可能的抗衰老作用及其機制。本研究發現,D-gal處理后小鼠腎功能下降、衰老標志物表達增加、衰老抑制基因及自噬水平降低,AOS干預后明顯改善了腎功能,上調其自噬水平和衰老抑制基因表達,表明AOS對D-gal誘導的小鼠腎臟衰老有潛在的保護作用。
自噬-溶酶體體系是真核細胞內受損細胞器和大分子物質的主要降解途徑,在自然衰老過程中,自噬活性逐漸降低。Beclin1是自噬過程啟動的關鍵因子,自噬過程啟動后,LC3蛋白合成并立即被Atg4剪切后在細胞質中形成LC3-Ⅰ,LC3-Ⅰ隨后被泛素化修飾和加工后形成LC3-Ⅱ,并定位到自噬小體中,LC3-Ⅱ/Ⅰ比值的大小可評估自噬水平的高低[13-14]。p62是一類銜接蛋白,在自噬溶酶體降解過程中起關鍵作用。因此,LC3-Ⅱ、Beclin1和p62均可作為自噬水平檢測的主要標志物。吳飛翔等[15]關于多胺及與自噬的研究支持了自噬在抗衰老過程中的關鍵作用。一項體外研究顯示,腎臟足細胞和近端腎小管細胞Atg5基因的特異性缺失導致足細胞中受損線粒體和泛素化蛋白的積累,從而導致年齡依賴性蛋白尿和腎小球硬化,該研究結果表明,足細胞和近端腎小管細胞中基礎自噬的缺乏與腎臟老化的發展相關[16]。我們的實驗證實了AOS可以延緩D-gal誘導的腎臟衰老,為了探索其可能機制,我們進一步探討了AOS處理前后自噬水平的變化。劉春燕等[17]研究表明,db/db糖尿病模型小鼠足細胞自噬水平下降,表現為自噬標志物LC3-Ⅱ和Beclin1表達減少,p62表達增加,AMPK磷酸化被抑制,mTOR磷酸化增加。本研究結果與前人一致,D-gal組小鼠腎臟組織中LC3-Ⅱ、Beclin1表達均減少,p62蛋白表達增加,予以AOS干預4周后,LC3-Ⅱ和Beclin1表達顯著增加,p62蛋白表達明顯減少,這表明AOS可能通過上調自噬水平延緩D-gal誘導的小鼠腎臟衰老。
研究表明,AMPK的缺失會加速衰老相關疾病的發生和發展。mTOR是誘導自噬的關鍵分子,磷酸化mTOR可抑制自噬,而mTOR的負性調節可促進自噬。AMPK/mTOR信號通路作為自噬調控的關鍵通路之一,在自噬調節中具有重要作用,AMPK在低能量條件下磷酸化,進而通過抑制mTOR的磷酸化激活自噬[18]。因此,我們檢測了AMPK/mTOR通路的相關指標,并探討了AOS是否通過激活AMPK/mTOR信號通路上調D-gal誘導小鼠衰老腎臟的自噬水平。研究發現,D-gal抑制了小鼠腎臟組織中AMPK的磷酸化,促進mTOR磷酸化,進而抑制自噬;AOS處理促進了衰老腎臟中AMPK的磷酸化,從而抑制了mTOR的磷酸化,進而增強自噬。基于本研究結果,我們推斷AOS通過激活AMPK/mTOR信號通路上調了D-gal誘導的小鼠衰老腎臟的自噬水平,從而延緩腎臟衰老。
綜上所述,本研究證實了在D-gal誘導的C57BL/6j小鼠的衰老腎臟中自噬水平下降。我們的研究表明,AOS可以延緩D-gal誘導的小鼠腎臟衰老,其機制可能與激活AMPK/mTOR信號通路上調自噬水平有關。然而,本研究只在動物水平探討了AOS通過調控自噬水平延緩D-gal誘導的小鼠腎臟衰老,AOS延緩腎臟衰老的其他機制需要進一步研究。

