保存溫度、時間和凍融次數對RNA樣本濃度和純度的影響
張汝倩,洪恩宇,于永波,任慧敏,耿迪,楊慧,王雅頔,周萍萍,魯潔,郭永麗
作者單位:100045 北京,國家兒童醫學中心(北京)首都醫科大學附屬北京兒童醫院,北京市兒科研究所兒童耳鼻咽喉頭頸外科疾病北京市重點實驗室(張汝倩、洪恩宇、于永波、任慧敏、耿迪、楊慧、王雅頔、周萍萍、魯潔、郭永麗);兒童臨床數據和樣本資源庫(洪恩宇、于永波、任慧敏、耿迪、楊慧、王雅頔、周萍萍、魯潔、郭永麗)
RNA 在人類多種生理和病理過程中發揮著舉足輕重的作用。近些年來,隨著分子生物技術在生命科學、醫學等方面的廣泛應用,以 RNA 為靶標進行的組織及細胞的分子生物學研究較為廣泛。在 RNA 的科學研究中,高質量 RNA可滿足 RT-PCR、Northern blot、基因表達譜、轉錄組測序和陣列分析等生物學實驗的研究需求[1-2],所以能夠獲得具有生物活性及化學穩定的完整 RNA 分子至關重要。然而由于 RNA 自身結構特性[3]和環境中廣泛分布的核糖核酸酶(Ribonuclease,RNase)[4],從血液、組織或培養的細胞中抽提得到的 RNA 的穩定保存相對困難。
目前,有關 RNA 濃度和純度的影響因素研究主要集中在提取方法、樣本類型、儲存溫度和時間等方面,有文獻報道不同的放置時間和溫度會影響 RNA 提取的質量濃度,但保存時間對 RNA 的純度影響各報道結論不統一[5-6]。根據臨床檢測和科研的需要,提取后 RNA 保存條件和時間對RNA 濃度和純度的影響也同樣非常重要。同時,我們查詢文獻發現提取后 RNA 的保存溫度和放置時間對 RNA 的質量影響也有所不同[7-8],不同濃度的 RNA 反復凍融對其濃度和純度的影響也鮮有報道。所以,本文通過探討不同濃度的 RNA 在 4 ℃ 及常溫條件下放置不同時間,評估其對RNA 濃度和純度的影響;另外,通過反復凍融不同濃度的RNA,研究不同濃度的 RNA 凍融次數對其濃度和純度的影響,以期為臨床檢測和科學研究提供實驗依據。
1 材料與方法
1.1 材料
1.1.1 主要設備 4 ℃ 和–80 ℃ 冰箱均為三洋產品;300 servies AE 生物安全柜和 NanoDrop 分光光度計均購自美國 Thermo 公司;1 L 便攜式液氮罐、高速冷凍離心機均購自德國 Eppendorf 公司;OSE-Y10 電動組織研磨器購自美國 Qiangen 公司。
1.1.2 主要試劑 AllPrep DNA/RNA Mini Kit 購自美國Qiangen 公司;β-巰基乙醇等試劑購自國藥集團化學試劑有限公司。
1.2 方法
1.2.1 標本采集與總 RNA 提取
1.2.1.1 組織標本的留取 組織標本為首都醫科大學附屬北京兒童醫院手術切除的患兒組織樣本(神經母細胞瘤瘤體)3 例,在組織離體 30 min 內,采集組織標本大小約30 mg/份(共 5 份),并迅速置于液氮中保存,以上操作均為無菌操作,并已獲取相關知情同意書。
1.2.1.2 總 RNA 提取 組織樣本 RNA 的提取嚴格按照操作說明書操作,步驟如下:每 30 mg 組織樣本加入0.6 ml 緩沖液 RLT 和 β-巰基乙醇混合液,組織研磨器破碎后離心,吸取上層勻漿至帶有收集管的過濾柱中,離心,加入等體積 70% 乙醇,離心,再加入緩沖液 RW1、緩沖液 RPE 去除蛋白及殘留乙醇,最后加 50 μl RNasefree water 溶解 RNA。
1.2.2 樣本分組 ①不同濃度 RNA 4 ℃ 放置組:組織樣本提取 RNA 后混勻稀釋成濃度 C1(400 ng/μl)、C2(200 ng/μl)、C3(100 ng/μl)和 C4(50 ng/μl)分裝于 RNase free 凍存管中并編號,4 ℃ 放置 0、6、12、24、48、72、96 及 168 h,行 RNA 濃度及純度檢測,每組 3 個重復樣本。②不同濃度 RNA 常溫放置組:組織樣本提取 RNA后混勻稀釋成濃度 C1(400 ng/μl)、C2(200 ng/μl)、C3(100 ng/μl)和 C4(50 ng/μl)分裝于 RNase free 凍存管中并編號,常溫放置 0、3、6、12、24、48、72、96 及 168 h,行 RNA 濃度及純度檢測,每組 3 個重復樣本。③不同濃度 RNA 反復凍融組:組織樣本提取 RNA 后混勻稀釋成濃度 C1(400 ng/μl)、C2(200 ng/μl)、C3(100 ng/μl)和C4(50 ng/μl)分裝于 RNase free 凍存管中并編號,–80 ℃冰箱保存,每組 3 個重復樣本。將 RNA樣本每天凍融2 次,上下午各一次,待 RNA 完全融化后放回–80 ℃ 保存,重復此操作,樣本共計凍融 5 次(N5)、10 次(N10)、15 次(N15)及 20 次(N20),并在 2 周內行 RNA 濃度及純度檢測。
1.2.3 RNA 濃度和純度檢測 取 2 μl RNA樣本,使用核酸蛋白檢測儀 NanoDrop 檢測 RNA 濃度及OD260/OD280比值。比值在 1.8~2.1 范圍內,表明 RNA 純度較好;比值 <1.8 表明有 DNA、蛋白質污染;比值 >2.1 表明 RNA降解或有異硫氰酸胍等物質污染。
1.3 統計學處理
應用 SPSS 19.0 統計軟件對實驗數據進行分析,計量資料以±s表示,各組間差異比較采用單因素方差分析,設定P<0.05 為差異有統計學意義。
2 結果
2.1 不同濃度 RNA 在 4 ℃ 放置不同時間對 RNA 質量的影響
使用 NanoDrop 分光光度計檢測 RNA 的濃度和純度。結果如表 1所示,不同濃度 RNA 在 4 ℃ 放置不同時間 RNA 濃度范圍:C1(400 ng/μl:399.0~436.4 ng/μl);C2(200 ng/μl:205.5~215.1 ng/μl)、C3(100 ng/μl:101.5~106.8 ng/μl)和 C4(50 ng/μl:48.6~53.1 ng/μl)。隨著放置時間的延長,不同濃度的 RNA樣本在 24 h 時均出現下降趨勢,48 h 時均出現上升趨勢,72 h 后低濃度的 RNA(50 ng/μl)出現下降趨勢,但各時間組并無統計學差異(P>0.05);不同濃度 RNA 4 ℃ 放置不同時間 RNA 純度OD260/OD280比值范圍:C1(400 ng/μl:2.03~2.05);C2(200 ng/μl:2.02~2.04)、C3(100 ng/μl:2.00~2.02)和C4(50 ng/μl:1.99~2.05),各組標準差在 ±0.01~±0.58 之間,且無統計學差異(P>0.05)。以上結果表明,組織樣本RNA 在 4 ℃ 條件下放置,不同濃度的 RNA樣本其濃度整體呈先下降后上升的趨勢,RNA 純度基本保持不變。
表1 不同濃度 RNA樣本在 4 ℃ 放置不同時間對 RNA 濃度和純度的影響(±s)
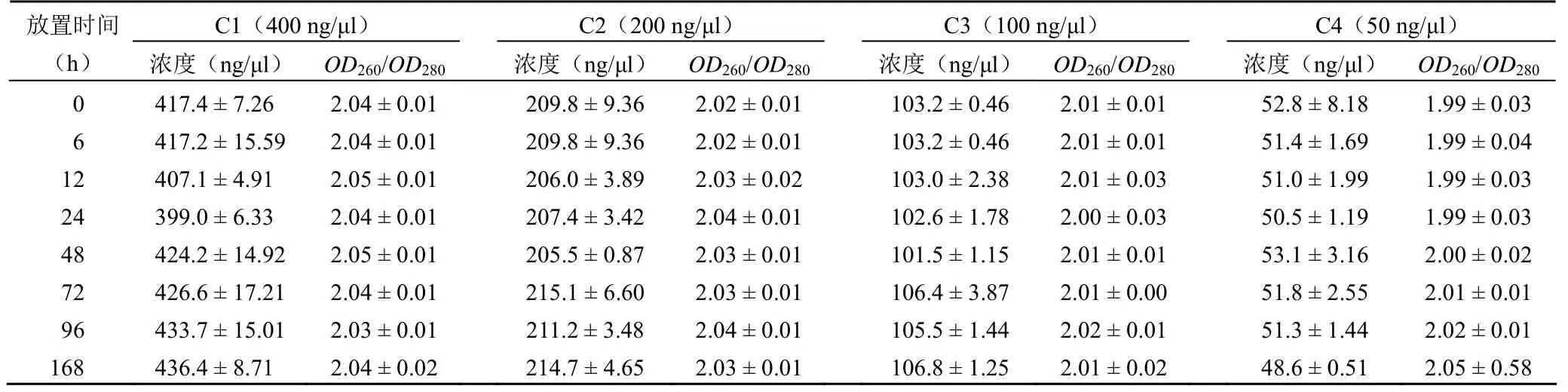
表1 不同濃度 RNA樣本在 4 ℃ 放置不同時間對 RNA 濃度和純度的影響(±s)
C1(400 ng/μl) C2(200 ng/μl) C3(100 ng/μl) C4(50 ng/μl)放置時間(h) 濃度(ng/μl) OD260/OD280 濃度(ng/μl) OD260/OD280濃度(ng/μl) OD260/OD280 濃度(ng/μl) OD260/OD280 0 417.4 ± 7.26 2.04 ± 0.01 209.8 ± 9.36 2.02 ± 0.01103.2 ± 0.46 2.01 ± 0.01 52.8 ± 8.18 1.99 ± 0.03 6 417.2 ± 15.59 2.04 ± 0.01 209.8 ± 9.36 2.02 ± 0.01103.2 ± 0.46 2.01 ± 0.01 51.4 ± 1.69 1.99 ± 0.04 12 407.1 ± 4.91 2.05 ± 0.01 206.0 ± 3.89 2.03 ± 0.02103.0 ± 2.38 2.01 ± 0.03 51.0 ± 1.99 1.99 ± 0.03 24 399.0 ± 6.33 2.04 ± 0.01 207.4 ± 3.42 2.04 ± 0.01102.6 ± 1.78 2.00 ± 0.03 50.5 ± 1.19 1.99 ± 0.03 48 424.2 ± 14.92 2.05 ± 0.01 205.5 ± 0.87 2.03 ± 0.01101.5 ± 1.15 2.01 ± 0.01 53.1 ± 3.16 2.00 ± 0.02 72 426.6 ± 17.21 2.04 ± 0.01 215.1 ± 6.60 2.03 ± 0.01106.4 ± 3.87 2.01 ± 0.00 51.8 ± 2.55 2.01 ± 0.01 96 433.7 ± 15.01 2.03 ± 0.01 211.2 ± 3.48 2.04 ± 0.01105.5 ± 1.44 2.02 ± 0.01 51.3 ± 1.44 2.02 ± 0.01 168 436.4 ± 8.71 2.04 ± 0.02 214.7 ± 4.65 2.03 ± 0.01106.8 ± 1.25 2.01 ± 0.02 48.6 ± 0.51 2.05 ± 0.58
2.2 不同濃度 RNA樣本常溫放置不同時間對 RNA 濃度和純度的影響
結果如表 2所示,不同濃度 RNA 常溫放置不同時間RNA 濃度范圍:C1(400 ng/μl:404.7~417.4 ng/μl);C2(200 ng/μl:205.7~218.2 ng/μl)、C3(100 ng/μl:102.1~108.5 ng/μl)和 C4(50 ng/μl:49.0~53.6 ng/μl)。隨著放置時間的延長,不同濃度的 RNA樣本在 6 h 時均出現下降趨勢,其他時間濃度呈無規律變化,各時間組也無統計學差異(P>0.05);不同濃度 RNA 常溫放置不同時間純度OD260/OD280比值范圍:C1(400 ng/μl:2.04~2.06);C2(200 ng/μl:1.98~2.05)、C3(100 ng/μl:1.93~2.03)和 C4(50 ng/μl:1.93~2.05),各組標準差在 ±0.01~±0.04 之間,且無統計學差異(P>0.05)。以上結果表明,組織樣本 RNA在常溫條件下放置,不同濃度的 RNA樣本在 6 h 時均出現下降趨勢,其他時間濃度呈無規律變化,RNA 的純度基本保持不變。
表2 不同濃度 RNA樣本常溫放置不同時間對 RNA 濃度和純度的影響(±s)
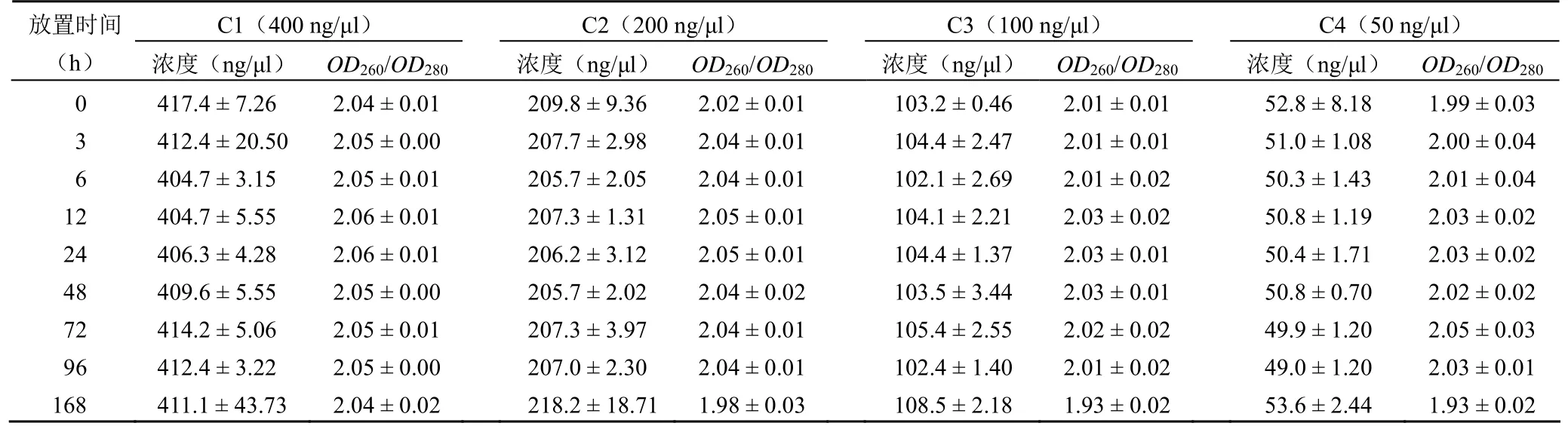
表2 不同濃度 RNA樣本常溫放置不同時間對 RNA 濃度和純度的影響(±s)
C1(400 ng/μl) C2(200 ng/μl) C3(100 ng/μl) C4(50 ng/μl)放置時間(h) 濃度(ng/μl) OD260/OD280 濃度(ng/μl) OD260/OD280濃度(ng/μl) OD260/OD280 濃度(ng/μl) OD260/OD280 0 417.4 ± 7.26 2.04 ± 0.01 209.8 ± 9.36 2.02 ± 0.01103.2 ± 0.46 2.01 ± 0.01 52.8 ± 8.18 1.99 ± 0.03 3 412.4 ± 20.50 2.05 ± 0.00 207.7 ± 2.98 2.04 ± 0.01104.4 ± 2.47 2.01 ± 0.01 51.0 ± 1.08 2.00 ± 0.04 6 404.7 ± 3.15 2.05 ± 0.01 205.7 ± 2.05 2.04 ± 0.01102.1 ± 2.69 2.01 ± 0.02 50.3 ± 1.43 2.01 ± 0.04 12 404.7 ± 5.55 2.06 ± 0.01 207.3 ± 1.31 2.05 ± 0.01104.1 ± 2.21 2.03 ± 0.02 50.8 ± 1.19 2.03 ± 0.02 24 406.3 ± 4.28 2.06 ± 0.01 206.2 ± 3.12 2.05 ± 0.01104.4 ± 1.37 2.03 ± 0.01 50.4 ± 1.71 2.03 ± 0.02 48 409.6 ± 5.55 2.05 ± 0.00 205.7 ± 2.02 2.04 ± 0.02103.5 ± 3.44 2.03 ± 0.01 50.8 ± 0.70 2.02 ± 0.02 72 414.2 ± 5.06 2.05 ± 0.01 207.3 ± 3.97 2.04 ± 0.01105.4 ± 2.55 2.02 ± 0.02 49.9 ± 1.20 2.05 ± 0.03 96 412.4 ± 3.22 2.05 ± 0.00 207.0 ± 2.30 2.04 ± 0.01102.4 ± 1.40 2.01 ± 0.02 49.0 ± 1.20 2.03 ± 0.01 168 411.1 ± 43.73 2.04 ± 0.02 218.2 ± 18.711.98 ± 0.03108.5 ± 2.18 1.93 ± 0.02 53.6 ± 2.44 1.93 ± 0.02
2.3 組織 RNA樣本冰上反復凍融對不同濃度 RNA 質量的影響
結果如表 3所示,不同濃度的 RNA樣本經反復凍融5、10、15 和 20 次(2 周內)后 RNA 濃度范圍:C1(400 ng/μl:377.8~417.4 ng/μl);C2(200 ng/μl:195.0~209.8 ng/μl)、C3(100 ng/μl:97.0~103.2 ng/μl)和 C4(50 ng/μl:48.0~52.8 ng/μl)。隨著凍融次數增多,不同濃度的 RNA樣本濃度均出現明顯下降趨勢,但各組間均無統計學差異(P>0.05);不同濃度 RNA 經反復凍融 5、10、15 和 20 次(2 周內)后 RNA 純度OD260/OD280比值范圍:C1(400 ng/μl:2.03~2.04);C2(200 ng/μl:2.02~2.03)、C3(100 ng/μl:1.99~2.01)和 C4(50 ng/μl:1.99~2.00),各組標準差在 ±0.01~±0.03 之間,且無統計學差異(P>0.05)。以上結果表明,保存在–80 ℃ 冰箱中不同濃度的RNA樣本,在冰上反復凍融(2 周內)后濃度均有下降,RNA 的純度基本保持不變。
表3 組織 RNA樣本冰上反復凍融對 RNA 濃度和純度的影響(±s)
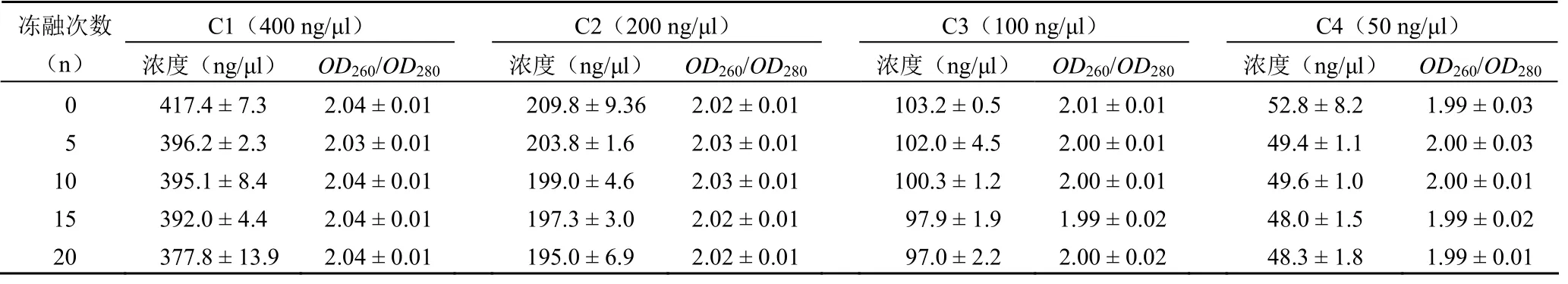
表3 組織 RNA樣本冰上反復凍融對 RNA 濃度和純度的影響(±s)
C1(400 ng/μl) C2(200 ng/μl) C3(100 ng/μl) C4(50 ng/μl)凍融次數(n) 濃度(ng/μl) OD260/OD280 濃度(ng/μl) OD260/OD280濃度(ng/μl) OD260/OD280 濃度(ng/μl) OD260/OD280 0 417.4 ± 7.3 2.04 ± 0.01 209.8 ± 9.362.02 ± 0.01103.2 ± 0.5 2.01 ± 0.01 52.8 ± 8.2 1.99 ± 0.03 5 396.2 ± 2.3 2.03 ± 0.01 203.8 ± 1.6 2.03 ± 0.01102.0 ± 4.5 2.00 ± 0.01 49.4 ± 1.1 2.00 ± 0.03 10 395.1 ± 8.4 2.04 ± 0.01 199.0 ± 4.6 2.03 ± 0.01100.3 ± 1.2 2.00 ± 0.01 49.6 ± 1.0 2.00 ± 0.01 15 392.0 ± 4.4 2.04 ± 0.01 197.3 ± 3.0 2.02 ± 0.0197.9 ± 1.9 1.99 ± 0.02 48.0 ± 1.5 1.99 ± 0.02 20 377.8 ± 13.9 2.04 ± 0.01 195.0 ± 6.9 2.02 ± 0.0197.0 ± 2.2 2.00 ± 0.02 48.3 ± 1.8 1.99 ± 0.01
3 討論
RNA樣本的質量檢測包括濃度、純度、完整性以及RT-PCR 反應擴增率等,而完整性和均一性是評價 RNA 質量的兩個最關鍵指標[9-12]。生物分析儀和OD260/OD280的比值是反映 RNA 質量的常用方法和指標。由于 RNA 極其容易降解,影響其質量的因素眾多,目前的科學研究中大多都集中在不同標本的保存條件和時間對 RNA 質量的影響,如何松哲等[5]研究的是不同保存和處理方式對全血標本總RNA 提取的影響;李維凱等[13]研究的是保存條件對大鼠海馬組織總 RNA 質量的影響;張杰等[6]研究的是乳腺癌細胞在不同溫度和不同放置時間對總 RNA 提取濃度和純度的影響等;然而不同濃度的 RNA 在不同的保存條件下對RNA 的質量影響卻少有報道。
楊秀榮等[8]報道過將 RNA樣本置于 4 ℃ 條件下,每隔 5 h、10 h、15 h、20 h、25 h、3 d、7 d 和 14 d 對提取的 RNA 進行檢測,結果顯示 14 d 后 RNA 完整性較好。我們研究同樣發現不同濃度的 RNA樣本在 4 ℃ 條件下放置 168 h(1 周),RNA 濃度和純度均與 0 h 沒有統計學差異,說明該條件下不會影響 RNA 的濃度和純度。毛君婷等[7]報道過將 RNA樣本置于 4 ℃ 條件下放置 24 h 和48 h,結果顯示樣本在室溫條件下可以保存 24 h 以上,48 h時有少量降解,我們研究發現不同濃度的 RNA樣本在常溫條件下放置 168 h(1 周),RNA 濃度和純度均與 0 h 沒有統計學差異,說明該條件下不會影響 RNA 的濃度和純度。因此不同濃度的 RNA樣本在 4 ℃ 或常溫放置 168 h(1 周)內,雖然 RNA 濃度有降低和升高,但是 RNA 純度OD260/OD280比值基本保持不變。導致 RNA 純度改變的原因我們認為是 RNA 不穩定,在存放過程中核酸降解一方面可以影響其濃度,另一方面降解產物可影響 RNA 純度,最終會影響 RNA 的質量。我們發現以OD260/OD280比值作為評價指標,RNA 在 4 ℃ 或常溫條件下放置 1 周RNA 純度基本不變。即使如此,由于生物分析儀是分析和反映 RNA 質量的另一常用方法和指標,但是我們忽略了該方法對研究結果進一步驗證,這是我們研究存在的局限性。
RNA 通常是從組織、全血和培養的細胞中獲得[14],從不同的標本中提取的 RNA 濃度會有所不同,在我們實際的臨床檢測和科學研究過程中,經常需要對某一樣品 RNA 進行重復檢測,因此,探討不同濃度的 RNA 反復凍融對RNA 質量的影響具有現實意義。課題組前期研究發現高濃度的 RNA 凍融 1、11、26 和 41 次,結果顯示隨著凍融次數的增多,RNA 濃度出現明顯的下降趨勢,但是各組并沒有統計學差異[15]。本次研究我們發現不同濃度的 RNA凍融多次(5、10、15 和 20 次),RNA 濃度均出現明顯的下降趨勢,但是各組 RNA 濃度和純度并沒有統計學差異,相應的OD260/OD280均在 1.8~2.1 之間,純度基本保持不變。因此保存在–80 ℃ 冰箱中不同濃度的 RNA 反復凍融后對 RNA 的濃度有一定影響,但對 RNA 的純度影響不大。
總之,本研究結果顯示不同濃度的 RNA樣本在 4 ℃或常溫條件下放置 1 周,不會對 RNA 濃度和純度造成明顯影響;不同濃度的 RNA 在 2 周內反復凍融會降低RNA 的濃度,但是不會影響 RNA 的純度。

