響應面優化微波輔助提取魔芋多糖的工藝
朱丹*,麻秀萍,楊菁,郭江濤
貴州中醫藥大學藥學院(貴陽 550025)
魔芋(Amorphophallus konjac),別名天南星、蛇頭草、花蓮桿,是天南星科的多年生草本植物魔芋的球狀塊莖[1]。魔芋中含量最多的是以葡甘露聚糖為代表的多糖類物質。魔芋多糖是一種復合型糖,是已知植物多糖中黏度最大的天然高分子多糖[2]。研究表明,魔芋多糖具有降血脂、降血糖[3-4]、抗衰老[5]、抗癌[6]、抗炎[7]等多種生物學功能,還具有獨特的水溶性、成膜性、增稠性和凝膠性[8],近年來越來越受到食品保健、運動醫學、醫療環保等領域的廣泛關注。因此,如何高效提取魔芋多糖,成為魔芋產品開發及提高產業競爭力的關鍵問題。微波輔助提取具有提取效率高、提取速度快、操作簡便等優點[9],在食品及中藥提取方面具有較高的應用前景。試驗采用微波輔助提取結合響應面優化法對魔芋多糖的提取工藝進行考察,為魔芋多糖的進一步開發利用提供參考。
1 材料與方法
1.1 材料與試劑
食用魔芋(市售);娃哈哈飲用水;無水乙醇、濃硫酸、苯酚(分析純,川東化工);D-無水葡萄糖對照品(200098-190602,江蘇永健醫藥科技有限公司)。
1.2 儀器與設備
UV-5900型紫外分光光度計(上海元析儀器有限公司);PJ21C-AN微波爐(美的公司);DRHH-1型數顯恒溫水浴鍋(上海雙捷實驗設備有限公司);H11650-W型離心機(湘儀離心機有限公司);FA2204N型電子天平(上海箐海儀器有限公司)。
1.3 方法
1.3.1 對照品溶液的制備
精密稱取102.75 mg葡萄糖對照品,置于500 mL容量瓶中,加蒸餾水溶解,定容至刻度,搖勻,即得
0.205 5 mg/mL的葡萄糖對照品溶液。
1.3.2 魔芋中還原糖的去除
由于還原糖會干擾多糖的含量測定,因此需將魔芋中的還原糖去除。取干燥至恒重的魔芋粉末,稱取1 g置250 mL圓底燒瓶中,加入200 mL 65%乙醇[10]于微波中回流提取20 min,過濾,將濾渣揮干至恒重,除去還原糖。
1.3.3 魔芋多糖的提取工藝
將1.3.2的方法干燥至恒重的魔芋粉末,精密稱定1 g,置于500 mL圓底燒瓶中,加入250 mL蒸餾水于微波爐中420 W功率下回流提取35 min,冷卻至室溫,轉移至離心管中,離心20 min(2 000 r/min),合并上清液,即得魔芋多糖提取液樣品。
1.3.4 魔芋多糖含量的測定
1.3.4.1 標準曲線的繪制
精密移取0.20,0.30,0.40,0.50和0.60 mL對照品溶液置于具塞試管中,用蒸餾水補足2 mL,加1.00 mL 5%苯酚溶液,在室溫水浴中緩緩加入5 mL濃硫酸,振搖,冷卻至室溫,放入沸水浴35 min,取出流水冷卻至室溫,以蒸餾水為空白對照,于490 nm測定吸光度,以葡萄糖濃度為橫坐標,吸光度為縱坐標,繪制標準曲線。
1.3.4.2 樣品中多糖的含量測定
精密移取0.5 mL 1.3.3小節的魔芋多糖提取液樣品置于25 mL容量瓶中,加蒸餾水定容至刻度,精密移取2 mL,加1.00 mL 5%苯酚溶液,在室溫水浴中緩緩加入5 mL濃硫酸,振搖,冷卻至室溫,放入沸水浴35 min,取出流水冷卻至室溫,以蒸餾水為空白對照,于490 nm測定吸光度。根據標準曲線計算出樣品中多糖提取率,按式(1)計算多糖提取率。
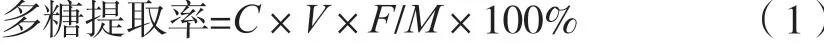
式中:C為由標準曲線計算出的多糖濃度,μg/mL;V為提取液體積,mL;F為稀釋倍數;M為魔芋質量,g。
1.3.5 提取條件單因素試驗
以魔芋中總多糖的提取率為指標,研究微波功率、提取時間、料液比3個因素對魔芋多糖提取率的影響。
1.3.5.1 微波功率對魔芋多糖提取率的影響
在固定料液比1∶150(g/mL)、提取時間30 min條件下,考察不同微波功率(140,280,42,560和700 W)對魔芋多糖提取率的影響。
1.3.5.2 提取時間對魔芋多糖提取率的影響
在固定微波功率420 W、料液比1∶150(g/mL)的條件下,考察不同提取時間(5,15,30,45和60 min)對魔芋多糖提取率的影響。
1.3.5.3 料液比對魔芋多糖提取率的影響
在固定微波功率420 W、提取時間30 min的條件下,考察不同料液比(1∶150,1∶175,1∶200,1∶225和1∶250 g/mL)對魔芋多糖提取率的影響。
1.3.6 響應面法優化提取條件
根據單因素試驗的結果,通過Design Expert 8.0軟件中的Box-Behnken設計,對提取條件進行優化,分析魔芋多糖的最佳提取條件[11-12]。
2 結果與分析
2.1 標準曲線的繪制
葡萄糖標準曲線見圖1,回歸方程為A=0.035 27C+0.145 4(R2=0.996 0),結果表明葡萄糖質量濃度與吸光度在5.138~15.413 μg/mL內線性關系良好。
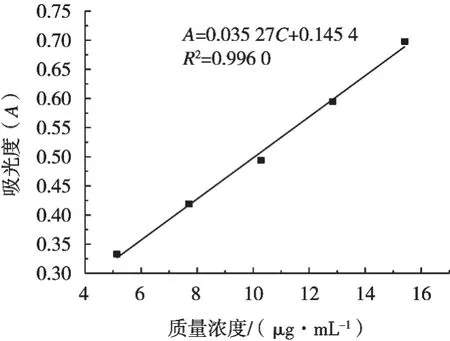
圖1 葡萄糖標準曲線
2.2 魔芋多糖提取條件單因素試驗
2.2.1 微波功率對魔芋多糖提取率的影響
由圖2可知,魔芋多糖提取率先隨微波功率升高而升高,微波功率達到420 W時,提取率最高。隨后微波功率繼續升高,提取率反而降低。這是由于微波功率較低時,小分子的物質先被浸提出來,而大分子的多糖類物質浸出較少,且速度較慢,隨著微波功率增大,多糖類物質的浸出速度加快,浸出量增多;微波功率繼續增大,多糖的水解速度也增大,從而使得魔芋多糖的提取率降低。而且微波功率過大,易使溶液爆沸,增加操作難度[13]。所以,微波功率選擇420 W。

圖2 微波功率對提取率的影響
2.2.2 提取時間對魔芋多糖提取率的影響
由圖3可知,魔芋多糖提取率隨著提取時間呈現先上升后下降趨勢,提取時間30 min時,提取率最高。微波提取時間較短,多糖無法完全溶出,因而提取率較低,在30 min時提取率最高,繼續延長微波提取時間,提取率降低,可能是由于魔芋多糖在提取30 min后,已基本溶出,繼續延長微波提取時間反而加劇多糖分解[14],使得提取率降低。所以,提取時間選擇30 min。
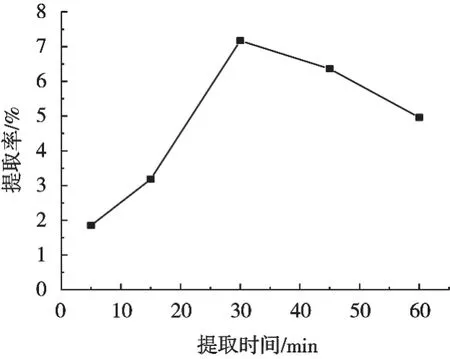
圖3 提取時間對提取率的影響
2.2.3 料液比對魔芋多糖提取率的影響
由圖4可知,料液比1∶225(g/mL)時,提取率最大,繼續提高料液比,提取率略有下降。料液比較低時,由于魔芋多糖是可溶性多糖,導致溶液黏度較大,分子溶出的阻力較大,提取不完全,因此提取率較低。隨著料液比增加,提取率顯著上升。料液比繼續增加,而提取時間保持不變,相當于增加微波能耗,因此提取率略有降低。所以,料液比選擇1∶225(g/mL)。

圖4 料液比對提取率的影響
2.3 響應面優化魔芋多糖的提取工藝
2.3.1 因素水平的設計
基于單因素試驗的結果,選擇微波功率、提取時間、料液比為自變量,魔芋多糖的提取率為響應值進行試驗設計,因素水平設計表見表1。

表1 響應面因素水平設計表
2.3.2 響應面試驗結果及分析
根據表1中響應面試驗方案,設計試驗及結果見表2,回歸方程方差分析見表3。
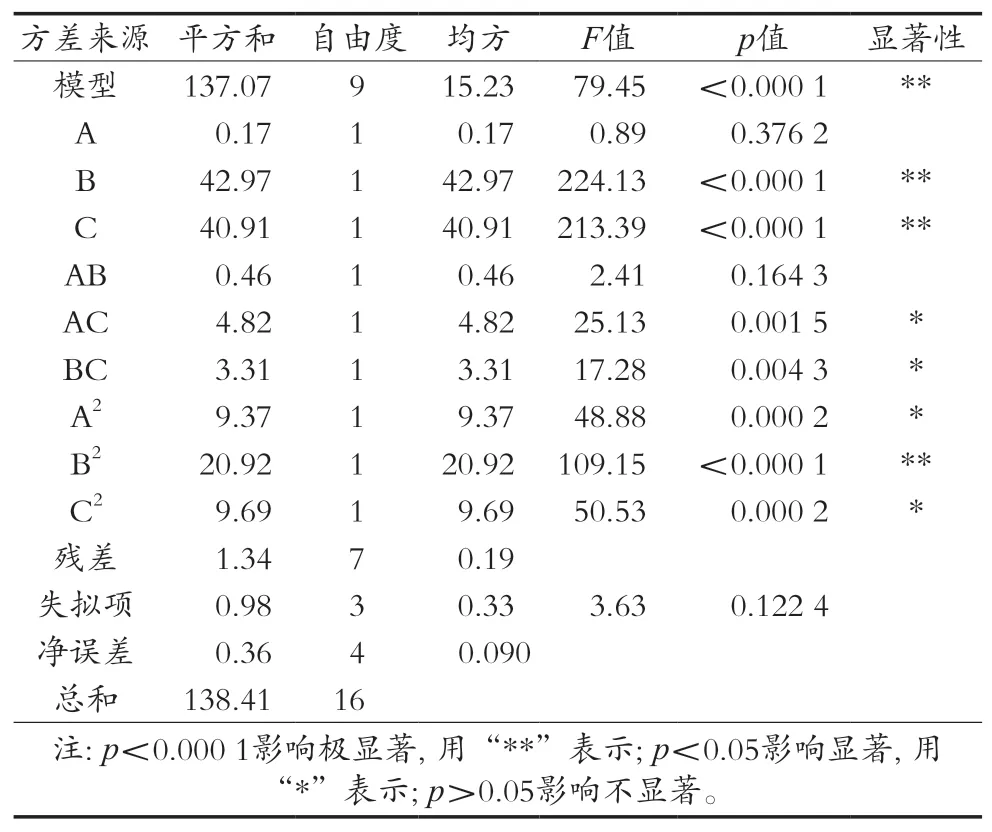
表3 回歸方程方差分析
從響應面結果分析來看,該模型的p值小于0.000 1,說明該回歸模型具有顯著差異,失擬項p值大于0.05,表示該回歸模型影響極顯著,與試驗擬合良好,可用于魔芋多糖的提取優化[15]。在該模型中,自變量B、C、B2對魔芋多糖提取率的影響極顯著,說明提取時間和料液比對魔芋多糖的提取率影響大;自變量AC、BC、A2、C2對魔芋多糖提取率的影響顯著,說明微波功率和料液比的交互作用及提取時間和料液比的交互作用對魔芋多糖的提取率影響較大。魔芋多糖的提取率符合二次回歸方程為Y=15.38-0.15A+2.32B+2.26C-0.34AB-1.10AC+0.91BC-1.49A2-2.23B2-1.52C2(R2=0.990 3)。
2.3.3 響應面各因素交互作用分析
用Design Expert 8.0軟件對試驗結果進行響應曲面的分析,得出2個因素之間對魔芋多糖提取率的響應曲面圖和等高線圖,如圖5~圖7所示。
響應曲面和等高線圖反映2個因素交互作用對魔芋多糖提取率的影響,響應曲面越彎曲,表明影響越顯著;等高線圖形狀越接近橢圓形,表明影響越顯著。從圖5~圖7可以看出,AC與BC交互作用對魔芋多糖的提取率影響較為顯著,響應曲面坡度較大,等高線呈橢圓形,與回歸方程方差分析結果一致。從魔芋多糖提取率的二次回歸方程可以看出,在A、B、C這3項中,對魔芋多糖提取率影響順序為B>C>A。說明提取時間的影響最大,料液比次之,微波功率的影響最小。

圖5 微波功率和提取時間交互作用對提取率的影響

圖7 提取時間和料液比交互作用對提取率的影響
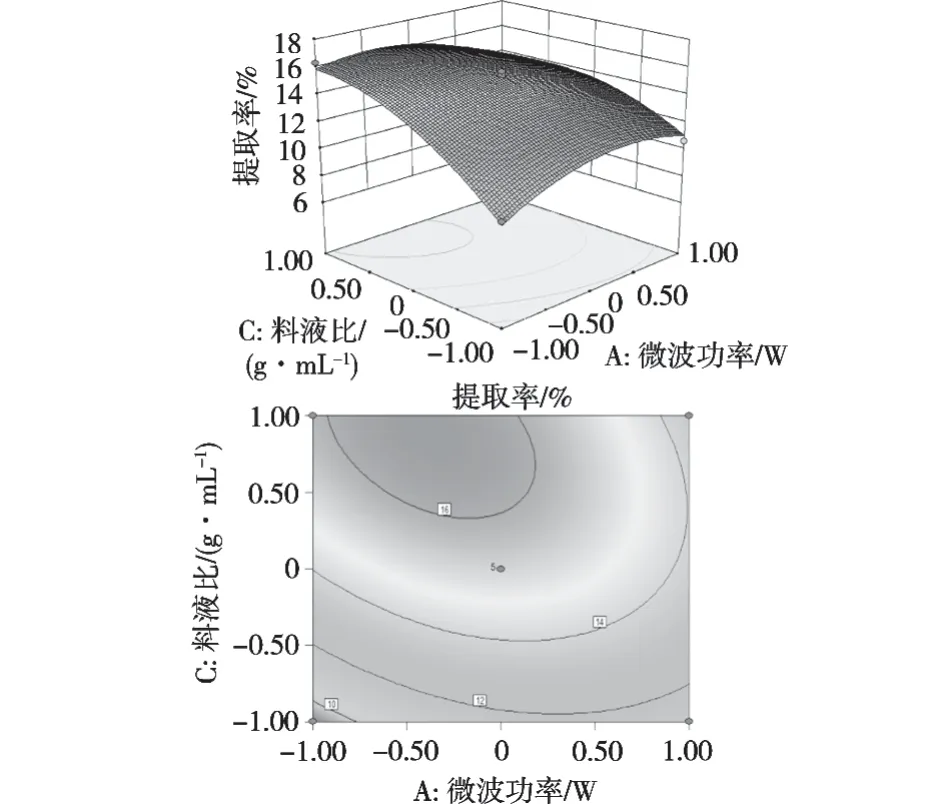
圖6 微波功率和料液比交互作用對提取率的影響
2.4 最佳提取條件驗證
通過響應面分析優化,使用Design Expert 8.0軟件對回歸方程進行計算,得到微波輔助提取魔芋多糖的最佳工藝:微波功率350 W、提取時間34.2 min,料液比1∶250(g/mL)。在此條件下模型預測的提取率為17.66%。在此基礎上,考慮到實際工作中的可操作性,確定最后的提取工藝為微波功率420 W、提取時間35 min、料液比1∶250(g/mL)。在此條件下進行3次平行試驗進行驗證,驗證試驗測得魔芋多糖的提取率為17.35%,與模型預測值接近,無顯著差異,表明響應面分析方法的模型選擇合適,可用于確定最佳提取試驗條件。
3 結論
魔芋多糖具有多種生物學活性及獨特性能,在食品、醫藥等各領域都有較大的開發應用價值。試驗選用提取效率高、提取速度快的微波輔助提取法提取魔芋中的多糖,在單因素試驗的基礎上,利用響應面分析對其提取條件進行優化,并依據試驗結果對提取率進行回歸擬合,分析得出的最佳提取條件為微波功率420 W、提取時間35 min、料液比1∶250(g/mL)。在此試驗條件下測得提取率為17.35%。試驗為魔芋多糖的提取開發與利用提供一定理論基礎。

