借助數形結合 解答化學難題
王士杰
(安徽省桐城中學 231400)
高中化學習題靈活多變.為使學生掌握運用數形結合思想解答不同習題的技巧,應結合自身經驗做好經典習題的積累,并在課堂上與學生一起分析,拓展學生視野的同時,養成運用數學結合思想解題的良好習慣.
一、借助數形結合,解答實驗類型的習題
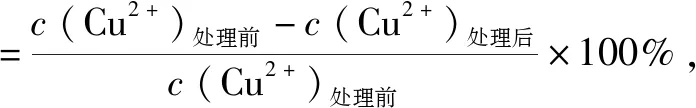
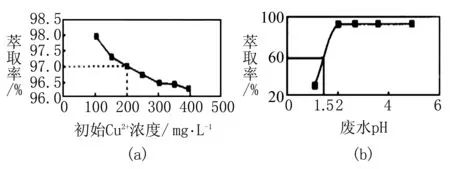
圖1
A.由圖1(a)可知,廢水中初始Cu2+濃度越大,萃取效果越好
B.由圖1(b)可知,初始廢水pH>2,去除Cu2+的效果較好
C.由圖1(a)可知,Cu2+初始濃度為200mg/L時,Cu2+的萃率為97%
D.由圖1(b)可知,取初始濃度為200mg/L的Cu2+800mL,在pH=1.5條件下進行處理,假設體積不發生變化,則處理后廢水中剩余Cu2+的物質的量為1.5×10-3mol
該題目的難點在于學生看不懂圖,無法應用給出的新定義進行相關的計算.事實上,只要認真讀圖不難解答.
由圖1(a)可知,隨著初始Cu2+濃度的增加,萃取率下降,且當初始濃度為200mg/L時對應的萃取率為97%.由圖1(b)可知,廢水pH>2時,Cu2+的萃取率接近100%.初始濃度為200mg/L的Cu2+800mL,Cu2+的物質的量為0.8L×0.2g/L/64g/L=2.5×10-3mol,由圖可知pH=1.5時,Cu2+的萃取率為60%,則去除的Cu2+的物質的量為:2.5×10-3mol×60%=1.5×10-3mol,因此,剩余的Cu2+的物質的量為1×10-3mol.綜上AD兩項是錯誤的.
二、借助數形結合,解答無機反應習題
例2將NaHCO3、Na2CO3混合后溶于水配成1L溶液.取50mL溶液,滴加一定物質的量濃度的鹽酸,得到如圖2所示的圖像,則( ).
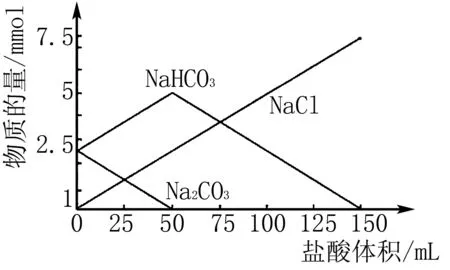
圖2
A.標注NaCl的直線可表示產生CO2的物質的量
B.原混合物中n(Na2CO3)∶n(NaHCO3)=1∶2
C.鹽酸的濃度為0.05mol/L
D.加入150mL鹽酸時放出標況下CO2的體積為2.24L
該習題的難點在于學生不能準確判斷NaHCO3、Na2CO3與HCl的反應順序,搞不清反應中物質的量之間的內在關系.

三、借助數形結合,解答化學平衡習題

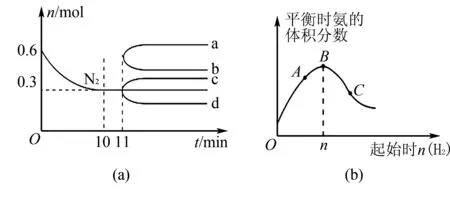
圖3
A.加入催化劑后ΔH<-92.6kJ/mol
B.11min只壓縮容器體積,N2物質的量變化為c曲線
C.0~10min內,該反應的反應速率為v(H2)=0.045mol/(L·min)
D.圖3(b)中A、B、C三點達到平衡時,B點N2的轉化率最高
該習題的難點在于學生對所學的化學平衡規律理解不深入,不能靈活的遷移所學知識.
A項,加入催化劑為加快反應速度,但并不引起平衡移動,反應焓也不會發生變化,錯誤.B項,11min只壓縮容器體積,壓強增大,由勒夏特列原理可知平衡正向移動,N2物質的量變小,d曲線是正確的,錯誤;C項,0~10min內,v(H2)=3v(N2)=3×[(0.6mol-0.3mol)/2L/10min]=0.045mol/(L·min),正確;D項,由圖可知A、B、C三點反應均達到平衡,要想N2的轉化率變高,則增加H2的物質的量,因此,C點時N2的轉化率最高,錯誤.綜上選擇C項.
四、借助數形結合,解答鹽類水解習題
例4 25℃條件下,將0.01mol/L的HCl逐滴滴加到10mL 0.01mol/L的NaCN溶液中,溶液中HCN和CN-濃度的百分數δ和溶液pH之間的關系如圖4(a)所示,pH變化曲線如圖4(b)所示.已知圖4(a)中a點坐標為(9.5,0.5),則溶液中的以下關系一定正確的是( ).
A.圖4(a)中pH=7的溶液:c(Cl-)=c(HCN)
B.常溫下,NaCN的水解平衡常數為K(NaCN)=10-4.5mol/L
C.圖4(b)中b點溶液中:c(CN-)>c(Cl-)>c(HCN)>c(OH-)>c(H+)
D.圖4(b)中c點溶液中:c(Na+)+c(H+)=c(HCN)+c(OH-)+c(CN-)
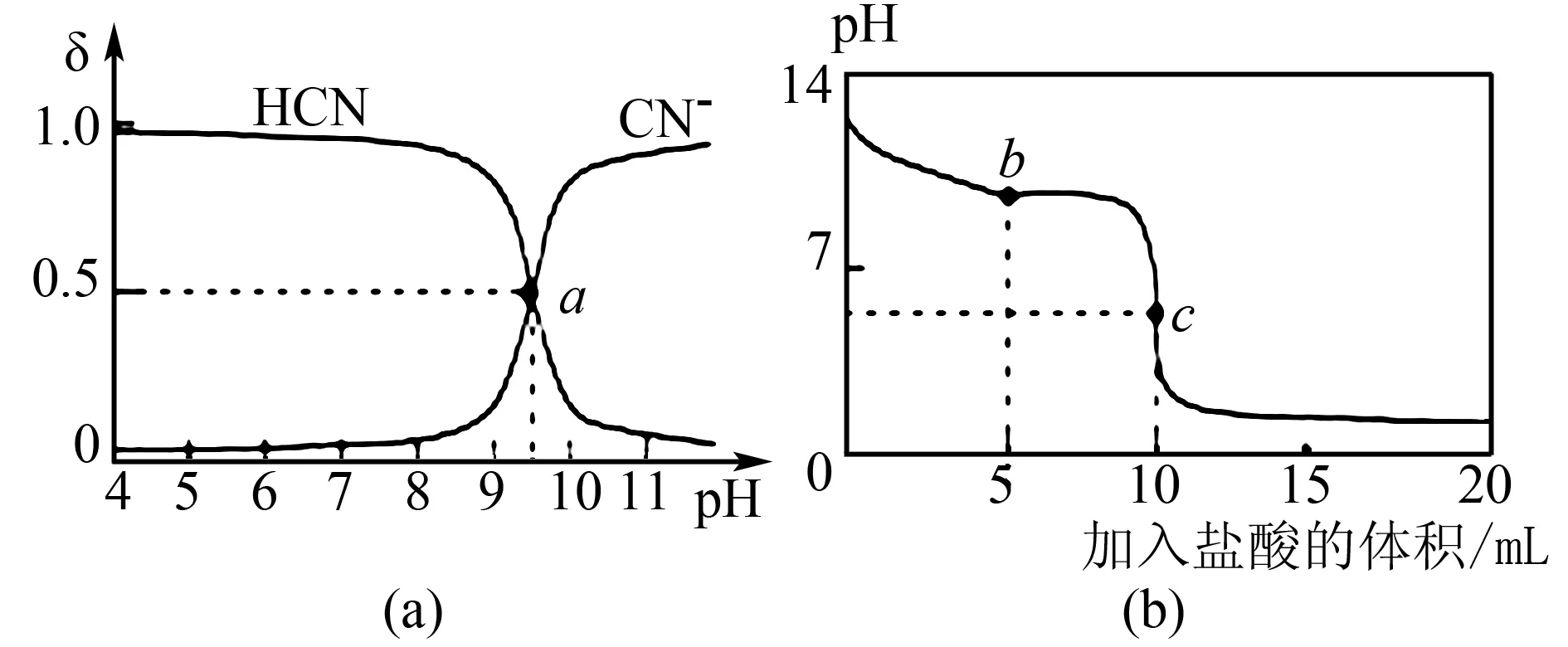
圖4
該習題的難點在于不能充分挖掘圖形中的隱含條件,無法構建兩個圖形之間的聯系.
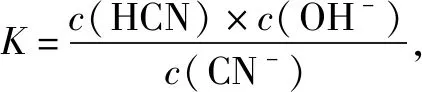
高中化學教學中為使學生能夠靈活運用數形結合思想解答相關習題,既要注重為學生講解讀圖的技巧,又要引導學生做好解題的總結,思考題目考查了哪些知識點,究竟難在何處,是如何進行突破的,并認真總結不同題型的高效解題方法,在以后的解題中能夠少走彎路,迅速破題.

