IL-6干預后人絨毛膜癌JEG-3細胞侵襲能力及MMP-2表達的變化
劉麗莎,張琳琳,袁恩武,石 瑛,杜紅梅,高峻峻,李 偉,張 展
鄭州大學第三附屬醫院檢驗科 鄭州 450052
人類成功的妊娠過程依賴于絨毛外滋養細胞(extravillous trophoblasts, EVT)對子宮結締組織和子宮螺旋動脈的侵襲作用,EVT侵襲能力降低可致母體血液無法充足地供應到絨毛間腔,妊娠期的多種不良結局由此引起[1-2]。已知基質金屬蛋白酶(matrix metalloproteinases,MMPs)可參與細胞侵襲過程[3-4]。Ⅳ型膠原是滋養細胞外基質的主要組成部分,又是MMP-2、MMP-9發揮水解作用的底物,因此MMP-2和MMP-9被認為是參與滋養細胞外基質降解從而實現細胞侵襲的重要蛋白酶[5-7]。多項研究[8-9]結果顯示,信號轉導及轉錄活化因子3蛋白(STAT3)在乳腺癌和胃癌細胞中參與調控下游靶因子MMP-2和MMP-9的表達。此外,Deshmukh等[10]的研究表明,IL-6可以上調乳腺癌細胞內磷酸化STAT3(p-STAT3)的表達,從而激活STAT3信號傳導通路,促進腫瘤細胞增殖和侵襲。人絨毛膜癌滋養細胞系JEG-3細胞的分子結構與EVT相似,多數學者采用該細胞系作為研究EVT侵襲功能的模型[11]。本研究中,我們首先觀察了STAT3活性抑制劑對JEG-3細胞STAT3及MMPs表達的影響,以驗證STAT3的作用通路,然后觀察了IL-6干預后,JEG-3細胞侵襲能力、STAT3及MMP-2、MMP-9表達的變化,旨在探討JEG-3細胞侵襲能力改變的機制,進一步探索由EVT侵襲能力失調導致不良妊娠的機制。
1 材料與方法
1.1 細胞來源與主要試劑JEG-3細胞購自中國北京鼎國昌盛公司。DMEM-H培養基購自Genview公司,小牛血清由Sigma公司提供,STAT3活性抑制劑(SD-1008)為R&D公司產品,IL-6購自Peprotech公司,侵襲小室購自康寧公司,熒光定量PCR試劑購自北京康為世紀公司,STAT3、MMP-9鼠抗人一抗[可同時檢測MMP-9酶原前體蛋白(Pro-MMP-9)和MMP-9活化蛋白(Active-MMP-9)]及p-STAT3兔抗人一抗購自美國CTS公司,MMP-2兔抗人一抗[可同時檢測MMP-2酶原前體蛋白(Pro-MMP-2)及MMP-2活化蛋白(Active-MMP-2)]購自美國Abcam公司,β-actin鼠抗人一抗購于北京中杉金橋生物技術有限公司。
1.2 細胞培養與實驗分組JEG-3細胞用含體積分數10%小牛血清的DMEM-H培養基,在37 ℃、體積分數5% CO2條件下培養。取對數生長期的細胞,胰蛋白酶消化后,調整細胞密度為0.6×106個/mL,接種于6孔板中,每孔加2.5 mL細胞懸液,繼續孵育24 h。實驗1分為空白對照組和抑制劑組(5 μmol/L SD-1008);實驗2分為空白對照組和IL-6組(10 μg/L IL-6)。
1.3 STAT3活性抑制劑對JEG-3細胞中STAT3、p-STAT3及MMP-2、MMP-9表達的影響收集按實驗1分組處理24 h的細胞[12],加入蛋白提取液提取總蛋白。吸取80 μg蛋白置于微量EP管內進行加熱預變性,之后加入凝膠孔,進行電泳、切膠、轉膜、封閉、洗膜。之后在冷庫分別與一抗(β-actin、STAT3、MMP-2、MMP-9抗體按1∶1 000稀釋,p-STAT3抗體按1∶2 000稀釋)孵育12 h。然后洗膜3遍,與HRP標記的二抗孵育1 h,再次洗膜后經ECL發光液顯像、膠片曝光定影。采集圖像,經Gel Logic 2000系統讀取條帶灰度值。以目的蛋白條帶與內參條帶灰度值之比為目的蛋白的相對表達量。實驗重復6次。
采用熒光定量PCR檢測MMP-2、MMP-9 mRNA的表達。用離心管收集按實驗1分組處理24 h的細胞,用Trizol試劑提取總RNA,反轉錄得cDNA。然后按試劑說明書進行PCR,反應體系為20 μL,擴增條件:95 ℃10 min;95 ℃15 s;60 ℃1 min;共35個循環。選擇36B4為內參,引物序列見表1,引物由上海生工生物工程有限公司合成。使用2-ΔΔCt法計算MMP-2、MMP-9 mRNA的表達水平。實驗重復6次。

表1 熒光定量PCR的引物及產物長度
1.4 IL-6對JEG-3細胞增殖能力、侵襲能力以及STAT3、MMP-2、MMP-9表達的影響
1.4.1IL-6對JEG-3細胞增殖能力的影響 收集按實驗2分組處理36 h后的細胞,加入MTT試劑,繼續孵育4 h。棄去培養孔中的液體,加入0.2 mL DMSO,在搖床中搖動10 min。用酶標儀讀取每孔在490 nm波長處的光密度(OD)值,用以評估細胞增殖能力。實驗重復6次。
1.4.2IL-6對JEG-3細胞侵襲能力的影響 采用無血清培養基調整JEG-3細胞密度為2.5×105個/mL,按實驗2分組處理后,將200 μL細胞懸液加至Transwell小室上室,加入750 μL完全培養基,放回溫箱中繼續孵育36 h。采用PBS溶液洗膜,再經固定、透化和染色,最后置于顯微鏡下計數穿膜細胞。每個小室計數8個視野(×200),取均值。實驗重復6次。
1.4.3IL-6對JEG-3細胞中STAT3活化的影響 用無血清培養基孵育JEG-3細胞6 h后,按實驗2分組干預,干預后10、30、60 min提取蛋白,檢測JEG-3細胞中p-STAT3蛋白的表達[13],檢測方法同1.3中Western blot實驗。實驗重復6次。
1.4.4IL-6對JEG-3細胞中MMP-2、MMP-9表達的影響 JEG-3細胞按實驗2分組處理36 h后,同1.3中方法分別檢測細胞中MMP-2、MMP-9蛋白及mRNA的表達。實驗重復6次。
1.5 統計學處理使用SPSS 17.0 分析數據。采用兩獨立樣本t檢驗分析空白對照組和抑制劑組細胞中STAT3、p-STAT3、MMP-2、MMP-9表達的差異以及空白對照組和IL-6組細胞增殖能力、侵襲能力及p-STAT3、MMP-2、MMP-9表達的差異。檢驗水準α=0.05。
2 結果
2.1 STAT3活性抑制劑對JEG-3細胞STAT3、MMPs表達的影響STAT3活性抑制劑SD-1008干預24 h,JEG-3細胞中p-STAT3蛋白表達量降低,MMP-2、MMP-9 mRNA及蛋白表達量亦降低(Active-MMP-9條帶灰度值過低,未進行數據分析)。見圖1、表2。
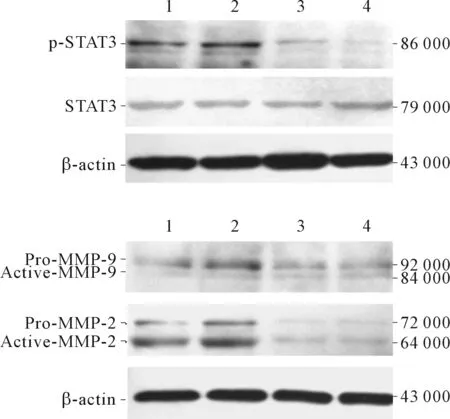
1、2:空白對照組;3、4:抑制劑組

表2 STAT3活性抑制劑對JEG-3細胞STAT3、MMPs表達的影響
2.2 IL-6對JEG-3細胞增殖能力和侵襲能力的影響與空白對照組相比,IL-6組JEG-3細胞增殖能力無明顯變化,但侵襲能力增強。見表3。
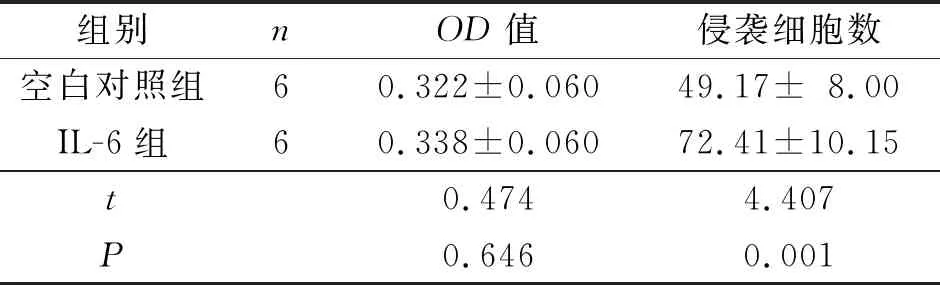
表3 IL-6對JEG-3細胞增殖能力和侵襲能力的影響
2.3 IL-6對JEG-3細胞p-STAT3表達的影響與空白對照組相比,IL-6組JEG-3細胞中p-STAT3的表達量在3個時間點均無明顯改變(因p-STAT3蛋白灰度值均過低而未行數據分析)(圖2)。
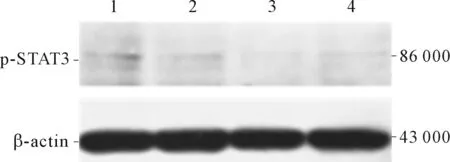
1:空白對照組,2、3、4:分別為IL-6干預10、30、60 min
2.4 IL-6對JEG-3細胞MMPs mRNA、蛋白表達的影響與空白對照組相比,IL-6組細胞中Active-MMP-2蛋白表達量增加,但MMP-2、MMP-9 mRNA及Pro-MMP-2、Pro-MMP-9蛋白的表達量無明顯改變(Active-MMP-9條帶灰度值過低,未進行數據分析)(圖3、表4)。
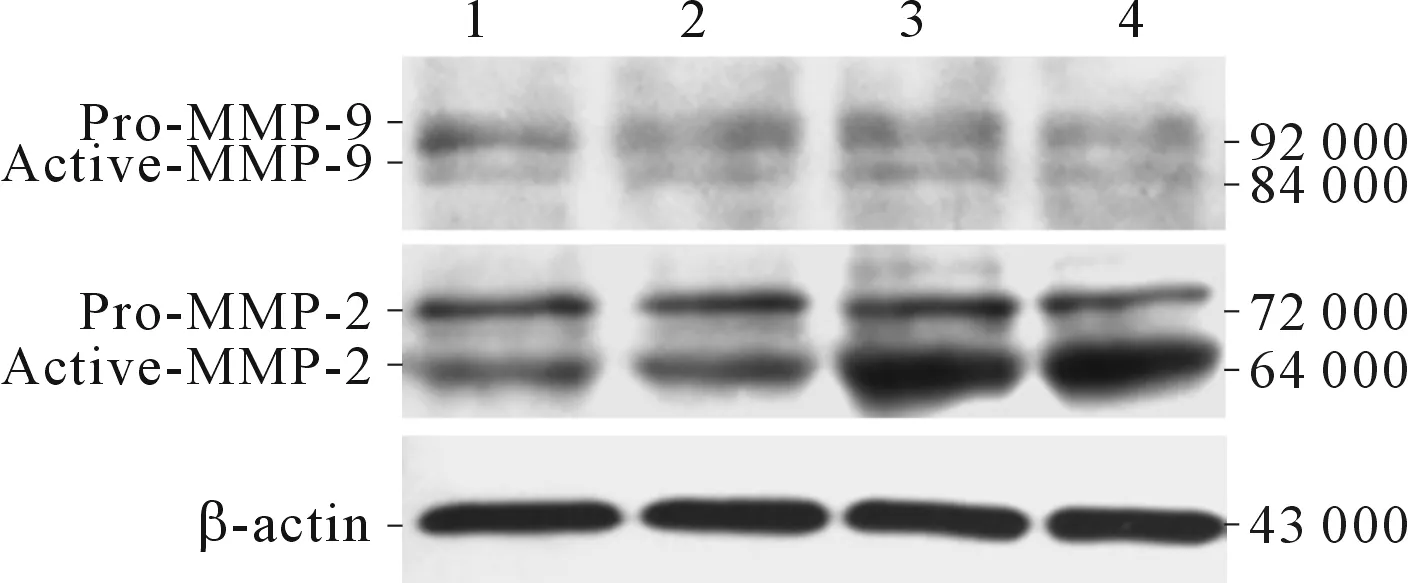
1、2:空白對照組;3、4:IL-6組
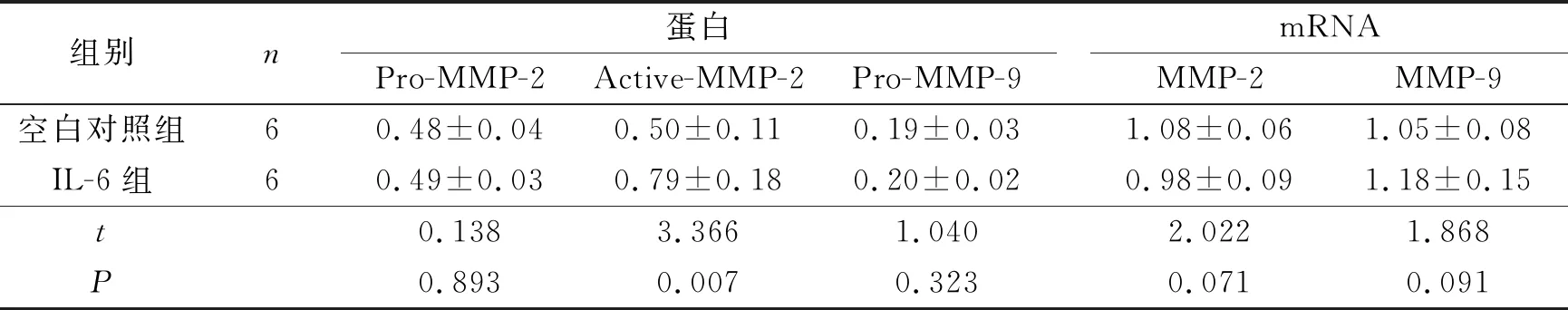
表4 IL-6對JEG-3細胞MMPs蛋白、mRNA表達的影響
3 討論
研究[14-15]顯示,STAT3與非小細胞肺癌、人結腸癌的侵襲有關。STAT3信號通路是調節細胞侵襲功能的重要途徑之一,通過激活胃癌細胞中STAT3的磷酸化可以增加細胞的侵襲能力并上調細胞中MMPs的表達;而抑制乳腺癌細胞中STAT3介導的信號通路,可下調MMPs的表達并降低細胞的侵襲性[8,16]。有證據[17]表明,抑制鼠類STAT3基因的轉錄及磷酸化,其妊娠過程受到了嚴重阻礙。SD-1008是一種能直接阻斷JAK/STAT3信號通路的抑制劑[18]。本研究中,采用SD-1008對JEG-3細胞進行干預后,細胞中p-STAT3、MMP-2、MMP-9蛋白及MMP-2、MMP-9 mRNA的表達下降,由此推測STAT3可能是EVT中MMP-2和MMP-9的上游調控因子之一。
白血病抑制因子(leukemia inhibitory factor,LIF)和IL-11已被證實分別通過STAT3信號轉導通路進行細胞內信號的級聯傳遞,從而調節EVT和腫瘤細胞的侵襲能力[19-20]。IL-6與這些因子都屬于“IL-6細胞因子超家族”的成員,都以細胞膜的gp130結合蛋白作為受體進行細胞內外信號的傳遞。本研究探討了外源性IL-6對JEG-3細胞的影響,發現10 μg/L IL-6刺激36 h后,JEG-3細胞侵襲能力明顯升高。但是,Fitzgerald等[21]的研究數據表明IL-6對JEG-3細胞的侵襲能力沒有明顯影響,可能的原因是IL-6濃度以及作用時間不同。本研究中MTT實驗結果顯示,10 μg/L IL-6對JEG-3細胞的增殖能力無明顯影響,排除了細胞增殖能力的改變對侵襲實驗的影響,進一步證實了IL-6可以提高JEG-3細胞的侵襲性。另外有研究[22-23]發現,IL-6對其他EVT(如HTR-8/Svneo細胞系和AC-1M88細胞系)有著相似的侵襲和趨化能力增強作用。因此我們認為,一定濃度的IL-6對維持和增加EVT的侵襲性有著重要的作用。
與預期實驗結果不同的是,JEG-3細胞經IL-6干預后的侵襲能力增加,但是p-STAT3、Pro-MMPs的表達水平無顯著變化,這說明雖然STAT3信號轉導通路對JEG-3細胞中MMPs的表達有重要調節作用,但是IL-6并未通過該信號轉導通路調節JEG-3細胞的侵襲能力。同時我們發現,IL-6干預后的JEG-3細胞中活化形式的MMP-2(Active-MMP-2)表達水平升高,這點讓我們感到意外,因為MMPs在合成時多以酶原的形式存在,一般通過從前體形式釋放抑制性前肽域而被激活才能獲得降解細胞外基質和基底膜的能力[4,24]。另外,Feng等[25]發現IL-6可以通過Raf-MAPK-ERK1/2通路上調細胞內MMP14的表達;而文獻[26]表明MMP-2的活化與細胞表面MT1-MMP(MMP14)的調控密切相關。結合本研究結果,我們推測IL-6刺激滋養細胞MMP-2活化的機制可能與上調MT1-MMP有關,有待后續進一步深入研究。
綜上所述,STAT3可能是誘導JEG-3細胞表達MMP-2和MMP-9的關鍵上游調控因子之一;但是IL-6并未通過該通路調節其侵襲能力,而是可能通過其他信號轉導通路增強細胞中MMP-2的活化而上調滋養細胞的侵襲能力。

