DGCR8基因對小鼠生長受限的影響
田捧,郭玉琪,郭智寬
(1.鄭州大學第三附屬醫院 a.超聲科;b.中醫科,河南 鄭州 450052;2.河南省人民醫院 婦產科,河南 鄭州 450003)
胎兒生長受限(fetal growth restriction,FGR)是指足月胎兒出生體質量小于2 500 g,或胎兒體質量低于同孕齡平均體質量的兩個標準差,或低于同孕齡正常體重的第十百分位數[1]。FGR不但影響胎兒的生長發育,還會導致青少年期的體格和智力發育受損,甚至可能發生腦性癱瘓,成年后心血管、神經系統和代謝性疾病發病率升高[2-3]。很多因素可造成FGR,FGR的發病機制一直是產科、兒科等相關領域的研究熱點。DGCR8是參與miRNA合成與成熟的重要蛋白,可調控miRNA的生成,影響miRNA對基因的調控作用[4]。miRNA是近年新發現的一種非編碼RNA,是一類長約22個核苷酸的非編碼的單鏈RNA大家族,參與多種生物過程。近年研究表明,miRNA在生長和發育中扮演著重要角色[5]。miRNA與FGR存在相關性。因此,本研究推測可以通過干預DGCR8的表達,調控miRNA的表達,分析DGCR8對胎兒生長發育的影響。本研究為FGR的治療和產前篩查找到新的靶點,具有重要的理論意義和臨床應用價值。
1 材料與方法
1.1 主要試劑和實驗儀器DMEM培養基、胎牛血清(fetal bovine serum,FBS)、青霉素、硫酸鏈霉素均購自美國Life Technologies公司,胰蛋白酶、兔抗DGCR8多克隆抗體、兔抗磷酸化的細胞外調節蛋白激酶(phospho-extracellular regulated kinase,p-ERK)多克隆抗體均購自美國Centocor公司,蛋白提取試劑盒、蛋白裂解液(radio immunoprecipitation assay,RIPA)均購自美國Pieree公司,離心機(型號M162856)、蛋白印跡電泳儀(型號BLY-DYCP-38C)、蛋白印跡轉膜儀(型號1704150)。
1.2 實驗動物動物實驗方案經美國田納西大學動物管理委員會審核通過。選用同一窩出生的14日齡的轉基因小鼠(品系批次:C57BL/6SvJ,小鼠模型由美國田納西大學科學健康中心郭玉琪與岳軍明教授聯合共建實驗室提供),在SPF級、溫度保持在22~28 ℃、相對濕度維持在40%~60%的動物房飼養。
1.3 可誘導型DGCR8基因敲除小鼠的制備選用可誘導型的Cre轉基因小鼠,該Cre酶的表達由可誘導型的β-actin啟動子控制,并含有雌激素受體序列,對他莫昔芬敏感,可通過控制他莫昔芬的劑量對小鼠進行可誘導性基因敲除。將含有β-actin-Cre-ERT2啟動子的轉基因小鼠和DGCR8loxp/loxp小鼠交配,獲得DGCR8loxp/loxp/actin-cre和DGCR8loxp/loxp小鼠[以上小鼠的基因型均由聚合酶鏈反應(polymerase chain reaction,PCR)檢測確認]。將兩種不同基因型的同一窩出生的小鼠分為對照組和實驗組進行飼養(共選擇3窩小鼠重復實驗,第1窩符合實驗基因型要求的共4組8只,第2窩3組6只,第3窩3組6只),實驗組和對照組小鼠均在小鼠生后第14天注射4 mg他莫昔芬(揚子江藥業集團有限公司,08022501)[6-7],選擇14日齡生長發育旺盛期的小鼠進行實驗。首次稱14日齡小鼠的體質量,以后每3 d對兩組小鼠分別進行稱重,記錄數據。
1.4 Mef細胞的制備取基因型分別為DGCR8loxp/loxp和DGCR8loxp/loxp/actin-cre小鼠胚胎(PCR反應檢測小鼠胚胎的基因型,體系由基因組DNA、引物、PCR buffer、25 mmol·L-1MgCl2、2 mmol·L-1dNTP、ddH2O和Taq酶組成。反應條件為95 ℃退火,55 ℃復性,75 ℃延伸,進行30個循環。所得產物經1.2%瓊脂糖凝膠電泳,EB染色,于紫外燈下觀察結果)。新鮮小鼠胚胎在37 ℃酶消化液中孵育8~10 min,在DMEM培養基中清洗3次,置于37 ℃,體積分數為5% CO2細胞培養箱中孵育1 h,用巴氏吸管反復吹打組織,使組織塊均勻分散成細胞層,1 500 r·min-1離心5 min,棄去上清,加入DMEM培養基重懸細胞,重復3次后,加入DMEM培養基(10% FBS+1%青鏈霉素)將細胞置于37 ℃,體積分數為5% CO2細胞培養箱中培養。
1.5 Western blot在基因型為DGCR8loxp/loxp和DGCR8loxp/loxp/actin-creMef細胞中分別加入他莫昔芬,他莫昔芬按能敲除DGCR8基因的最低劑量0.5 μmol·L-1的濃度添加。待細胞生長密度達到80%~100%時,刮下細胞并轉移至1.5 mL離心管,加入80~100 μL裂解液,冰上裂解10 min,13 000 r·min-1離心10 min,取上清液保存于-80 ℃冰箱。1.5 mL離心管中加入800 μL ddH2O和200 μL Protein Assay Dye Reagent,加入1 μL蛋白樣品,混勻后用紫外分光光度計檢測595 nm波長條件下吸光度值,根據標準曲線計算蛋白含量。處理好的蛋白樣品,按照每孔40~100 μg上樣,濃縮膠80~100 V電泳,分離膠100~120 V電泳。電泳結束后,將蛋白樣品轉移至NC膜或PVDF膜,25 V轉膜2 h,5%脫脂乳封閉1 h,加一抗4 ℃孵育過夜,PBST洗膜3遍后加二抗孵育1 h,顯影,定影,曝光條帶。
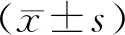
2 結果
2.1 他莫昔芬篩選的最低劑量Western Blot結果顯示,當加入濃度為0.5 μmol·L-1他莫昔芬時,DGCR8基因已經被完全敲除。見圖1。
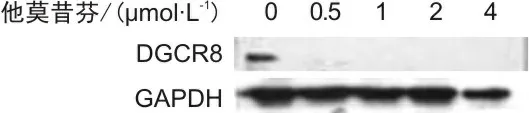
圖1 加入不同濃度的他莫昔芬處理Mef細胞48 h DGCR8基因敲除效果
2.2DGCR8基因敲除小鼠生長速度DGCR8基因敲除組小鼠生長發育速度低于對照組小鼠,差異有統計學意義(P<0.05)。見表1、圖2。
表1 實驗組和對照組小鼠體質量比較
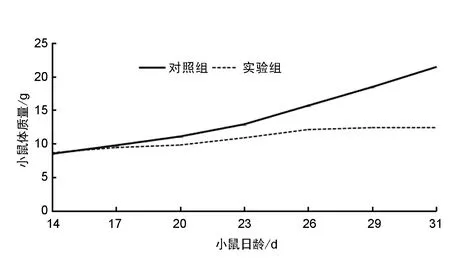
圖2 實驗組和對照組小鼠生長曲線
2.3DGCR8基因敲除小鼠p-ERK1/2、PCNA蛋白表達水平Western blot結果顯示,DGCR8基因敲除組p-ERK1/2、PCNA蛋白的表達低于對照組,差異有統計學意義(P<0.05)。見圖3、4。
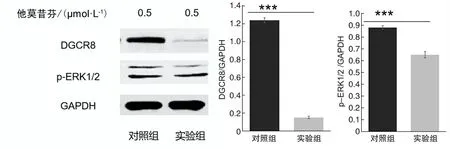
圖3 實驗組和對照組p-ERK1/2的表達
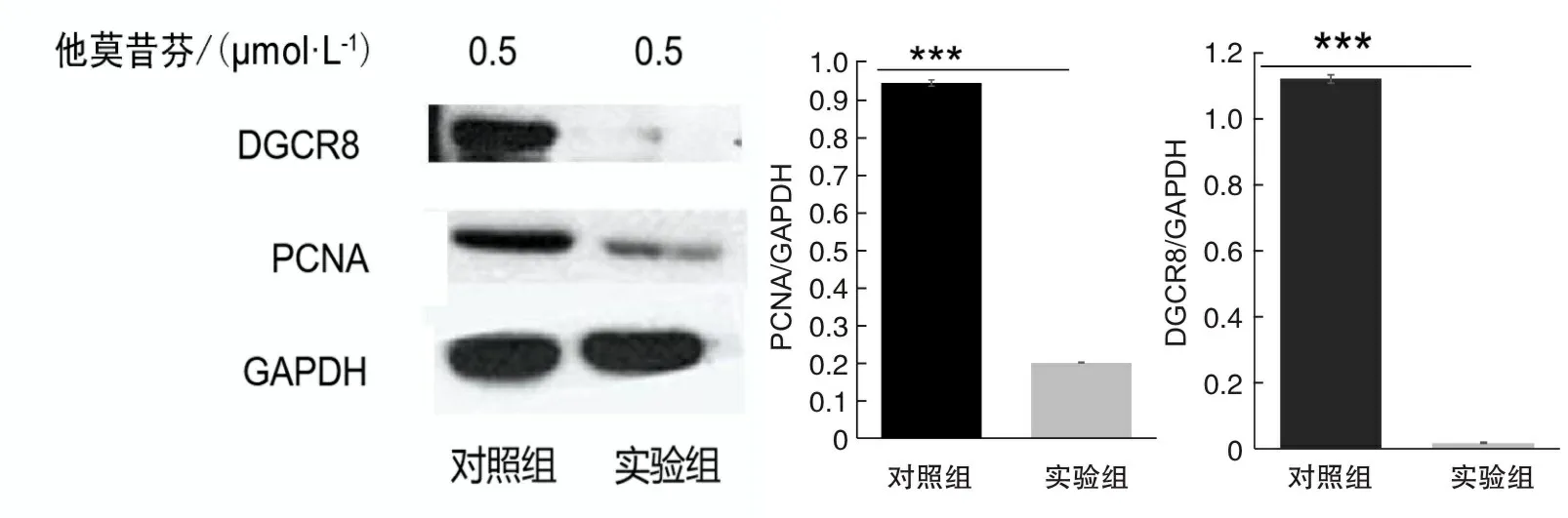
圖4 實驗組和對照組PCNA的表達
3 討論
FGR是產科的嚴重并發癥,我國FGR的發生率為6.39%,可導致圍生兒發病率增高4~6倍[8],是導致圍生兒死亡的主要原因之一[9],能導致早產、窒息以及腦癱等[10]。FGR是一種復雜的疾病,其病因多樣,迄今尚未完全闡明。
DGCR8是位于人類22號染色體q11.2區域的一個等位基因,是雙鏈miRNA結合蛋白,它與RNA酶Ⅲ Drosha相互作用,促進miRNA的成熟,影響miRNA對基因的調控作用[11]。研究顯示,miRNA參與調控胎兒發育和妊娠病理結局[12],miRNA的表達變化與FGR、胎膜早破、子癇前期和巨大兒等妊娠病理結局密切相關[13]。Maccani等[14]研究了人類胎盤中的 107個調節細胞生長與分化的miRNA,其中miR-16、miR-21、miR-93、miR-135b、miR-146a和miR-182與胎兒生長存在相關性。Mouillet等[15]對正常妊娠孕婦和妊娠合并FGR孕婦血漿中部分缺氧相關miRNAs的表達進行了比較,結果顯示,FGR組總miRNA表達較正常妊娠組高1.8倍。此外國內一項研究顯示,miR-210可能參與了FGR的發病,循環中miR-210可作為FGR診斷的生物標志物[16]。miRNA與FGR存在一定的相關性,循環中miRNA的表達可作為FGR診斷的生物標志物。基于以上理論,本研究推測DGCR8可能與FGR密切相關,但是目前國內外針對DGCR8與FGR的研究尚未見報道。本研究旨在探討DGCR8基因對FGR的影響及其作用機制,以期為FGR尋找到新的發病機制及基因靶點。
細胞外調節蛋白激酶是絲裂原活化蛋白激酶家族成員之一,被激活后成為p-ERK,可介導信號由胞漿向胞核傳遞,參與調節細胞的生長、發育、分化和凋亡等多種生理過程[17]。PCNA與細胞增殖狀態高度相關,是衡量細胞增殖能力的重要標志物[18]。本研究構建DGCR8基因敲除小鼠并提取DGCR8基因敲除Mef細胞,結果顯示DGCR8基因敲除小鼠出現了生長發育遲緩,DGCR8基因敲除Mef細胞中p-ERK、PCNA細胞信號通路蛋白表達下降,因此我們推測DGCR8通過調控p-ERK、PCNA的表達影響細胞的生長、增殖、分化等,從而影響小鼠的生長發育,DGCR8與生長受限存在相關性。然而本研究只是在小鼠和細胞水平進行了初步的驗證,其在胎兒體內的表達水平是否存在差異,還需要臨床實驗進一步研究。
綜上所述,DGCR8基因敲除小鼠生長受限,發育遲緩,DGCR8可能是通過調控Mef細胞中p-ERK、PCNA相關信號通路來發揮作用。據此,我們有望通過檢測母體血清或相關組織中DGCR8的表達,預測胎兒宮內生長受限,以便臨床早期采取有效的干預措施,從而為胎兒宮內生長受限的早期診斷、預防、治療提供新的思路。

