卒中后抑郁患者血清miR-223-3p和HMGB1的表達及診斷價值
樊軍,樊建軍
(魯山健民醫院 內科,河南 平頂山 467300)
卒中后抑郁(post-stroke depression,PSD)是一種與卒中發病相關的情感障礙疾病,以卒中發病數周至數年后出現卒中癥狀以外的持續性情緒低落、興趣減退等抑郁癥狀為特征,是缺血性卒中常見的并發癥之一[1]。PSD的發病率為25%~79%,其發病與卒中不良預后相關[2-3]。然而PSD的發病機制尚不清楚,神經炎癥、胺假說和神經遞質等多種因素均可能參與PSD的發病[4]。微小RNAs(microRNAs, miRNAs, miRs)不僅可參與調節炎癥反應和神經發育[5],還在抑郁和自殺行為中起著關鍵作用,循環中的某些miRNAs可作為嚴重抑郁癥等精神疾病潛在的新的血液標志物[6]。研究發現miR-223-3p參與調控趨化因子信號傳導[7]等多種炎癥反應過程。炎癥與卒中患者神經功能缺損癥狀和PSD發病均存在相關性,但目前尚無有關miR-223-3p與PSD的相關性研究。高遷移率組蛋白Box1(high-mobility group box-1,HMGB1)是一種新的細胞因子樣核蛋白,卒中發生后其立即從缺血組織的壞死細胞釋放并激活早期的炎癥反應,其濃度與腦損傷后疾病的嚴重程度和預后相關[8]。而卒中患者HMGB1水平升高是否與PSD發病有關,目前也無相關研究。鑒于此,本研究旨在觀察并分析miR-223-3p及HMGB1在PSD患者血清中的表達情況,探討將miR-223-3p及HMGB1作為PSD診斷的生物標志物的可能性。
1 資料與方法
1.1 一般資料選取2018年6月至2019年6月魯山健民醫院收治的159例急性缺血性卒中患者作為研究對象,其中男101例,女58例,年齡32~86歲,平均(62.21±10.56)歲。依據住院治療期間或隨訪時是否發生PSD癥狀將患者分為PSD組(51例)和非PSD組(108例)。
1.2 選取標準(1)納入標準:①急性缺血性腦卒中的診斷符合《中國急性缺血性腦卒中診治指南2018》[9]的診斷標準,并在入院后24 h內經頭顱磁共振成像(magnetic resonance imaging,MRI)檢查確診;②首次發病,且在發病后12 h內入院;③PSD的診斷符合中國精神障礙分類及診斷標準(CCMD-3)[10],且由2名受過量表評估培訓的臨床醫生對所有患者進行漢密爾頓抑郁量表17(Hamilton depression scale-17,HAMD-17)評估,HAMD-17≥7分為抑郁癥[11];④年齡>18歲;⑤良好配合完成抑郁評估量表且完成隨訪;⑥簽署知情同意書。(2)排除標準:①有抑郁癥、精神分裂癥等精神疾病;②有認知障礙或意識障礙;③有急、慢性感染性疾病;④近期應用糖皮質激素或免疫抑制劑;⑤服用氯丙嗪、丙戊酸鈉等可能導致抑郁或加重抑郁的藥物;⑥合并惡性腫瘤等其他嚴重疾病。
1.3 miR-223-3p和HMGB1的檢測方法收集患者入院后次晨的空腹血液10 mL至 EDTA抗凝管中,立即將血樣以800 g,4 ℃低溫離心15 min,吸取上層血清分裝至EP管中,并儲存在-80 °C冰箱。通過RT-PCR法檢測患者血清miR-223-3p的相對表達量,具體如下。采用mirVanaRNA分離試劑盒(Applied Biosystem,美國)分離并純化總血清RNA。采用Nanodrop 2000分光光度計(Thermo Fisher Scientific,美國)對每個RNA樣本濃度及純度進行檢測,取A260/A280值在1.8~2.1且經RNA完整性鑒定(基于瓊脂糖凝膠電泳)合格的RNA樣品進行后續實驗。采用HiScript Ⅱ RT SuperMix for qPCR逆轉錄試劑盒(南京諾唯贊生物科技有限公司,中國)將提取出的總RNA按500 ng、10 μL體系進行cDNA逆轉錄,反應條件為50 ℃ 15 min,85 ℃ 10 s;取1 μL cDNA、5 μL 2×ChamQ SYBR qPCR Master Mix(南京諾唯贊生物科技有限公司,中國)和miR-223-3p特異性前向、逆向引物(10 μmol·L-1)各0.2 μL,按說明書完成反應體系的配置,采用ABI 7500熒光定量 PCR機(Thermo Fisher,美國)進行檢測。miR-223-3p的引物序列為前向:5’-GGGGTGTCAGTTTGTCAAA-3’,逆向:5’-GTGCGTGTCGTGGAGTCG-3’。U6的引物序列為前向:5’-GCTTCGGCAGCACATATACTAAAAT-3’, 逆向:5’-CGCTTCACGAATTTGCGTGTCAT-3’。每個PCR樣本重復3次,采用2-△△Ct相對定量法對miR-223-3p的相對表達量進行計算。采用人HMGB1 ELISA試劑盒(上海信裕生物科技有限公司,中國)以雙抗體夾心法檢測患者血清HMGB1水平,依照配套說明書進行檢測。
1.4 隨訪所有患者接受門診隨訪,完成為期 1 a的隨訪。隨訪開始時間為急性缺血性腦卒中確診時間,隨訪截止時間為發病后1 a,以PSD為終點事件。
1.5 觀察指標(1)患者的一般臨床資料,包括性別、年齡、受教育年限、吸煙史、飲酒史、高血壓史、糖尿病史和體質量指數(body mass index,BMI)。(2)患者入院后次晨空腹血液送檢的血常規、甘油三酯(triglyceride,TG)、低密度脂蛋白膽固醇(low density lipoprotein cholesterol,LDL-C)、總膽固醇(total cholesterol,TC)、高密度脂蛋白膽固醇( high density lipoprotein cholesterol,HDL-C)、空腹血糖( fasting blood glucose,FBG)等常規實驗室檢查結果。(3)急性缺血性卒中患者梗死灶的位置、TOAST病因分型及入院時的美國國立衛生研究院卒中量表(National Institute of Health stroke scale, NIHSS)評分結果。
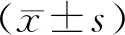
2 結果
2.1 患者臨床資料兩組患者在年齡、性別、受教育年限、高血壓史、BMI、飲酒史、吸煙史、TC、TG、LDL-C、HDL-C、梗死灶部位及TOSAT分析方面的比較,差異均無統計學意義(P>0.05);PSD組患者NIHSS評分及HMGB1水平高于非PSD組,miR-223-3p相對表達量低于非PSD組(P<0.05)。見表1。

表1 兩組患者臨床資料比較
2.2 卒中患者發生PSD的危險因素分析將表1中有差異的指標納入多因素logistic回歸分析(α入=0.05,α出=0.10)尋找PSD的危險因素,以是否發生抑郁(0=無抑郁,1=抑郁)為因變量,以miR-223-3p、NIHSS評分及HMGB1水平為自變量。結果顯示,miR-223-3p相對表達量降低及NIHSS評分和HMGB1水平升高是卒中患者發生PSD的獨立危險因素(P<0.05)。見表2。

表2 卒中患者PSD發病的危險因素分析
2.3 卒中患者血清miR-223-3p、NIHSS評分及HMGB1間相關性分析Pearson相關檢驗結果提示,卒中患者血清miR-223-3p與HMGB1水平(r=-0.606,P<0.001)和NIHSS評分(r=-0.553,P<0.001)均呈負相關,HMGB1與NIHSS評分(r=0.566,P<0.001)呈正相關。
2.4 卒中患者血清miR-223-3p和HMGB1水平對PSD發病的診斷價值分析ROC曲線分析miR-223-3p和HMGB1水平對卒中患者PSD發病的診斷價值的結果顯示,兩者ROC曲線下面積分別為0.796和0.775,兩指標的靈敏性較高但特異性稍低。聯合miR-223-3p和HMGB1兩指標對PSD發病的診斷價值進行評估時,靈敏性提升至88.2%、特異性提升至73.2%,約登指數上升為0.577。見表3。

表3 卒中患者血清miR-223-3p和HMGB1對PSD發病的診斷價值

圖1 卒中患者血清miR-223-3p和HMGB1對PSD發病診斷價值的ROC曲線
3 討論
2017版全球疾病負擔研究報告稱卒中和抑郁癥均是全球致殘率較高的疾病,且卒中和抑郁癥也是導致社會經濟負擔增加的主要疾病[12]。PSD是卒中后最常見且疾病負擔最重的精神性疾病并發癥[13],與無PSD患者相比,PSD患者有著更高的病死率、認知障礙、致殘率和較低的生活質量[14]。因此,早期識別PSD的相關危險因素有助于指導臨床醫生更早發現并評估抑郁的發病和嚴重程度并積極進行干預,對改善卒中患者的預后具有重要意義。針對PSD的發病機制,有研究表明神經炎癥可能參與了PSD的發病,如PSD患者下丘腦-垂體-腎上腺軸調節失調導致炎癥加重[4]。近年來越來越多的研究關注miRNAs在中樞神經系統如何參與并調節炎癥反應、氧化應激、內皮功能障礙等多種生物學過程,其在血液循環中的穩定存在具有作為疾病診斷的潛在的新型生物標志物的價值[15]。近期有研究發現多種miRNAs與PSD存在密切相關性[16]。
研究發現miR-223-3p水平與caspase-1和IL-1β水平呈負相關,miR-223-3p在抑制炎癥小體激活和細胞凋亡中發揮作用[17]。另有研究發現miR-223-3p升高可減輕單核細胞、中性粒細胞和早期活化的巨噬細胞的浸潤,并下調促炎細胞因子IL-6和IL-12及趨化因子CCL2、CCL3、CXCL1[18]。值得注意的是,有研究還發現過表達miR-223-3p可減少腦梗死面積,最終改善神經功能缺損癥狀,改善學習和記憶[19]。卒中誘發的炎癥和促炎介質的激活已成為卒中誘發神經功能損傷機制的最新研究重點,HMGB1是一種典型的損傷性相關蛋白,在正常腦組織中HMGB1通常定位于細胞核中,而卒中發生后其轉移至細胞質并由受損細胞分泌至胞外,在卒中發病的早期階段作為促炎因子激活炎癥反應,可破壞血腦屏障,導致神經元凋亡等[8]。目前有研究認為HMGB1所介導的炎癥反應與抑郁癥的發病存在相關性[20],但miR-223-3p及HMGB1在PSD患者血清中的表達情況目前國內外尚無文獻報道。
本研究結果顯示,PSD組患者NIHSS評分及HMGB1水平高于非PSD組,且miR-223-3p相對表達量低于非PSD組,提示miR-223-3p相對表達量降低與HMGB1水平升高可能與PSD的發病有關。研究發現,抑郁小鼠模型中發現小鼠海馬區小膠質細胞HMGB1的mRNA轉錄水平及晚期糖基化終末產物(receptor for advanced glycation end products,RAGE)受體mRNA轉錄水平顯著上調,提示HMGB1RAGE通路的激活可能誘導抑郁癥狀[20]。卒中發生后,受損腦組織釋放HMGB1增加,HMGB1與RAGE受體結合后可激活活化絲裂原活化蛋白激酶,繼而使NF-κB激活,導致炎癥反應加重[8],該通路激活后最終導致靶細胞對TNF-α、IL-1β、IL-6等炎癥因子的合成和分泌增多[21],這些炎癥因子均參與了抑郁癥的發病,而miR-223-3p同樣參與NF-κB炎癥通路的激活[22]和促炎細胞因子IL-6和IL-12等的釋放[18],這提示miR-223-3p也可能在抑郁癥的發病中發揮一定的作用。同時本研究還發現卒中患者血清miR-223-3p與HMGB1水平及NIHSS評分均呈負相關,而HMGB1與NIHSS評分呈正相關,提示卒中患者miR-223-3p相對表達量降低且HMGB1水平升高者的神經功能缺損癥狀更重,較高NIHSS評分的卒中患者與PSD的發病率呈正相關[20]。此外,有研究發現慢性不可預知性應激誘導小鼠出現抑郁癥狀,是通過提高HMGB1水平而導致小膠質細胞的活化,最終誘導出小鼠的抑郁癥狀[23]。
同時,本研究采用ROC曲線分析了血清miR-223-3p與HMGB1水平對卒中患者PSD發病的診斷價值,結果顯示,兩指標的ROC曲線下面積分別為0.796和0.775, miR-223-3p的最佳診斷閾值為0.52,HMGB1的最佳診斷閾值為66.75 μg·L-1,提示缺血性卒中患者血清miR-223-3p水平降低與HMGB1水平升高對PSD的發病有著較高的診斷價值,但兩指標的特異性稍低。聯合miR-223-3p和HMGB1兩指標對PSD發病的診斷價值進行評估時,靈敏性和特異性及約登指數均得到一定程度的提升,提示對缺血性卒中患者早期聯合監測miR-223-3p和HMGB1的表達情況,可有效預測PSD的發生。
綜上所述,本研究發現急性缺血性腦卒中患者血清miR-223-3p相對表達量降低及HMGB1水平升高是PSD發病的獨立危險因素,早期將兩指標聯合檢測可有效預測PSD的發病,而miR-223-3p和HMGB1如何參與調控PSD發病及病情進展過程中具體的分子機制及信號通路,仍需進一步深入研究。

