難熔金屬含氧酸鹽短流程熔鹽電解制備金屬單質及合金的研究進展
趙國立,許 瑩,蔡艷青,宋 潘,夏朋昭
(1.華北理工大學材料科學與工程學院,河北唐山 063000;2.華北理工大學冶金與能源學院,河北唐山 063000)
難熔金屬一般指熔點高于1 650 ℃(如鈦、鉻、釩、鎢等)并具有一定儲量的金屬。難熔金屬可以和其他元素形成合金,稱之為難熔金屬合金。難熔金屬具有很多的優點,比如高溫強度較好,耐腐蝕性能好,這使得它們在冶金工程、化工等傳統領域有著重要的應用[1]。尤其是隨著近年來科學技術的快速發展,難熔金屬廣泛應用在國防軍事、航空領域、3D 打印技術等方面,成為供不應求的高端金屬材料,各產業對其需求量越來越大。
在鋼鐵及有色金屬合金方面難熔金屬主要用作添加劑。比如在鋼鐵行業中釩用于合金添加劑,用以細化鋼的組織和晶粒,使得晶粒粗化溫度升高,鋼的強度和韌性也會得到改善。金屬鉻會以單質鉻或者鉻鐵的方式與鋼鐵形成合金,作為不銹鋼的主要添加元素之一,用以提高鋼的硬度、機械性能和耐腐蝕性能,金屬鉻還用于高溫合金、精密合金及電阻合金的制備等。
鈦是一種銀白色金屬,具有延展性、可塑性、易加工成形、低溫韌性、斷裂韌性、導熱系數低及溫度適應范圍廣的優點,而且純度越高,塑性越大,強度越低;在常溫下,金屬鈦可在溶解于任何濃度的氫氟酸和含有氟離子的酸中,與無機酸不發生反應,但是能夠在熱鹽酸和熱硝酸中溶解;500 ℃以下,鈦及鈦合金具有非常穩定的特性,但是,鈦金屬的化學性質在高溫下極具活性,并且會與氧、氮、碳、氫和其他元素發生劇烈反應,并在高溫下與大多數耐火材料發生反應[2]。鈦具有耐腐蝕性強的性質,它具有與氧氣、氮氣和其他氣體相互作用的能力,一些鈦和其合金易于在金屬表面上形成致密的氧化物和氮化物保護膜,以獲得優異的耐腐蝕性,而且這種與氣體作用的能力除了氫氣外是不可逆的。由于鈦及其合金具有種種優點,使它逐漸廣泛應用于汽車行業、體育器械、醫用器材、輕工等行業,成為僅次于鐵、鋁的“第三金屬”[3]。
但是上述難熔金屬的提取過程難度較大,在工業上制備難熔金屬用的是熱還原法,這種方法工藝復雜,能源消耗大,附屬產物污染環境。熔鹽電解法是一種新的制備難熔金屬的工藝,比如FFC、OS、USTB、SOM 等,這些熔鹽電解技術用到的原料一般是難熔金屬的氯化物或者氧化物,這些難熔金屬的氯化物或氧化物制備過程比較復雜,能耗大并且會污染環境,它們是由難熔金屬的原生礦物經焙燒、浸出后首先獲得對應的含氧酸鹽,再將含氧酸鹽中間相分解、鍛燒、氯化、分離后最終獲得此類原料。除此之外,以氯化物為原料的熔鹽電解過程還存在產生的廢料污染大、腐蝕性強、步驟復雜等問題;另外,由于金屬氧化物在熔鹽中的溶解度小,電解過程動力學差、制備效率低。所以,找到短流程、清潔、高效的熔鹽電解制備難熔金屬的新方法是目前急需解決的難題。
1 難熔金屬工業制備方法
目前,難熔金屬的工業生產方法基本采用熱還原法。
1.1 金屬釩
金屬釩的制備方法包括鈣熱還原法、鋁熱還原法和鎂熱還原法。鈣熱還原法和鋁熱還原法采用釩的氧化物為原料,鎂熱還原法采用釩的氯化物為原料[4-7]。反應方程式見式(1)~(3)。
鈣熱還原法:
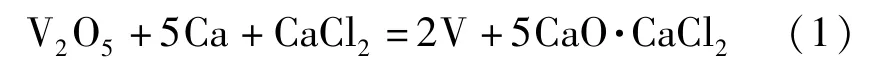
鋁熱還原法:

鎂熱還原法:

1.2 金屬鉻
金屬鉻的制備方法有鋁熱法和電解法。鋁熱法主要以三氧化二鉻為原料,化學反應見式(4);電解法以鉻銨礬中的硫酸鉻或者鉻酐為原料,化學反應見式(5)~(6)[8]。
鋁熱法:
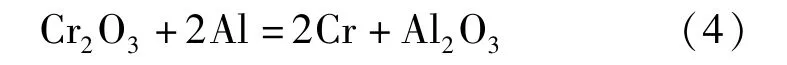
電解法:
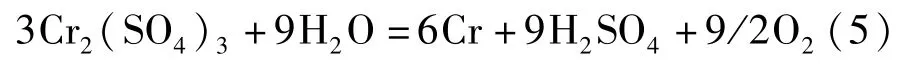
或:

1.3 金屬鈦
金屬鈦的制備方法有鎂熱還原法(Kroll 法)[9]和鈉熱還原法(Hunter 法)[10],主要化學反應見式(7)~(8)。
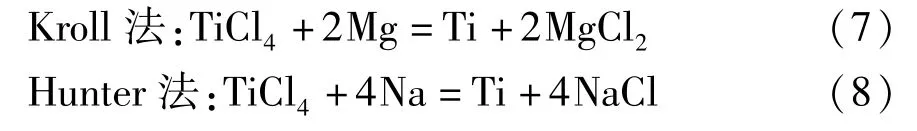
難熔金屬的工業生產方法主要是熱還原法,這種傳統的工業生產方式使難熔金屬的制備具有以下缺點:生產成本高昂、大規模生產困難、產品雜質含量高、工序和生產設備復雜、能源消耗大等。因此,急需開發難熔金屬冶煉新工藝。
2 氧化物和氯化物的熔鹽電解法
用于制備難熔金屬的工業方法除了具有上述的缺點外,在分離過程中還會出現產物與金屬的分離困難以及熱利用率低等缺點,而熔鹽電解法制備金屬用電子作為還原劑,不需要引入其他還原金屬雜質,也無需考慮還原金屬再生的問題,因此,熔鹽電解法比金屬熱還原法生產難熔金屬更有優勢。熔鹽電解法研究的是直流電通過熔鹽電解質時熔鹽中各化學組分發生變化的過程,與水溶液相比,熔鹽具有的優勢更多,比如擴散系數大、黏度低、分解電壓范圍寬、離子電導率高、對電解原料的溶解度高、電極反應快、過電壓低等。下文闡述幾種熔鹽電解比較具有代表性的方法:FFC、OS、USTB、SOM、液態金屬做陰極制備合金等。
2.1 FFC 法
FFC 熔鹽電解技術是由英國劍橋大學的Fray Derek J.等在CaCl2熔鹽中對其制備的純金屬鈦進行陰極脫氧實驗時發現的一種熔鹽電解方法。這種方法最初是為了除去金屬鈦中的雜質氧,進而使得鈦材的純度得以提高,后來研究者們發現這種技術可以直接電解固體TiO2制備海綿鈦,于是將其以三名發明者(Fray Derek J.,Fathing Tom W.和Chen George Zheng)的姓名命名為FFC 法[11]。
FFC 法是一種制備鈦金屬的新方法,已經研究了近20年。FFC 熔鹽電解法的具體操作方法:陽極選擇石墨棒,陰極選擇TiO2,熔鹽電解質選擇CaCl2,在800~900 ℃的溫度和2.8~3.2 V 的槽電壓下進行電解,并通入氬氣進行保護,電解完成后冷卻至室溫,取出。在實驗過程中TiO2陰極中所含的O 變為O2-,O2-與陽極上的C 反應生成CO 或者CO2。隨著TiO2陰極中O 含量的減少,陰極產物逐漸變為低價的鈦氧化合物,直至純金屬鈦。
整個電脫氧過程反應見式(9)~(10)。
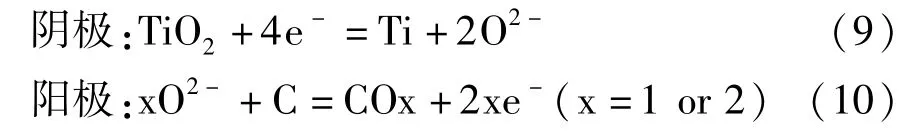
近年來,國內外學者對FFC 法的陰極脫氧機理進行了大量研究后,發現FFC 法的陰極脫氧是一個比較復雜的過程,二氧化鈦在逐級還原的過程中伴隨著一系列副反應。比如Schwandt 等[12]根據脫氧還原過程中熱力學和動力學特性以及物相變化的特點,推導出了Ti02脫氧還原過程的路徑:TiO2脫氧還原的第一階段產物是鈦的低價氧化物TixOy和CaTiO3,見式(11)~(14);第二階段產物主要是CaTi2O4,見式(15);第三階段是第二階段產物CaTi2O4的分解和TiO 的形成,見式(16);第四階段是TiO 繼續脫氧形成Ti—O(鈦氧固溶體) ,見式(17)。
第一階段:
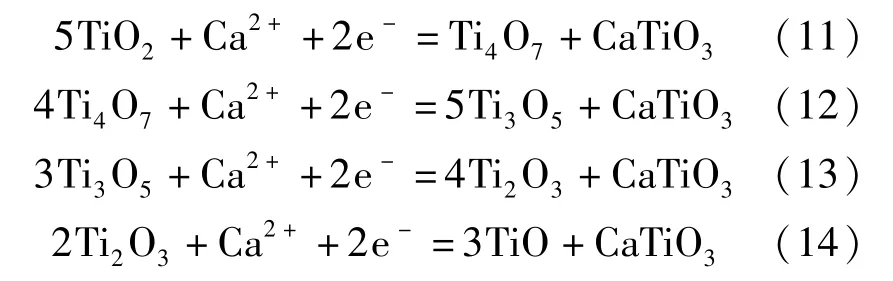
第二階段:

第三階段:

第四階段:

FFC 方法提出后,引起了鈦冶金學家的廣泛關注,并將該方法拓展至V、Cr、Si、Ta、Nb 等的制備。FFC 法的應用性極其廣泛,適用于各種加工難、活性高的金屬。也可以通過將各種氧化物混合燒結,得到固態陰極后直接電解脫氧制得傳統工藝無法合成的合金,同時還可以避免傳統方法造成的氧化、偏析等問題。在此基礎上,Ma 等[13]、Chen 等[14]采用FFC 法對高鈦渣進行電解后得到了產物金屬鈦和TiC/SiC 合金。由于FFC 法是固態陰極直接脫氧,因此可以先將氧化物原料預成型,然后直接脫氧得到一定形狀的產品,極大降低了金屬和合金產品后續的成型和加工費用。
FFC 工藝雖然有上述優點,但是仍然存在以下問題:①電流效率低;②陰極產物含有雜質;③陰極產物易含有尚未完全還原的低價氧化物,導致電解產品中的氧鈣含量極高;④在熔鹽電解質中易生成碳酸根,在陰極上會發生還原反應導致碳含量升高;⑤TiO2陰極本身并不導電,當它失去氧離子形成低價鈦氧化合物時才會導電,因此還需要考慮如何使陰極中的氧原子在電解開始時就離子化的問題:⑥TiO2陰極中的O 在電解時進入熔鹽而留下鈦,如何控制電解電壓使得熔鹽中的雜質元素(C 和Ca 等)不在陰極還原也是一個難點。
2.2 OS 法
2002年,One 和Suzuki[15]在日本京都大學設計了一種鈣熱還原制備鈦的工藝方法,稱為OS 法。它的原理是電解熔鹽中的CaO 首先得到金屬鈣,再與TiO2發生鈣熱還原得到金屬鈦。在該方法中,石墨作為陽極材料,金屬鐵網或不銹鋼網作為陰極材料,溶有金屬Ca 的CaCI2熔鹽作為電解質,使電解槽的溫度在1 150~1 190 K 之間,使電解電壓介于CaO 的分解電壓1.66 V 和CaCI2的分解電壓3.2 V之間(一般選擇3.0 V),然后TiO2粉末從電解槽上方加入,在陰極附近TiO2被Ca 還原生成金屬鈦并沉積到電解槽底部,還原產生的CaO 又被電解生成Ca,實現了金屬鈦的連續生產。陰極反應機理見式(18)~(21);陽極反應機理見式(22)~(23)。
陰極:

陽極:

OS 法與FFC 法采用相似的電解槽和相近的電解電壓,并且陽極選擇的都是C 棒。區別是FFC 法用塊狀TiO2和導線連接作陰極,因此陰極中的氧必須穿過陰極表層才能去除;在OS 法實驗中,TiO2以粉末狀從陰極上方加入,二者之間無需導線連接,氧不需要長距離的擴散,利于其轉移。顯然OS 法的能耗較FFC 更小,也更加環保,但是它也面對著一些問題,比如設備和工藝比較復雜,鈦與鹽難分離,還原得到金屬Ti 的效率較低等問題。
根據近年來的研究發現,OS 法的陰極區域會出現中間產物CaTiOx,它的出現制約著金屬鈦的制備。在OS 法基礎上,研究者們進行了鈣蒸汽還原(PRP 工藝)[16]、鈣鎳合金還原(EMR 工藝)[17]、CaH2合金還原(MHR 工藝)[18]等。猶他大學的Fang 等[19]進行了熔鹽中鎂熱還原二氧化鈦用氫輔助制備金屬Ti 的研究,并對氫輔助下的脫氧機理和熱力學等做出了解釋。上述研究所面臨的挑戰仍是金屬鈦及其合金制備效率低的問題。
2.3 USTB 法
北京科技大學朱鴻民等[20]發現一種以可溶性陽極為原料制備金屬鈦的新方法,稱之為USTB 法。這種方法包括可溶性陽極材料TiO-mTiC(0≤m≤1)的制作和熔鹽電解制取金屬鈦兩個步驟。采用TiO2碳熱還原制備可溶性陽極,也可以選擇TiO2與TiC 混合燒結,具體方法:將TiO2和碳粉或者TiC 在300~1 000 kg/cm2的壓力下壓制成型,隨后在1 273~1 673 K 和小于100 Pa 的真空條件下燒結4 h,得到具有良好導電性的可溶性陽極。電解實驗過程以TiO-mTiC 做為陽極,鋼棒做為陰極,NaCI/KCl 作為熔鹽電解質,并在1 073 K 下進行電解實驗。在實驗過程中,TiO-mTiC 可溶性陽極中的鈦離子溶解進入NaCI/KCl 熔鹽,到達鋼棒陰極后發生還原反應生產金屬鈦,與此同時,陽極放出CO 和CO2,陽極氣體的組成取決于制備的陽極材料中碳和氧的含量。該電解過程中發生的化學反應見式(24)~(25)。

USTB 法是借用電解制備金屬的思路,在制備鈦的機理上和FFC 法、OS 法有著明顯的不同。USTB 法最大的特點是鈦源是陽極,這使得陰極產物不像FFC 法和OS 法那樣會含有大量的氧,且不會引入熔鹽中Fe、Si、Mg、Al 等金屬雜質[21];該方法克服了FFC 法中以TiO2為陰極時導電性差的缺點,并以導電性良好的TiCxOy作為可溶性陽極,在陰極上電解得到高純度的金屬鈦,使電流效率明顯提高。該方法得到的金屬鈦純度可達到99.9%,是目前制備金屬鈦及其合金較有發展潛力的方法之一。
USTB 法目前存在的問題:鈦離子在陰極的沉積過程會受到陽極溶解速率的影響,TiO-mTiC 經高溫燒結后成型,是密實的塊狀半導體固溶體,在熔鹽中溶解速率緩慢,影響了鈦離子的沉積速率,限制了電極產能;若要實現大規模生產,必須增加固體陽極的尺寸,這將會增加成型難度,增大氧化物的還原阻力,降低其高溫熱穩定性和物化性質均一性等。
2.4 SOM 法
固體透氧膜法(SOM)[22]是21世紀初興起的一項綠色環保、節能高效的提取冶金技術,由波士頓大學U.B.Pal 教授提出,并進行了由氧化鎂直接提取鎂的研究。發生的化學反應見式(26)~(27)。

SOM 法是通過控制O2-的流動,在電場作用下使O2-遷移到陽極,從而實現對金屬氧化物的電解。由于在熔鹽中加了一層固體透氧膜,陽離子只會在陽極析出,所以參與電解反應的物質只有氧化物;非氧離子無法透過固體透氧膜進入陽極附近,在進行電解實驗時就算電壓超過了熔鹽的分解電壓,熔鹽也不會發生分解。利用此技術特點,SOM 法延伸到了處理鈦精礦和含鈦高爐渣制備合金TiFe 和Ti5Si3
[23-24],還用來電解含鈦收塵渣和鈦鐵渣來制備鈦及鈦合金[25]。
固體透氧膜由于其電子電導有限,電解時產生的背景電流也會受到限制,這顯著提高了電解時的電流效率。與此同時,SOM 法不存在FFC 法的“熔鹽中不能有比要制備金屬的析出電位更高的金屬離子”的限制。
2.5 液態金屬做陰極制備合金
當使用固態陰極進行熔鹽電解制備金屬時,由于金屬的熔點比熔鹽的電解溫度要高得多,所以這種類型的方法制備的金屬大多以粉末狀沉積在陰極,導致高熔點金屬的電解提取過程無法連續進行,也無法獲得密實的塊狀金屬,還極易誘發陰極產物的二次反應,使得電解過程中電流效率降低,熔鹽損失增加。
熔鹽電解制備合金的方法主要有電解共沉積法、陰極合金化法和液態金屬陰極法[26]。當陰極選擇液態金屬時,在陰極上生成的金屬能夠與液態金屬形成合金。用這種方法制備的合金可以使金屬的活性降低,合金的污染和溶解損失減少,并且能夠在較低溫度制備高熔點金屬合金。
目前北京科技大學的焦漢東等[27]利用此方法制備的合金有以下幾種。
1)在NaCl-KCl 共晶鹽體系中,TiCl3作為鈦源,金屬錫作為液態陰極,制備鈦錫合金(Ti6Sn5)。
2)在NaCl-KCI-KF-K3TiF6的體系中,采用液態錫和液態鉛電極制備鈦錫合金(Ti6Sn5)和鈦鉛合金。
3)在LiF-NaF-KF-K2TiF6體系中,在液態錫和液態鉍電極上制備出了鈦錫合金和鈦鉍合金。
4)在CaO-Al2O3-MgO-TiO2熔體中,采用液態鐵做陰極,從而獲得鈦鐵合金。
使用液態金屬做陰極時,沉積出來的金屬在液態陰極內部具有更好的擴散條件,因此也更容易得到合金相。與固態惰性陰極相比,液態金屬陰極可以使沉積金屬的活度降低,使沉積金屬在未達到其理論沉積電位之前發生去極化作用,從而得到與液態金屬陰極形成的合金。
電解實驗中沉積金屬的電極電位由式(28)計算[26]。

式中:EElectro為陰極沉積金屬的電極電位,V;η為過電位,V;ERA+/RA為電活性物質的平衡電極電位,V;aRA+(solution)為熔鹽中活性物質的活度;aRA(in-liquid-metal)為液態金屬陰極中沉積金屬的活度。
使用固態金屬陰極時沉積金屬的活度為1,而使用液態金屬陰極制備合金時,電解體系的沉積金屬能與之形成合金,導致aRA(in-liquid-metal)小于1。故采用液態金屬陰極時,會導致金屬的還原電位正向移動,使金屬離子的電沉積加快,從而起到去極化作用。
由于液態陰極有著去極化的作用,可用此方法提取含鈦高爐渣中的鈦元素,采用鐵作為陰極時,含鈦高爐渣中所含的硅要比鈦先在鐵陰極上發生去極化電沉積。若想要鈦和硅元素在鐵陰極上發生共沉積,就得適當增大陰極電流密度,在該電流密度下用恒電位電解可以得到鈦-鐵-硅三元合金;采用直流電解的方法可以使硅元素首先還原,然后鈦在硅表面發生去極化沉積,得到鈦-硅二元合金[27]。
適當的液態陰極也能起到抑制雜質進入電解產物的作用,比如:在電解實驗溫度下,Zn、Sn、Pb 等低熔點金屬與目標金屬Cr 易形成合金[28],但它們與C 無法形成,用此類金屬做液態陰極時,就可以促進熔鹽中鉻酸根()在陰極上的電沉積,同時抑制的沉積,從而達到除碳的目的。
用液態陰極制備合金除這些優勢以外,它還能夠和沉積金屬形成液態合金,從而達到合金與熔鹽的液-液分離,使電解產物得以在線收集,對難熔金屬含氧酸鹽在熔鹽中的電沉積連續化操作具有重要的指導意義。
該技術目前存在的問題主要是液態陰極的選擇問題,具體包括以下內容:①液態陰極能夠既強化目標金屬電解,又抑制雜質的沉積;②液態金屬通過與沉積金屬的合金化實現去極化作用,所以選擇的液態陰極應該易與沉積金屬形成合金;③所選擇的陰極不能與雜質形成合金,最好對雜質具有排斥作用,從而達到去除雜質的目的。
3 含氧酸鹽的熔鹽電解
上述熔鹽電解法的原料是氧化物或者氯化物,這類原料屬于冶金流程的中下游產物,制備困難,并且在電解中會產生有毒氣體。為了避免此類情況,以冶金流程中第二步得到的難熔金屬含氧酸鹽為原料進行熔鹽電解來制備金屬及合金,這樣可以大幅縮短流程,且不會產生有毒物質污染環境。另外,難熔金屬含氧酸鹽屬于離子型鹽類,它能夠與熔鹽形成共晶體系,在電解過程中具有優異的動力學條件,可有效避免傳統熔鹽電解法中氧化物原料在熔鹽中溶解度小的問題。故以難熔金屬含氧酸鹽為原料進行熔鹽電解制備金屬及合金符合短流程綠色冶金的原則。
在熔鹽電解制備金屬及合金時,如果被電解物質直接做固態陰極,會出現大塊陰極成型困難,物化性質不均一、導電性能差、電解產物的燒結現象嚴重等問題;如果被電解物質溶于電解質中,就要考慮被電解物質在熔鹽中的溶解度,以及和熔鹽的平衡電位問題。
難熔金屬含氧酸鹽在熔鹽中的溶解度越大,越有利于熔鹽電解過程中沉積金屬離子在熔鹽中的擴散,就越能夠得到更大的極限擴散電流密度和實現更高的電流效率。如Kim 研究了在CaCl2熔鹽中CaWO4的溶解度,發現二者可形成簡單共晶體系,并在CaWO4含量為4%時形成共晶點,且CaWO4的溶解度會隨著熔鹽溫度的升高而升高[29];Clark 發現CaCl2-CaCrO4也可以形成簡單的共晶體系,表明了CaCrO4在CaCl2熔鹽中也會有一定的溶解度[30];肖巍研究發現SiO2在CaCl2熔鹽中轉變為CaSiO3后,其在CaCl2熔鹽中的溶解度有了顯著的提高[31];李運剛發現SiO2在KCl-NaCl-NaF 熔鹽中轉變為Na2SiO3之后,能夠提高SiO2在熔鹽中的溶解度[32],說明離子型含氧酸鹽在熔鹽中的溶解度要遠遠高于氧化物[33-36]。
氯化物與氟化物是熔鹽電解過程中最常見的體系,如工業中常用氯化物熔鹽體系電解提取堿金屬、堿土金屬和稀土金屬,用氟化物熔鹽體系進行鋁電解[37]。對于周圍環境的腐蝕性來說,氯化物熔鹽體系要低于氟化物,因此,當原料在這兩種熔鹽體系中的溶解度都滿足電解要求時,一般選擇對環境腐蝕性較小的氯化物體系。難熔金屬含氧酸鹽在不同熔鹽中的溶解度決定了沉積金屬離子向電極表面擴散的難易程度,是選擇熔鹽體系的重要依據[38]。在熔鹽中的溶解度越大,沉積金屬離子越容易擴散至電極表面,在電解時就越能夠達到更大理論電流密度和電流效率,在電極單位面積上沉積的金屬也就越多,這也是保證電解能夠連續穩定運行的前提。
難熔金屬含氧酸鹽標準平衡電位越正,在電解過程中就越容易得電子發生還原反應沉積出金屬,熱力學驅動力也越大。表1 是常見金屬及非金屬含氧酸鹽的標準平衡電位,以CaCl2的標準平衡電壓(3.214 V)為基礎,將Ca2+/Ca 的標準平衡電位定為0 V,Cl2/Cl-的標準平衡電位定為3.214 V,就可計算出其他鹽類相對于Ca2+/Ca 的標準平衡電位。由表1 可知,Cr、V、Mo、Co 和W 的含氧酸鹽平衡電位較正,熱力學驅動力也大,這些金屬的含氧酸鹽較易得電子還原為金屬;Ti 和Zr 含鹽酸鹽的標準平衡電位較其他金屬的含氧酸鹽較負,熱力學驅動力也較小,因此較難得電子發生還原反應沉積金屬;除Zr 的含氧酸鹽外,其他金屬含氧酸鹽的標準平衡電位都正于Ca2+/Ca,它們對應的陽極氧化反應也遠小于Cl2/Cl-的平衡電位。因此,對這些金屬的含氧酸鹽進行電解時,熔鹽中的堿金屬不會發生還原反應在陰極沉積出金屬,氯離子也不會在陽極析出氯氣,進而從電位的角度證明了難熔金屬含氧酸鹽熔鹽電解制備金屬時氯化物和氟化物可作為穩定的熔鹽體系[39]。

表1 不同金屬含氧酸鹽的標準平衡電位
電解槽示意圖如圖1所示,電解槽中的熔鹽在進行不同含氧酸鹽電解時可換為最適宜其電解的熔鹽。電化學實驗中的測試裝置采用VersaSTAT 4 電化學工作站。整個實驗裝置包括電阻爐裝置、氣體處理裝置、數據測試裝置,采集和記錄數據用計算機來進行。在進行電解實驗時,由于電流會隨著電極沒入熔鹽的深度而變化,故所采集到的電流一般采用電流密度來表示,它的計算方法可由公式J=I/S計算得到,I為實驗時的電流,S為陰極面積,在進行實驗時可自行測得。
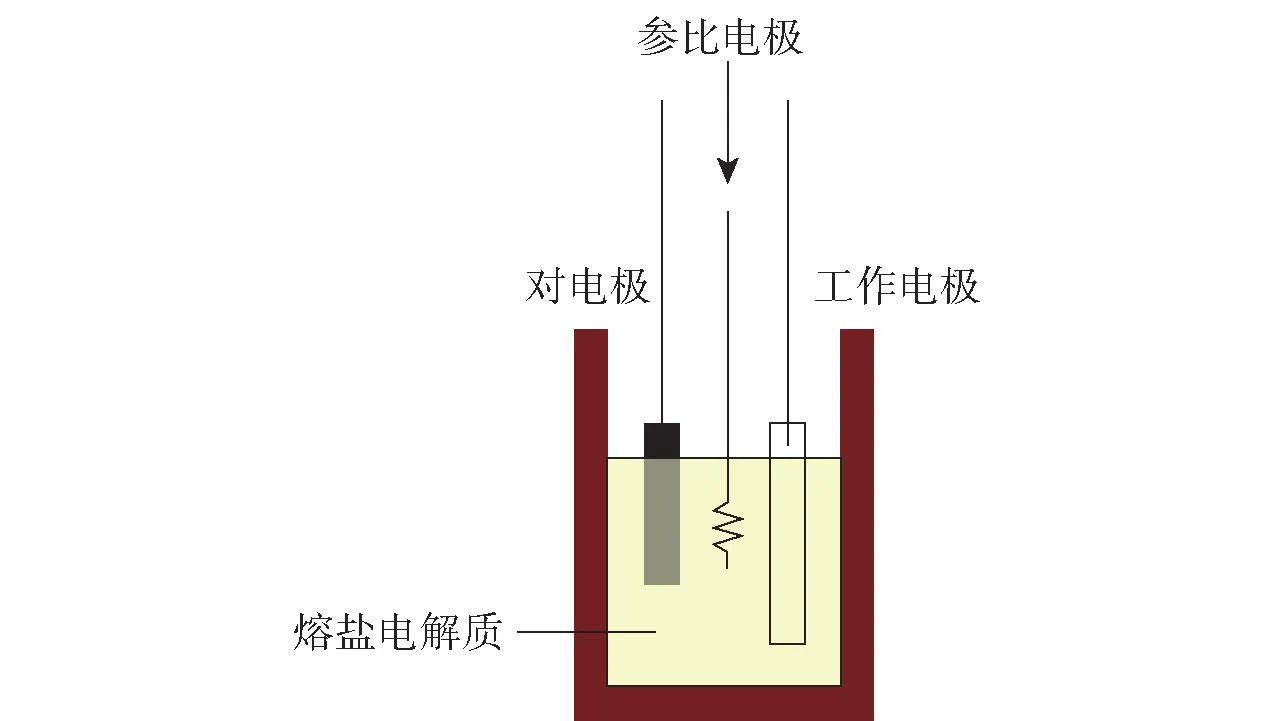
圖1 電化學實驗電解槽示意圖
4 典型難熔金屬含氧酸鹽的電化學行為
現介紹比較典型的V、Cr、Ti 的含氧酸鹽在電解過程中發生的電化學行為。
4.1 釩酸鹽
釩含氧酸鹽的熔鹽電解過程由沉積金屬離子在電極表面的擴散和還原兩步組成。根據文獻結果可知[39],NaVO3在NaCl-CaCl2熔鹽中,800 ℃條件下溶解度為6%。因此,采用NaCl-CaCl2熔鹽可使釩含氧酸鹽在電極表面進行擴散。與此同時,釩含氧酸鹽的還原過程中是先還原為釩的低價氧化物,然后再進一步還原為金屬釩。
金屬釩是一種高價態-多變價的元素,釩含氧酸鹽在純NaCl 熔鹽中還原為低價氧化物后,由于這種中間相的溶解度極低,難以擴散至電極附近繼續還原為金屬釩。但如果NaCl 熔鹽中引入CaCl2,中間相向電極擴散的動力學條件會得到改善,它的還原深度也會大大增加。其原因是:在純NaCl 熔鹽中引入Ca2+后,在電解過程中生成的中間相會由V2O3轉化為CaV2O4,CaV2O4在NaCl-CaCl2熔鹽中的溶解度比V2O3要大得多(CaV2O40.6%,V2O30.15%),也比V2O3要更容易擴散至電極附近,因而可以深度還原得到金屬單質。所以NaVO3以CaCl2-NaCl 混合熔鹽為電解質,在800 ℃、3.0~3.2 V 的槽電壓下進行電解會得到釩單質。
釩酸鹽也可用液態金屬陰極的方法來制備VM 合金,關鍵是找到合適的陰極,即易與釩形成有低共熔點的固溶體,且該陰極難與C 形成固溶體。
4.2 鉻酸鹽
鉻酸鹽與釩含氧酸鹽電解還原過程相似,在氯化物熔鹽中具有良好的溶解性。同樣遵循分步還原歷程,先生成低價氧化物中間體,然后還原為金屬。Ca2+也會加深其還原深度,促進低價氧化物的還原[40],強化向電極表面的遷移,具體過程為:中間相Cr2O3轉變為CaCr2O4,CaCr2O4在熔鹽中具有比Cr2O3更好的溶解度,更容易擴散至電極表面,使得還原動力學條件得以改善,進而實現中間產物的深度還原。
鉻酸鹽也可用液態金屬陰極的方法制備合金,陰極可選擇與Cr 固溶度好的Zn 和Sn[41],用液態金屬陰極制備鉻合金,金屬Cr 會進入液態金屬陰極內部,雜質C 停留于陰極界面,實現金屬Cr 與雜質碳的分離。鉻酸鹽可與Zn、Sn 形成Cr-Zn、Cr-Sn 合金,除此之外,也可用固體氧化膜的方法從鉻的復合礦中直接制備金屬或者合金。
4.3 鈦酸鹽
以鈦酸鹽中最為常見的鈦酸鈣來說,它的理論分解電壓遠低于氯化物或者氟化物熔鹽[42],這兩類熔鹽都有可能作為熔鹽電解鈦酸鈣的電解質,實現它的電化學還原。但是鈦酸鈣在氯化物熔鹽中溶解度較差,要沉積的鈦離子難以擴散至電極表面,故鈦酸鈣的熔鹽電解過程不能選擇氯化物作為其熔鹽體系。據文獻結果可知,CaTiO3在氟化物熔鹽Na3AlF6-10%AlF3中的溶解度為2.4%,它能夠很好地溶解鈦酸鈣,鈦離子在氟化物熔鹽中易擴散至電極表面附近,實現鈦離子的深度還原,動力學條件良好。CaTiO3在Na3AlF6-10%AlF3熔鹽中的電解過程中發生的化學反應見式(29)。
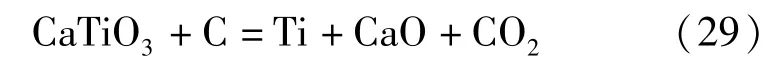
但上述反應并不是一步到位的,與其他難熔金屬含氧酸鹽一樣遵循分步還原步驟,先還原為鈦的低價氧化物,再進一步還原為單質,具體過程是:。在具體實驗中,只要在鈦酸鹽的標準平衡電位之上對其施加電壓,鈦酸鹽就可以在Na3AlF6-10% AlF3熔鹽體系中制備出鈦單質。
在OS 法的基礎上,TiO2的電解還原過程中會有中間相鈦酸鈣(CaTiO3)的產生,且CaTiO3的生成量隨著CaCl2添加量的增加而增加。據文獻[43-47],TiO2的鈣熱還原過程為:TiO2→Ti4O7→Ti3O5→Ti2O3→TiO→Ti。發生的主要化學反應見式(30)~(37)。
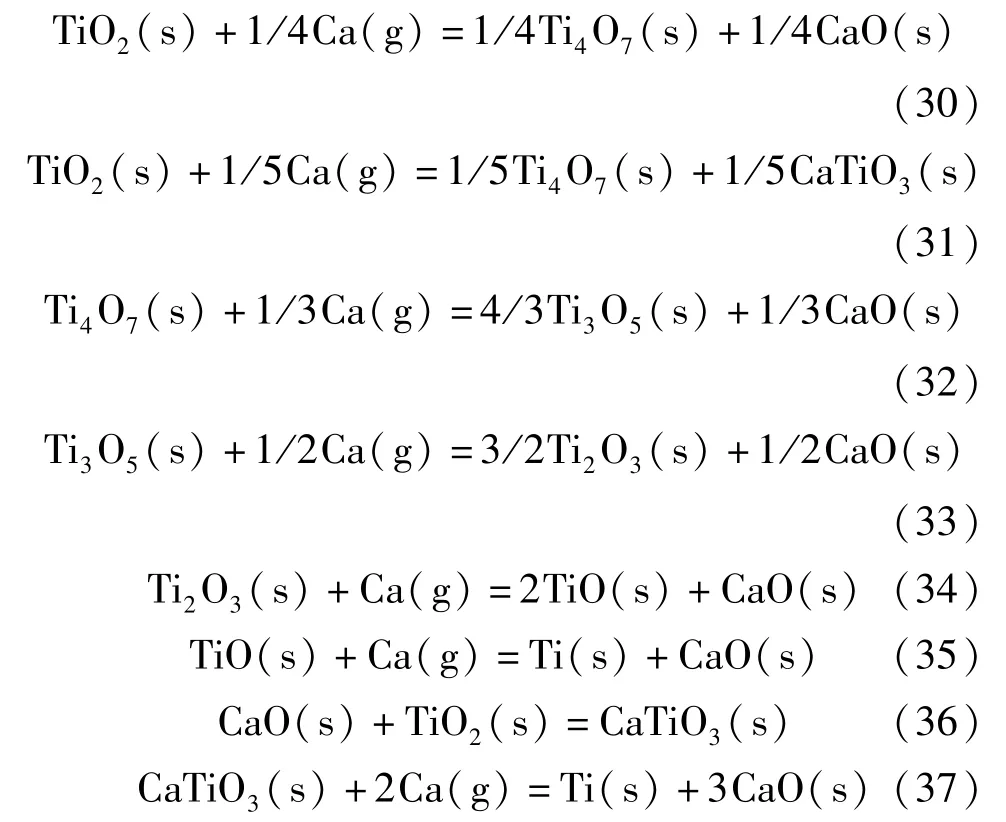
采用HSC6.0 軟件以TiO2轉變成Ti4O7為例,對最終TiO 和CaTiO3還原生成Ti 進行熱力學分析。據圖2 可知,反應式(30)的ΔG大于反應式(31)的ΔG,表明在TiO2在還原過程中更容易生成中間相CaTiO3;反應式(37)的ΔG遠遠小于反應式(35)的ΔG,說明CaTiO3更容易與單質鈣發生還原反應生成金屬鈦[48]。

圖2 反應式(30)~(31)和反應式(35)~(37)的ΔG 與T 的關系
除了OS 法之外,在以氧化物為原料,采用FFC法電脫氧制備硅、鈦的過程中也發現,會有中間相CaSiO3和CaTiO3等含氧酸鹽的生成,說明難熔金屬含氧酸鹽作為原料制備金屬單質存在可能性,但這種方法是固態電脫氧過程,存在著固態電極的弊端,難以實現大規模生產。
由上述分析可知,鈦酸鈣可以作為熔鹽電解制備鈦的鈦源,原因如下:鈦酸鈣在氟鹽體系中具有一定的溶解度(Na3AlF6-10%AlF3,2.4%);相較于鈦的氧化物來說鈦酸鈣更易生產金屬鈦;鈦酸鈣為離子型的晶體,在熔鹽中比較容易擴散到電極附近,實現高效電解;也可用液態金屬做陰極,但需選擇合適的金屬,如Fe、Sn、Si 等,形成Ti-M 合金,但這種方法都選擇鈦的氯化物作為鈦源,鈦酸鹽是否可作為原料還有待研究。
5 結論
目前熔鹽電解制備金屬及合金的工藝大多是以金屬氧化物或氯化物為原料。氧化物在熔鹽中溶解度小,還原動力學差;氯化物雖然溶解度較好,但其制備過程復雜,腐蝕性強,污染環境。本文提出以難熔金屬含氧酸鹽作為原料熔鹽電解短流程制備金屬的新過程,具有如下優點。
1)難熔金屬含氧酸鹽接近原生礦物,以此為原料可大幅縮短工藝流程,還能夠避免氧化物原料制備過程中產生的污染,且難熔金屬含氧酸鹽熔鹽電解制備金屬的過程不產生有害氣體,保護環境。
2)難熔金屬含氧酸鹽為易溶解離子型化合物,能夠與熔鹽電解質結合形成共晶體系,利于電解過程中離子的遷移擴散,有望實現高效電解,提高電流效率。
3)難熔金屬含氧酸鹽的理論分解電壓遠小于氯化物和氟化物熔鹽,在電解過程當中不會發生氯化物和氟化物熔鹽的分解。
4)以難熔金屬含氧酸鹽為電解原料溶解將其在熔鹽中制備其對應金屬時,可避免FFC 法中電解原料做固態電極時電解產物中氧含量過高、某些雜質(C 等)依附于固體顆粒難以去除等問題,減少后續除雜步驟。
5)對于實用性的金屬電化學冶金技術,必須要求原料為溶解態,難熔金屬含氧酸鹽在氯化物或者氟化物熔鹽中的溶解度比其金屬氧化物在熔鹽中的溶解度更好,符合短流程高效制備金屬的原則。

