抗菌肽BCp12對大腸桿菌壁膜及DNA損傷的作用機制
楊 昆,王 歡,高 潔,李鈺芳,趙 瓊,施婭楠,黃艾祥
(云南農業大學食品科學技術學院,云南 昆明 650201)
大腸桿菌(Escherichia coli)是人和多數動物體內常見的腸道共生革蘭氏陰性菌[1],并且廣泛存在于動植物產品中[2-3],肉制品在加工過程中極易受到大腸桿菌污染,從而引發食源性疾病[4]。因此,有效抑制動植物產品中的大腸桿菌的增殖生長,對提高食品的安全性顯得尤為重要。
抗菌肽是一類天然的具有抗細菌或真菌作用的活性肽,作為新型天然食品防腐劑而備受關注[5]。作為天然來源的抗菌肽,與傳統的抗菌劑相比,其在發揮抑菌作用的同時不易產生耐藥性,因此其抑菌機理已成為廣大學者的研究熱點[6]。抗菌肽BCp12是本課題組從檳郎江水牛酪蛋白中分離出的新型抗菌肽,一級結構為YLGYLEQLLRLK,分子質量為1 508.82 Da,屬于熱穩定性高的疏水性陽離子抗菌肽,且對大腸桿菌具有良好的抑菌效果[7]。謝海偉等[8]研究發現抗菌肽首先作用于細胞膜,隨著作用時間和濃度效應變化,細胞膜通透性增加,胞膜裂解,這表明細胞膜是其首要和重要作用靶點。王梓源等[9]研究發現ε-聚賴氨酸能夠增強大腸桿菌細胞表面疏水性及細胞內、外膜的通透性,并且改變菌體細胞膜內外電勢,使其細胞內容物如核酸、蛋白質等大量滲出,從而實現對菌體的殺菌作用。陳旋等[10]研究發現抗菌肽P7能特異性地結合rnhA序列,引起大腸桿菌DNA的損傷,并抑制大腸桿菌的DNA復制。
目前,抗菌肽BCp12的研究主要集中在純化、鑒定及性質方面,并沒有對其抑菌機制進行研究。因此,本實驗從抗菌肽BCp12對大腸桿菌的生長繁殖、壁膜損傷機制及DNA的影響3 個方面來揭示BCp12對大腸桿菌壁膜及DNA的損傷機制。
1 材料與方法
1.1 材料、菌種與試劑
抗菌肽BCp12是用本課題組自主研發的貫筋藤蛋白酶對檳榔江水牛酪蛋白進行酶解,利用活體大腸桿菌親和吸附法聯合反相高效液相色譜(reverse phase highperformance liquid chromatograph,RP-HPLC)技術從酶解液中靶向分離得到的,利用UniProt數據庫(https://www.uniprot.org/)預測分析酪蛋白的功能活性,發現該序列來源于牛αS1-酪蛋白,屬于新抗菌肽,由安徽國平藥業有限公司合成,純度為95%以上。
大腸埃希氏菌CICC10003 中國工業菌種保藏中心。
正十六烷 山東西亞化學工業有限公司;溴化乙錠(ethidium bromide,EB) 山東西亞化學股份有限公司;細菌基因組DNA提取試劑盒 北京索萊寶生物科技有限公司;0.02 mol/L pH 7.4磷酸鹽緩沖液(phosphate buffer saline,PBS) 賽國生物科技有限責任公司。
1.2 儀器與設備
Synergy HI全波長熒光酶標儀 美國Biotek公司;GR85DA高壓滅菌鍋 美國Zealway公司;DW-HL388-86 ℃冰箱 中科美菱低溫科技有限公司;UV-6100紫外-可見分光光度計 上海美譜達儀器有限公司;ZQZY-85CS振蕩培養箱 上海知楚儀器有限公司;NEXUS 470傅里葉變換紅外光譜儀 美國賽默飛世爾科技公司;FlexSEM1000 HITACHI落地式掃描電子顯微鏡 日本日立公司;JEM-1200EX透射電子顯微鏡 日本JEOL公司;Gel-Doc XRS免疫電泳成像系統 美國Bio-Red科技公司。
1.3 方法
1.3.1 BCp12對大腸桿菌生長繁殖影響的測定
1.3.1.1 最小抑菌濃度及抑菌曲線的測定
參照文獻[11]的研究方法,取對數生長期的大腸桿菌菌液,用0.02 mol/L pH 7.4 PBS稀釋至106CFU/mL,使用96 孔板進行實驗。每孔加入190 μL新鮮Luria-Bertani(LB)培養基、10 μL菌液和50 μL抗菌肽BCp12溶液,BCp12的終質量濃度分別為0、1、1.6、2、3.2 mg/mL。以等體積無菌水為空白對照組,于37 ℃恒溫培養箱培養18 h,用酶標儀測定OD600nm。能完全抑制病原菌生長的最低質量濃度作為最小抑菌濃度(minimum inhibitory concentration,MIC)。然后,參照Cirioni等[12]的研究方法,測定不同質量濃度的BCp12對大腸桿菌的抑菌效果。每小時測一次OD600nm,測7 次并計算出平均值,以時間為橫坐標、OD600nm為縱坐標,繪制抑菌曲線。
1.3.1.2 大腸桿菌生長曲線的測定
參照孟兆麗[13]的研究方法,并稍作修改。取對數生長期的大腸桿菌菌液,用0.02 mol/L pH 7.4 PBS稀釋至106CFU/mL,實驗組加入等體積BCp12溶液并使其終質量濃度為MIC,空白對照組和四環素對照組分別加入等體積的無菌水和四環素溶液(2 mg/mL)代替BCp12溶液。37 ℃、120 r/min連續培養24 h,每2 h取樣1 次,用酶標儀測定OD600nm,每個時間點重復3 次,取平均值繪制生長曲線。
1.3.2 BCp12對大腸桿菌壁膜損傷的機制研究
1.3.2.1 菌體細胞壁表面疏水性分析
參照文獻[14]的方法,取對數生長期的大腸桿菌菌液,10 000 r/min離心2 min,收集菌體沉淀,加入等體積PBS將菌體沉淀重懸,10 000 r/min離心2 min,收集菌體沉淀加入等體積的0.02 mol/L pH 7.4 PBS,重復上述離心洗滌操作,洗滌3 次后,將菌體沉淀重懸于0.1 mol/L的KNO3溶液,調整菌液濃度為1.0×106CFU/mL備用,并測定該菌懸液于405 nm處的光密度,記為OD0。然后取1.2 mL菌懸液,加入200 μL的一定質量濃度的BCp12溶液,使其終質量濃度為MIC;KNO3組加入200 μL 0.1 mol/L KNO3溶液;正十六烷組加入200 μL正十六烷分別于室溫孵育10 min,漩渦振蕩2 min,使各溶液充分的混合,靜置15 min后,快速吸取上清液置于96 孔板中,每組重復3 次,測定405 nm處的光密度(OD405nm)。菌體壁膜表面疏水性與吸附率相關,因此可用大腸桿菌吸附率來反應菌體壁膜表面疏水性的變化,大腸桿菌吸附率按下式進行計算。
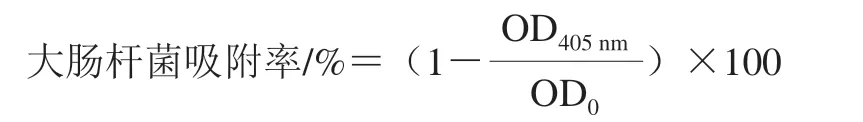
1.3.2.2 菌體細胞膜通透性的測定
參照Al-Adham等[15]的研究方法,取1.3.2.1節用PBS洗滌3 次的菌體沉淀,用PBS重懸得到1.0×106CFU/mL的大腸桿菌菌懸液,并加入等體積BCp12溶液,使BCp12終質量濃度分別為MIC、1/2 MIC,對照組添加等體積的無菌水,于37 ℃恒溫孵育一定時間,分別在培養的2、4 h取樣,10 000 r/min離心2 min,取上清液于260 nm和280 nm測定其光密度,分別用于檢測胞內核酸和蛋白質的泄漏情況。
1.3.2.3 流式細胞儀分析菌體細胞膜的完整性
參照文獻[16]并稍作修改。取1.3.2.1節用PBS洗滌3 次的菌體沉淀,用PBS重懸得到1.0×106CFU/mL的大腸桿菌菌懸液,并加入等體積BCp12溶液,使BCp12終質量濃度為MIC,對照組添加等體積的無菌水。均勻混合后,于37 ℃恒溫培養箱培養6 h,孵育結束后,用PBS洗滌菌體沉淀3 次,以終止抗菌肽繼續發揮作用。上機前加入終質量濃度為50 μg/mL的碘化丙啶(propidium iodide,PI)染液,用流式細胞儀分析PI著染陽性細菌數[17]并分析菌體細胞膜的完整性。
1.3.2.4 BCp12對菌體壁膜組分的影響
參照文獻[18]并進行適當調整。取1.3.2.1節用PBS洗滌3 次的菌體沉淀,用PBS重懸得到1.0×106CFU/mL的大腸桿菌菌懸液,并加入等體積BCp12溶液,使BCp12終質量濃度分別為MIC、1/2 MIC,對照組添加等體積的無菌水。置于37 ℃恒溫培養一定時間后,取10 μL于透明光學晶片(KBr)上,立即置于裝有硅膠的減壓干燥器中,將其干燥成透明的膜狀物。按中華人民共和國藥典的方法校準儀器。取出空白KBr晶片,立即置于樣品窗口中,測定吸收后紅外光譜圖,用于矯正空白。測量參數:分辨率4 cm-1、掃描次數32 次、掃描范圍400~4 000 cm-1。用同樣方法和參數測定載有透明膜狀物的KBr晶片[19]。
1.3.2.5 對菌體壁膜超微結構的觀察
取1.3.2.1節用PBS洗滌3 次的菌體沉淀,用新鮮LB培養基重懸為1.0×106CFU/mL菌懸液,加入BCp12使其終質量濃度為MIC,對照組添加無菌水,對照組于37 ℃培養5 h、BCp12處理后于37 ℃培養5、10、15 h時分別取樣,在10 000 r/min下離心5 min,加入等體積PBS按照1.3.2.1節方法洗滌3 次,收集菌體沉淀。向菌體沉淀中加體積分數為2.5%戊二醛溶液固定12 h,將固定好的菌體于室溫10 000 r/min離心2 min,除去固定液,PBS洗滌3 次后得到菌體沉淀。依次用體積分數為30%、50%、70%、80%、90%、100%的乙醇溶液梯度脫水,每次脫水時間為10 min,其中100%乙醇脫水2 次,并用100%乙醇重懸。最后,吸取一定量的重懸液在載樣臺上烘干,并進行鍍金,上樣,用掃描電子顯微鏡觀察[20]。
菌液處理同上,于37 ℃培養10、12 h時分別取樣。參考文獻[21],取PBS洗滌3 次后的菌體沉淀,加入體積分數為2.5%戊二醛溶液固定12 h;然后,離心收集菌體,用PBS沖洗,并加入體積分數為1%鋨酸溶液固定2~4 h;接著用不同梯度濃度的乙醇脫水,并將菌體沉淀用包埋劑進行處理,72 h后對包埋樣品進行超薄切片、染色;最后,用透射電子顯微鏡進行觀察、拍照[21]。
1.3.3 BCp12對大腸桿菌DNA影響的分析
1.3.3.1 凝膠阻滯實驗分析BCp12與菌體DNA的結合情況
參照Bandyopadhyay等[22]的研究方法,將大腸桿菌接種至無菌的LB液體培養基中,于37 ℃搖床培養,直至對數生長期,然后通過麥氏比濁法確定原菌液的濃度,取1.3.2.1節用PBS洗滌3 次的菌體沉淀,用PBS重懸得到1.0×106CFU/mL的大腸桿菌菌懸液1 mL,按照細菌基因組DNA提取試劑盒進行DNA提取。所獲得的DNA溶液用紫外分光計檢測其核酸濃度和純度,測定OD260nm和OD280nm。所提取的細菌基因組DNA純度均達到實驗的要求:1.7≤OD260nm/OD280nm≤1.9。取5.0 μL基因組DNA溶液與不同質量濃度(0、0.625、1.25、2.5、5 mg/mL)的抗菌肽等體積混合,置于37 ℃生化培養箱中作用30 min。反應結束后,用質量分數1%的瓊脂糖凝膠跑電泳,觀察和分析基因組DNA的遷移結果。
1.3.3.2 熒光光譜實驗分析BCp12與菌體DNA的作用方式
參照文獻[23]和文獻[24],用1×TE緩沖液將菌體DNA稀釋為50 μg/mL,然后,在96 孔板的每個孔中加入5 μL的DNA溶液和10 μL 100 μg/mL的EB溶液,混勻后置于37 ℃生化培養箱中,避光孵育10 min。接著加入50 μL不同質量濃度(0、0.625、1.25、2.5、5 mg/mL)的BCp12溶液,對照組用50 μL超純水代替,混勻后置于37 ℃生化培養箱中避光孵育30 min。孵育結束后,用多功能酶標儀測定樣品在激發波長535 nm及發射波長550~750 nm范圍內的熒光光譜。
1.4 數據處理與分析
所有實驗均進行3 次平行實驗,實驗數據采用SPSS Statistics 19 軟件與GraphPad Prism 8.3.0軟件進行統計分析,以平均值±標準差表示。采用Duncan法進行顯著差異性比較,P<0.05表示差異顯著。
2 結果與分析
2.1 BCp12對大腸桿菌生長繁殖的影響
2.1.1 BCp12對大腸桿菌的最小抑菌質量濃度及抑菌曲線
如圖1A所示,BCp12質量濃度越高,OD600nm越小,表示對大腸桿菌的抑菌效果越強。當BCp12的終質量濃度為2 mg/mL時,幾乎完全抑制了菌體的生長,由此確定BCp12的MIC為2 mg/mL。由圖1B可知,BCp12的抑菌菌效果與抗菌肽的質量濃度成正比關系。與空白對照組(添加無菌水)相比,添加BCp12的菌液,其生長繁殖受到了不同程度的抑制。當BCp12終質量濃度達到2 mg/mL及以上時,其菌體生長被明顯抑制。
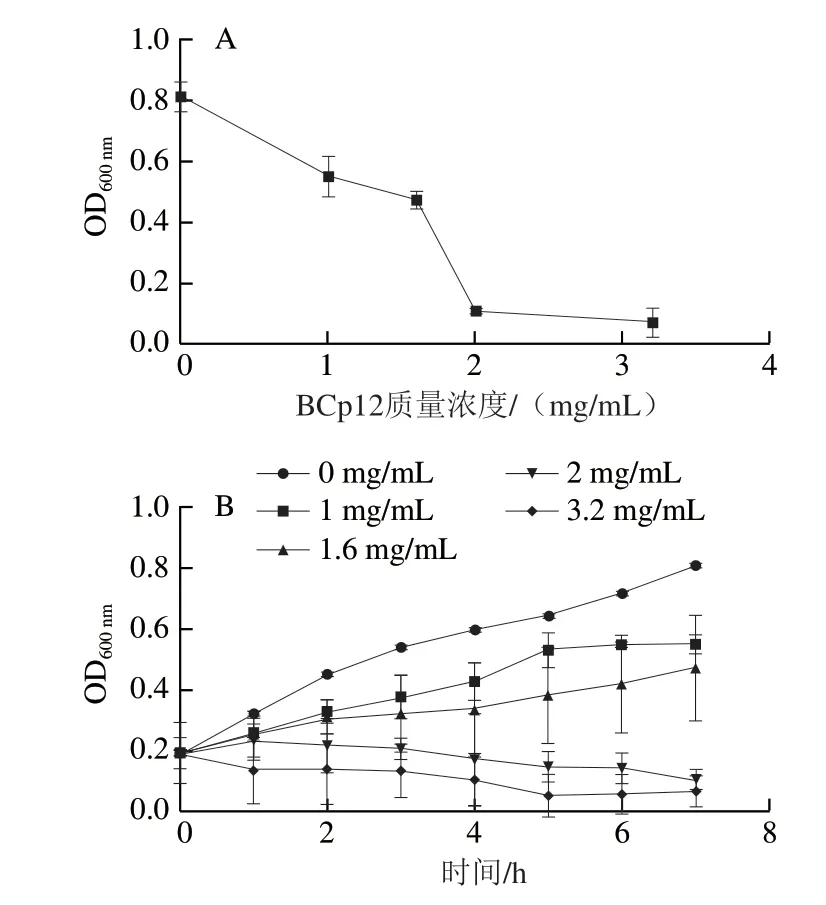
圖1 BCp12對大腸桿菌的MIC(A)和抑菌曲線(B)Fig. 1 Minimum inhibitory concentration (A) and time courses (B) of anti E. coli effect of BCp12 at different concentrations
2.1.2 對菌體生長曲線的影響
如圖2所示,BCp12對菌體的生長具有明顯的抑制作用。在0~14 h期間,空白對照組的菌體生長繁殖速度快,14 h之后趨于平緩,菌體的生長進入相對穩定的時期。添加BCp12的菌液,菌體在0~14 h生長速率也比較快,14 h以后呈現快速下降的趨勢,直至最終趨于穩定,但與空白對照組相比,菌體總量明顯降低。添加四環素的菌液,菌體生長被明顯抑制。通過對3 組的對比,可以看出BCp12有良好的抑菌效果。
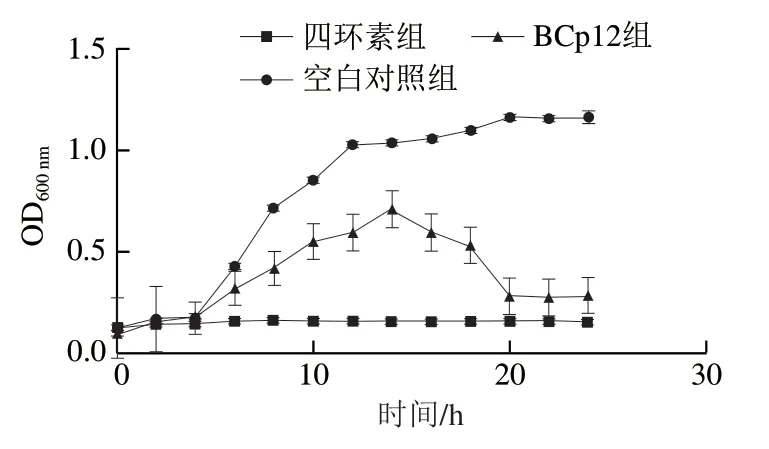
圖2 BCp12對大腸桿菌生長曲線的影響Fig. 2 Effect of BCp12 on the growth curve of E. coli
2.2 BCp12對大腸桿菌壁膜損傷的機制
2.2.1 對菌體細胞壁表面疏水性的影響
從圖3可見,BCp12能夠明顯降低菌體細胞壁的表面疏水性。BCp12處理1 h后大腸桿菌吸附率為79.8%,顯著低于相同作用時間的正十六烷組(84.3%);作用5 h時,正十六烷組和BCp12處理組大腸桿菌吸附率分別為79.95%和64.73%,BCp12處理組大腸桿菌吸附率表現出顯著低于相同時間的其他組(P<0.05)。相同作用時間下,正十六烷組大腸桿菌吸附率顯著低于KNO3組(P<0.05)。孫宜君[25]在螺旋藻抗菌肽的純化鑒定及其抑菌機理的研究中提到,正十六烷是一種有機相,大腸桿菌在水相和有機相中的吸附率是不同的,因此,細菌細胞表面疏水性可由吸附率的大小來反映。另外,阿琪瑪[14]對于疏水性的理解為細菌對于有機溶劑的吸附效果,疏水性越大則代表對有機溶劑的黏附效果越強。

圖3 BCp12對大腸桿菌細胞壁表面疏水性的影響Fig. 3 Effect of BCp12 on the surface hydrophobicity of E. coli cell wall
綜上所述,BCp12可以引起大腸桿菌細胞親水性增加。這是因為BCp12是陽離子抗菌肽,可與菌體細胞表面帶負電的脂多糖結合,導致細菌細胞表面疏水性降低,最終起到破壞細胞壁膜的作用。郭文杰等[26]的研究結果也表明,細胞表面疏水性降低可能是因為抗菌肽與菌體細胞表面相互作用,吸引電負性基團造成重排,從而導致菌體細胞表面電負性增強,疏水性下降。
2.2.2 對菌體細胞膜通透性的影響
如圖4所示,正常條件下,培養液中的核酸和蛋白質基本穩定在較低的水平。與對照組(添加無菌水)相比,菌體在1/2 MIC和MIC的BCp12下作用2 h,培養液中的核酸含量無顯著變化(P>0.05),蛋白質含量顯著增加(P<0.05)。作用4 h后,培養液中的核酸及蛋白含量均顯著增加(P<0.05)。

圖4 BCp12對大腸桿菌細胞膜通透性的影響Fig. 4 Effect of BCp12 on cell membrane permeability in E. coli
Bajpai等[27]研究表明,核酸作為細胞內重要的大分子物質,當菌體細胞完整性受到破壞時,正常狀態下不能透過細胞膜的大分子物質(核酸)通過“蛋白孔道”釋放出胞外,泄漏到菌懸液中,由于核酸在260 nm處有強吸收,所以可通過檢測菌懸液中核酸泄漏(260 nm處吸光度)的變化來評價細胞膜是否完整。Long Men等[28]的研究表明,核酸、蛋白質等生物大分子貫穿于整個細胞膜和細胞質之中,是細胞的重要組成結構,大腸桿菌細胞膜被破壞時,核酸、蛋白質等大分子物質就會泄漏到胞外。另外,抗菌肽也能通過改變細胞膜的通透性使細胞死亡[29]。
因此,通過測定菌懸液在260、280 nm處吸光度的變化,可分析細胞壁膜的受損情況。上述結果表明:大腸桿菌胞內核酸及蛋白質的泄漏量與BCp12的質量濃度、作用時間呈正比關系;BCp12通過破壞大腸桿菌細胞膜的完整性,致使其通透性增加,引起胞內核酸及蛋白質的滲漏,從而達到抑制菌體增殖的目的。
2.2.3 流式細胞儀分析菌體細胞膜的完整性
如圖5所示,M1和M8表示收集的50 000 個大腸桿菌細胞中完整細胞所占的百分比。由圖5A可知,未經BCp12處理的菌液在培養6 h后,細胞膜的損傷率幾乎為0。由圖5B可知,經過MIC BCp12處理的菌液,在培養6 h后,細胞膜的損傷率為25.1%,兩者相比差異較大。
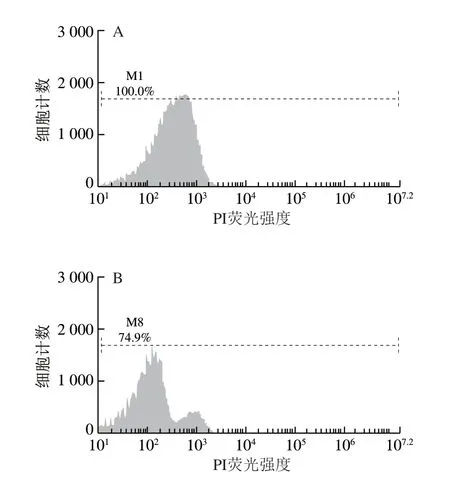
圖5 BCp12對大腸桿菌細胞膜完整性的影響Fig. 5 Effect of BCp12 on cell membrane integrity in E. coli
研究表明,PI是一種可對DNA染色的核染色試劑,當細菌細胞膜結構完整時,PI染料無法進入細胞,但當細菌細胞膜完整性遭到破壞后,該染料可穿過破損的細胞膜而對核酸染色,流式細胞儀檢測其為紅色熒光,PI熒光信號強弱能夠反映細胞膜完整性破壞程度[30]。由此可知,經BCp12處理后,菌體的細胞膜發生損傷,即細胞膜不完整,通透性增強。
2.2.4 BCp12對菌體細胞壁膜組分的影響
傅里葉變換紅外光譜技術可用來分析微生物細胞壁和細胞質膜的組成成分,通常可分為5 個區域來描述不同的細胞成分信息[18]:1)3 000~2 800 cm-1:脂肪酸信息區;2)18 00~1 500 cm-1:蛋白和多肽酰胺信息區;3)1 500~1 200 cm-1:混合信息區域(蛋白質和脂肪酸);4)1 200~900 cm-1:細胞壁多糖的信息區;5)900~500 cm-1:指紋信息區。如圖6所示,與對照組相比,BCp12在以上5 個區間的吸收峰強度出現明顯變化,這表明BCp12對大腸桿菌菌體的脂肪酸、蛋白和多肽酰胺、多糖、指紋信息區都有影響。另外,不同質量濃度的BCp12對大腸桿菌壁膜組分的影響,如MIC處理的菌體在3 600~2 500 cm-1區間的其吸收峰強度明顯高于1/2 MIC處理組。

圖6 BCp12對大腸桿菌細胞壁膜組分的影響Fig. 6 Effect of BCp12 on main components of the cell wall and membrane of E. coli
綜上所述,抗菌肽BCp12可以影響大腸桿菌細胞壁膜結構上的組分,與文獻[31]和文獻[19]報道的結果相似,也驗證了前述BCp12對大腸桿菌細胞壁膜的損傷作用。
2.2.5 對菌體壁膜超微結構的影響
如圖7A所示,未經BCp12處理過的菌體,其細胞表面圓潤光滑,飽滿。而經BCp12處理5 h的菌體,細胞形態發生變化,變得粗糙皺縮,無飽滿感,少部分細胞具有完整性(圖7B)。作用10 h,部分細胞發生自溶,甚至黏連在一起(圖7C)。作用15 h,菌體細胞大部分自溶,只有少數的幾個細胞保持桿狀形態(圖7D)。

圖7 掃描電子顯微鏡觀察抗菌肽BCp12對大腸桿菌超微結構的變化Fig. 7 Effect of the antimicrobial peptide BCp12 on the ultrastructure of E. coli observed by SEM
張子越[32]在水煎液體外抑制大腸桿菌和痢疾桿菌的作用機制的研究中發現,對照組的菌體形態正常飽滿,細胞壁和細胞膜結構完整,經1/2 MIC藥物作用6 h后,與對照組相比,有些菌體形態開始變得不規則,菌體變長,有的菌體皺縮變圓發生死亡。Matsuzaki[33]、Sebe[34]等關于抗菌肽作用機制的研究報道也證明了這一結論。由此確定,BCp12主要通過破壞菌體的細胞壁膜,致使胞內物質流出來,引起壁膜發生皺縮,變得凹凸不平,產生自溶現象,進而達到抑制菌體生長的效果。
如圖8所示,用無菌水處理的大腸桿菌細胞膜結構光滑完整,無破損,細胞內容物充實致密(圖8A、C)。與對照組相比,MIC BCp12作用菌體10 h,菌體細胞膜有明顯的孔洞、撕裂及受傷情況,且胞內物質發生泄漏(圖8B);作用菌體12 h,部分細胞壁膜、細胞器和細胞核區消失,甚至細胞質內出現空化現象(圖8D)。石偉[35]通過透射電子顯微鏡觀察發現,蜂毒肽melittin作用于水稻白葉枯病菌細胞膜后,細菌細胞膜結構破壞,內容物被完全釋放出來,且呈囊泡狀結構。這與本研究結果相似,也證實了BCp12能夠破壞菌體的細胞膜,且使菌體細胞器消失,進而出現空化現象,以達到抑制菌體生長繁殖的作用。

圖8 透射電子顯微鏡觀察抗菌肽BCp12對大腸桿菌超微結構的變化Fig. 8 Effect of the antimicrobial peptide BCp12 on the ultrastructure of E. coli observed by TEM
2.3 BCp12對大腸桿菌DNA的影響
2.3.1 凝膠阻滯實驗分析BCp12與菌體DNA的結合情況如圖9所示,BCp12可以與EB競爭性結合大腸桿菌的DNA,且使DNA在泳道中出現拖尾和偏移。當BCp12的終質量濃度在0~2.5 mg/mL時,BCp12與大腸桿菌DNA出現一定程度的結合,泳道中出現拖尾現象,同時有部分DNA被阻滯在凝膠孔中。當BCp12質量濃度為5 mg/mL時,DNA的遷移幾乎完全受阻,無法看到DNA的遷移條帶。謝海偉等[8]的研究表明,抗菌肽在較低質量濃度時結合到DNA表面,起到阻滯DNA遷移率的作用;高質量濃度的抗菌肽通過靜電作用力結合到DNA雙螺旋表面,競爭并阻礙EB和DNA的結合,從而在凝膠電泳中未發現電泳條帶。另外也有研究表明,DNA是最重要的遺傳物質之一,DNA的損傷會影響基因的表達,導致酶和受體蛋白質等合成受阻,最終導致細胞死亡[36]。由此可知,BCp12使菌體DNA在遷移過程中發生拖尾和偏移,影響DNA的正常復制,進而起到抑制菌體生長繁殖的作用。

圖9 BCp12與菌體DNA結合的凝膠阻滯分析Fig. 9 Gel retardation analysis of BCp12 binding to bacterial DNA
2.3.2 熒光光譜實驗分析BCp12與菌體DNA的作用方式
如圖10所示,BCp12促進DNA-EB復合物的熒光強度降低,且BCp12的質量濃度越高,其下降趨勢越明顯。與對照組相比,添加BCp12的菌液熒光強度明顯降低。研究表明,EB為靈敏度高、選擇性好的熒光探針,其本身的熒光很弱,能夠與雙鏈DNA以兩種方式結合[37]。EB可以通過靜電作用與雙鏈DNA的磷酸骨架結合,此時其熒光性質不變;但當它以較高親和力嵌入DNA的雙鏈內部的堿基對之間后使熒光強度大幅度增強,此外,當它與能產生相似作用的分子共存時,便相互競爭與DNA的結合,使EB-DNA復合體系的熒光發生變化[38]。劉莎[39]和Li Lirong[40]等也得到了相似的結論,抗菌肽能夠與EB相互競爭結合位點,并以嵌入方式結合DNA。由此可知,BCp12也是以嵌插的方式與EB競爭性地結合DNA,致使DNA-EB復合物的熒光強度明顯下降,進而影響DNA的正常復制,使菌體的生長繁殖受到抑制。

圖10 BCp12與EB競爭性結合菌體DNA的熒光光譜Fig. 10 Fluorescence spectra showing competitive binding of BCp12 and EB to bacterial DNA
3 結 論
BCp12通過降低大腸桿菌壁膜的表面疏水性,對菌體壁膜脂肪酸、蛋白、多肽酰胺、多糖及指紋信息區都有明顯影響,致使菌體壁膜損傷,從而引起胞內紫外吸收物質滲漏,菌體呈現自溶及空化現象,且以嵌插方式與DNA結合,產生凝膠阻滯現象,影響DNA正常復制,從而起到抑制菌體增殖的作用。

