海洋放線菌S187產抗補體活性物質的發酵工藝優化
徐小娜,牛海青,王曉霞,田 晴,高 茜,蘇 春
(1.咸陽職業技術學院醫藥化工學院,陜西 咸陽 712000;2.陜西師范大學生命科學學院,陜西 西安 710119)
海洋占地球表面積的70%,擁有非常豐富的微生物資源[1]。高壓、低溫、氧氣和鹽含量分布不均勻、營養匱乏、環境復雜等特殊性造就了海洋放線菌獨特復雜的代謝途徑,使得海洋放線菌代謝產物結構新穎、復雜多樣和生物活性較高[2]。人們從19世紀20年代開始對海洋放線菌代謝產物進行研究,大多集中在抗腫瘤、抗病毒和抗菌等方面,對抗補體活性方面的研究非常少。
補體系統是由30多種膜結合性蛋白、補體受體和可溶性蛋白組成的多分子系統,是存在于正常動物和人組織液及血清中的一組經活化后具有酶活性的蛋白質。補體系統的主要組分為C1~C9化合物,激活途徑主要有3種:經典途徑(classical pathway,CP)、旁路途徑(alternative pathway,AP)和凝集素途徑(lectin pathway,LP)[3]。但是,補體異常激活會引起許多疾病,如阿爾茲海默癥、風濕性關節炎等,其過度激活也會對紅細胞、血管、腎臟和關節等組織造成實質性損傷[4]。所以,抗補體活性藥物的研發引起了人們的廣泛關注。目前,臨床上普遍使用甲胺蝶呤、糖皮質激素、環磷酰胺等免疫抑制劑治療某些與補體異常激活相關的疾病,但這些抑制劑并非專一的補體抑制劑,選擇性較差,長期使用會造成機體的防御機能降低,從而造成抗感染能力下降,容易使潛在病灶擴散和繼發感染,并產生多種副作用和并發癥[5]。所以,臨床醫學上急需具有高效、低毒和專一等特性的補體抑制劑。
作者以抗補體活性為評價指標,在單因素實驗的基礎上,采用正交實驗優化海洋放線菌S187產抗補體活性物質的發酵工藝,擬為海洋放線菌S187抗補體活性物質的開發研究奠定基礎。
1 實驗
1.1 菌株與培養基
海洋放線菌S187,采自大連星海灣海底沉積物,保存于-80 ℃冰箱。
TSB培養基(M1)(g·L-1):胰蛋白胨 17,大豆蛋白胨 3,葡萄糖 5,NaCl 5,K2HPO42.5,自然pH值。
二號培養基(M2)(g·L-1):葡萄糖 10,可溶性淀粉 20,牛肉膏 3,蛋白胨 5,酵母提取物 5,(NH4)2SO45,CaCO34,pH值7.5。
ISP4培養基(M3)(g·L-1):可溶性淀粉 10,(NH4)2SO42,K2HPO41,NaCl 1,蛋白胨 1,酵母粉 0.5,CaCO32,微量元素 100 μL,pH值7.2~7.5。
ISP2培養基(M4)(g·L-1):酵母提取物 4,麥芽提取物 10,葡萄糖 4,pH值7.2~7.5。
AM2ab 培養基(M5)(g·L-1):大豆粉 5,酵母粉 5,可溶性淀粉 20,蛋白胨 2,CaCO32,pH值7.2~7.5。
RA培養基(M6)(g·L-1):麥芽提取物10,葡萄糖 10,玉米粉 5,可溶性淀粉 20,麥芽糖 10,微量元素 100 μL,pH值7.2~7.5。
豆粉培養基(M7)(g·L-1):可溶性淀粉 20,大豆粉 25,(NH4)2SO42,NaCl 2,K2HPO40.5,CaCO35,pH 值7.2。
A1培養基(M8)(g·L-1):可溶性淀粉 10,酵母粉 4,蛋白胨 2,人造海鹽 28(可用75%的海水代替人造海鹽),自然pH值。
九號培養基(M9)(g·L-1):玉米粉 30,大豆粉 7,KNO31.5,K2HPO40.5,pH值7.5。
大豆粉先煮沸,用8層紗布過濾后再加入到培養基中;微量元素(mg·L-1):ZnCl2800,FeCl3·6H2O 4 000,CuCl2·2H2O 200,MnCl2·4H2O 200,NaB4O7·10H2O 200;配制固體培養基均加入2%瓊脂;所有培養基均用滅菌鍋121 ℃滅菌20 min。
1.2 方法
1.2.1 菌種活化及種子液的制備
菌種活化:取保存于-80 ℃冰箱中的菌懸液1 mL,涂布于M9固體培養基平板上,于28 ℃培養4~8 d。
種子液的制備:用接種環從平板上刮取1 cm2活化的菌株S187孢子,接種于裝有50 mL M1液體培養基的250 mL三角瓶中,于28 ℃、220 r·min-1培養2 d。
1.2.2 樣品制備
種子液經離心后,得到上清液和菌絲體;用乙酸乙酯反復萃取上清液3次;用甲醇-丙酮(體積比1∶1)過夜破壁浸提菌絲體,減壓蒸餾得到菌絲體水溶液,再用等體積的乙酸乙酯反復萃取3次;將上述兩個乙酸乙酯萃取液合并,濃縮得到浸膏;再用5% 二甲基亞砜溶液超聲溶解、稀釋,得到濃度為0.06 mg·mL-1的菌株S187代謝產物的粗提物。
1.2.3 菌株S187代謝產物的抗補體活性測定
(1)5倍巴比妥緩沖液(5×BBS):取2.875 g巴比妥鈉溶于250 mL熱水中,加入42.5 g NaCl、0.84 g MgCl2·6H2O、0.14 g CaCl2、1.0 g巴比妥,再加入三蒸水至1 000 mL,即得。實驗時將5×BBS緩沖液直接稀釋成1×BBS緩沖液。
(2)2%綿羊紅細胞(2%SRBC):取2 mL綿羊血,用1×BBS緩沖液洗滌后,3 000 r·min-1離心5 min,重復洗滌3次,再補加1×BBS緩沖液至2 mL,混勻;取約0.5 mL于紅細胞的壓積管中,3 000 r·min-1離心10 min,測定綿羊紅細胞的體積百分比,加入適量1×BBS緩沖液配制成2%SRBC。
(3)溶血素(效價1∶4 000):實驗時用1×BBS緩沖液將效價1∶4 000的溶血素稀釋成1∶1 000。
采用經典途徑溶血法[6-7]測定菌株S187代謝產物的抗補體活性:將樣品與補體混合均勻,置于37 ℃水浴鍋中水浴10 min;按表1加入1×BBS緩沖液、溶血素和2%SRBC,于37 ℃水浴30 min后,放在冰上冷卻;于4 ℃、5 000 r·min-1離心10 min,取上清液0.2 mL于96孔板中,用酶標儀測定OD405值。同時設置樣品對照組、補體組和全溶血組。將樣品組的OD405值扣除相應樣品對照組的OD405值后計算溶血抑制率(抑制率越高,抗補體活性越高)。按下式計算抗補體活性:
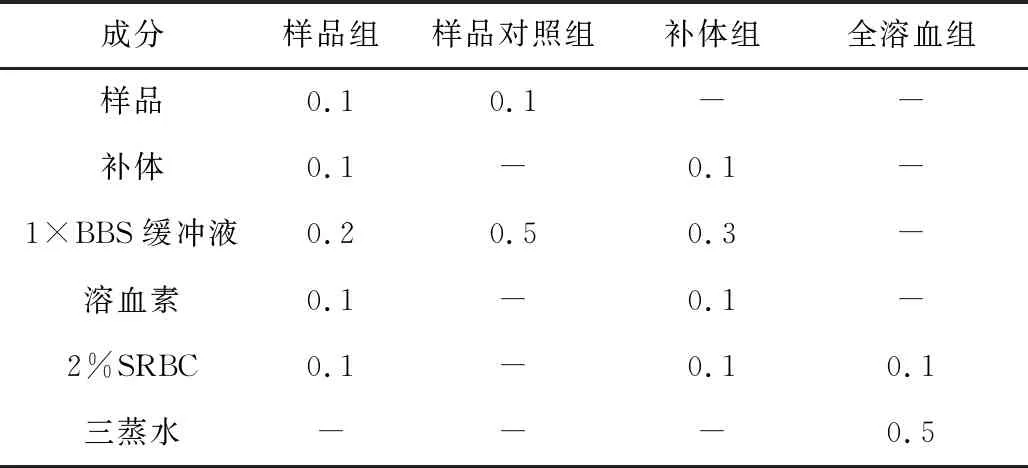
表1 經典途徑溶血法測定抗補體活性實驗中各處理組成分/mL

1.2.4 發酵工藝優化
以抗補體活性為評價指標,先分別考察碳源、氮源、發酵時間、初始pH值對菌株S187代謝產物抗補體活性的影響;然后在單因素實驗的基礎上,選取碳源含量、氮源含量、發酵時間、初始pH值為考察因素,采用L9(34)正交實驗優化菌株S187產抗補體活性物質的發酵工藝,利用SAS軟件分析數據。
2 結果與討論
2.1 基礎培養基的篩選
取3 mL種子液分別接種于M1、M2、M3、M4、M5、M6、M7、M8等8種液體培養基中,于28 ℃、220 r·min-1培養6 d,測定菌株S187代謝產物的抗補體活性,結果如圖1所示。
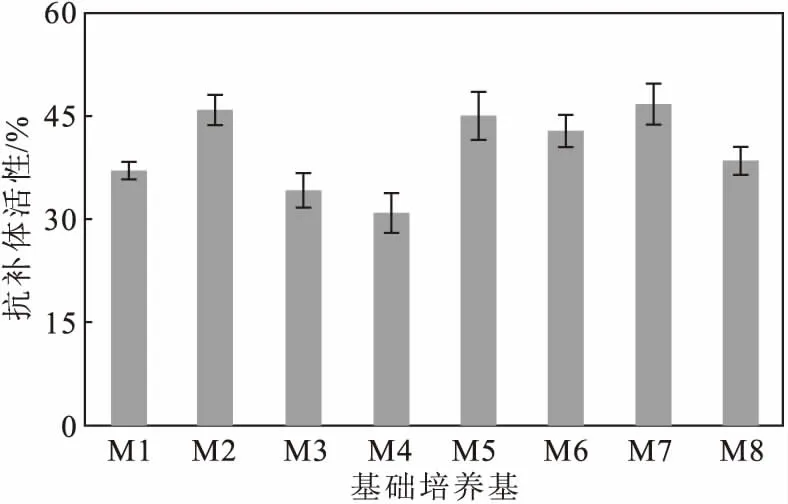
圖1 菌株S187在不同培養基中代謝產物的抗補體活性
從圖1可以看出,菌株S187在M7培養基中培養時,代謝產物的抗補體活性最高。因此,選擇M7培養基作為基礎培養基進行發酵工藝優化。
2.2 單因素實驗結果
2.2.1 碳源對抗補體活性的影響
在基礎培養基其它成分不變的條件下,分別以葡萄糖、麥芽糖、蔗糖和乳糖等量替換基礎培養基中的可溶性淀粉,測定菌株S187代謝產物的抗補體活性,考察碳源對抗補體活性的影響,結果如圖2所示。
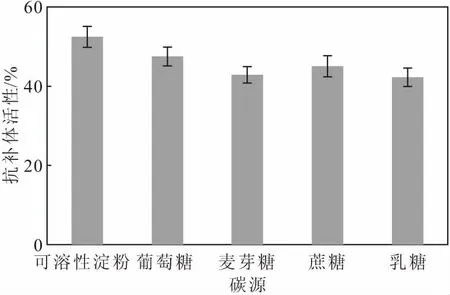
圖2 碳源對抗補體活性的影響
從圖2可以看出,以可溶性淀粉為碳源時,菌株S187代謝產物的抗補體活性最高,其次是葡萄糖、蔗糖和麥芽糖;以乳糖為碳源時的抗補體活性最低。因此,確定最佳碳源為可溶性淀粉。
2.2.2 氮源對抗補體活性的影響
在基礎培養基其它成分不變的條件下,分別以花生粉、蛋白胨、玉米粉和牛肉粉等量替換基礎培養基中的大豆粉,測定菌株S187代謝產物的抗補體活性,考察氮源對抗補體活性的影響,結果如圖3所示。
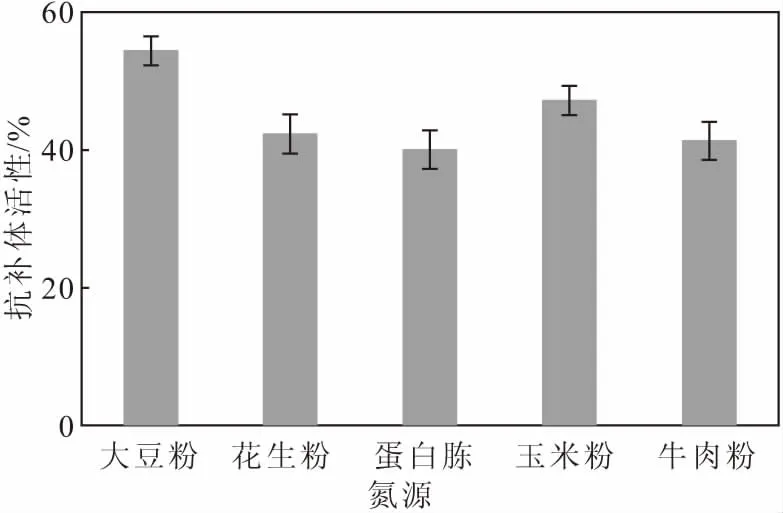
圖3 氮源對抗補體活性的影響
從圖3可以看出,以大豆粉為氮源時,菌株S187代謝產物的抗補體活性最高,其次是玉米粉、花生粉和牛肉粉;以蛋白胨為氮源時的抗補體活性最低。因此,確定最佳氮源為大豆粉。
2.2.3 發酵時間對抗補體活性的影響
將種子液按6%的接種量接種于基礎培養基中,于28 ℃、220 r·min-1下分別發酵3 d、4 d、5 d、6 d、7 d,測定菌株S187代謝產物的抗補體活性,考察發酵時間對抗補體活性的影響,結果如圖4所示。
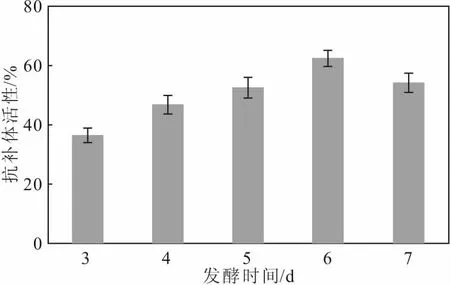
圖4 發酵時間對抗補體活性的影響
從圖4可以看出,發酵時間對菌株S187代謝產物的抗補體活性影響較大;隨著發酵時間的延長,抗補體活性呈先升高后降低的趨勢,在發酵第6 d時,抗補體活性達到最高。這是因為,隨著發酵時間的延長,抗補體活性物質的產量逐漸增多,抗補體活性相應逐漸升高;但發酵時間過長,抗補體活性物質逐漸被消耗,抗補體活性反而會降低。因此,發酵時間以6 d為宜。
2.2.4 初始pH值對抗補體活性的影響
將基礎培養基初始 pH值分別調至4.0、5.0、6.0、7.0、8.0,將種子液按6%的接種量接種于基礎培養基中,28 ℃、220 r·min-1下發酵6 d,測定菌株S187代謝產物的抗補體活性,考察初始pH值對抗補體活性的影響,結果如圖5所示。
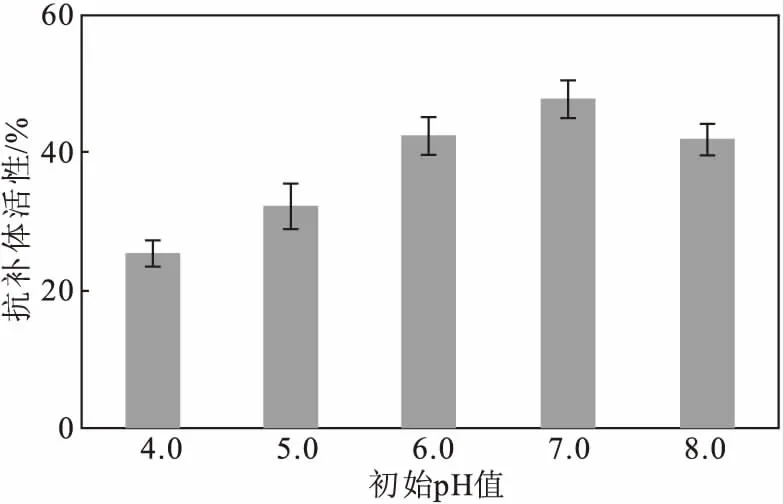
圖5 初始pH值對抗補體活性的影響
從圖5可以看出,當基礎培養基初始pH值為7.0時,菌株S187代謝產物的抗補體活性最高,進一步證明,在發酵過程中,只有在合適的環境下,菌株才能正常生長并產生代謝產物;當初始pH值低于7.0或者高于7.0時,代謝產物的抗補體活性均有不同程度的降低。因此,基礎培養基初始pH值以7.0為宜。
2.3 正交實驗結果與方差分析
在單因素實驗的基礎上,選取可溶性淀粉含量(A)、大豆粉含量(B)、發酵時間(C)、初始pH值(D)為考察因素,采用L9(34)正交實驗優化菌株S187產抗補體活性物質的發酵工藝。正交實驗的結果與分析見表2,方差分析見表3。

表2 正交實驗的結果與分析
從表2、3可以看出,各因素對抗補體活性影響的大小順序依次為D>B>C>A;因素B和D有顯著性差異,因素A和C沒有顯著性差異。結合極差分析,最終確定最佳發酵工藝為A2B3C3D3,即可溶性淀粉20 g·L-1、大豆粉35 g·L-1、發酵時間7 d、初始pH值7.5。
2.4 工藝驗證
分別稱取20 g·L-1可溶性淀粉、35 g·L-1大豆粉,基礎培養基其余成分不變,調節初始pH值為7.5,發酵7 d,進行3次重復實驗。測得菌株S187代謝產物的抗補體活性分別為69.35%、69.38%、69.33%,平均抗補體活性為69.35%。表明該工藝穩定可靠。
3 結論
采用單因素實驗和正交實驗優化了海洋放線菌S187產抗補體活性物質的發酵工藝。確定最佳發酵工藝為:可溶性淀粉20 g·L-1,大豆粉35 g·L-1,(NH4)2SO42 g·L-1,NaCl 2 g·L-1,K2HPO40.5 g·L-1,CaCO35 g·L-1,初始pH值7.5,于28 ℃、220 r·min-1下發酵7 d。在此條件下,海洋放線菌S187代謝產物的抗補體活性為69.35%。為海洋放線菌S187代謝產物的抗補體活性的進一步研究奠定了基礎。

