高分子聚合物栓塞微球的研究進展
李 楓,楊嘉豪,賴耿昌,王建南,2,許建梅,2
(1.蘇州大學 紡織與服裝工程學院,江蘇 蘇州 215021;2.蘇州大學 紡織行業醫療健康用蠶絲制品重點實驗室,江蘇 蘇州 215127)
腫瘤,特別是惡性腫瘤一直是臨床醫學領域的難題。對于治療腫瘤的常規方法有手術切除、放射療法、化學藥物療法。手術治療可直接切除病變部位,但對于癌細胞已發生轉移的情況,并沒什么特別的效果。腫瘤切除還可能存在不夠徹底,造成繼發性癌細胞轉移。特別是為了獲得較好的手術效果,會在術前配合使用放化療手段,先損傷或殺死部分癌細胞以減小腫瘤尺寸,從而減小手術切除尺寸,降低手術風險,但放療和化療方法存在一定的缺點,由于是針對全身性的,在殺死癌細胞的同時,也會損傷人體正常細胞。
近年來,隨著微創介入技術的快速發展,經動脈栓塞術(TAE)逐漸成為一種倍受青睞的治療手段。介入治療是通過導管向靶細胞注射栓塞物質,對流向腫瘤細胞的主血管進行阻塞,進而阻斷腫瘤細胞的血氧供給,使得腫瘤變小或者壞死;也可在栓塞物質中加入化療藥物,進行經動脈化療栓塞術(TACE),在阻斷血氧供給的同時釋放化療藥物,加速腫瘤細胞死亡。常規的TACE 是利用化療藥物與碘油混合注射,選擇性地阻塞腫瘤供血動脈,從而引起靶腫瘤的細胞毒性和缺血效應,導致靶腫瘤缺血性壞死[1]。雖然碘油和傳統的化療方法相比,降低了藥物的全身性擴散,但仍有藥物擴散到身體正常部位,損傷正常細胞;且對腫瘤進行治療時需藥物持續釋放,使腫瘤內部始終保持高的藥物濃度,液體栓塞劑碘油很難做到。栓塞微球作為介入治療中的固體栓塞劑,可有效將藥物靶向腫瘤部位,降低藥物全身性的擴散,克服液體栓塞劑的缺點。
在介入栓塞治療中:根據目標血管的大小需要選擇相應尺寸的栓塞微球,微球應尺寸均一,具有不同粒徑規格可供選擇;作為與生物體直接接觸的材料,微球應具有較好的生物相容性、低細胞毒性;栓塞時為使微球到達盡可能遠的血管端,微球還應具有一定的彈性可變形性;根據腫瘤的種類、病程等特點可負載不同的化療藥物,對藥物有良好的負載率,對藥物釋放具有可控性,最大程度地保持藥物活性等。為此,有關栓塞微球的各類研究也逐漸增多。在制備栓塞微球的研究中,高分子聚合物材料常作為載體材料,可利用單一材料如殼聚糖[2-4]、明膠[5-6]等進行制備,也可利用2種不同材料如殼聚糖和絲素蛋白[7]、殼聚糖和明膠[8-9]等進行復合制備。對于載藥栓塞微球所載藥物的選擇,有裝載5-氟尿嘧啶(5-FU)[2-3]、順鉑等化療藥物;對于其他功能性微球如光熱效應[10]的研究也逐漸成為熱點。
介入治療具有微創、療效好、副作用少等優點。目前,臨床使用的栓塞微球產品雖然仍比較單一,大都是不可降解的聚乙烯醇微球,但隨著載藥微球制備技術的不斷成熟與發展,相信在未來臨床上會有更多種類的載藥栓塞微球可供選擇。本文介紹了栓塞微球的分類及作用機制;綜述了目前栓塞微球研究中所用到的各類載體材料的特點及研究現狀;分析了栓塞微球的多種制備方法及成球特點,以及載藥微球所載藥物的分類、適用性、相應的制備特點等;最后總結了未來藥物栓塞微球研究的多種研究方向。期望未來栓塞微球的研究可以向多功能化、可降解性、藥物可緩控釋方向發展。
1 栓塞微球的分類及作用機制
栓塞微球的分類具有多種形式。根據載體材料不同可分為殼聚糖栓塞微球、海藻酸鈉栓塞微球、復合栓塞微球等。根據栓塞微球降解性可分為可降解栓塞微球和不可降解栓塞微球。根據栓塞微球作用可分為空白栓塞微球、功能性栓塞微球等。根據栓塞微球的作用機制可分為空白栓塞微球和載藥栓塞微球。微球的尺寸一般為微米級,范圍在100~1 200 μm之間,可劃分為多種不同尺寸規格,比如100~300、300~500 μm,依此類推。臨床手術時根據所需栓塞部位的血管粗細選擇相匹配規格的栓塞微球。
對于空白栓塞微球而言,其作用機制是通過微球對病變部位進行物理阻塞,栓塞微球經動脈插管注入腫瘤供血動脈后,可阻斷流向腫瘤細胞的血液,切斷供養,從而使腫瘤細胞壞死、凋亡。這種方式特別適用于良性腫瘤。對于載藥微球而言,其作用機制除進行物理栓塞外,還會因其負載化療藥物,可靶向作用于病變部位。當微導管將載藥栓塞微球注入腫瘤供血動脈,在阻斷腫瘤的營養供給時,栓塞微球中的藥物也同時緩慢持續釋放,使得抗癌藥物能直接作用于腫瘤部位加速腫瘤細胞壞死[10]。
有研究認為栓塞微球若具有生物降解性,會發揮更好的作用[11]。不具有生物降解性的微球在進行栓塞手術前后一般要配合使用高劑量的化療藥物給藥。而采用高劑量給藥時,身體往往會產生較大的反應,比如惡心、脫發、嘔吐、病變部位疼痛,甚至不可逆的心臟毒性等;且在不破壞肝的微循環系統下,很難控制癌細胞與藥物的接觸時間,以及預測藥物濃度隨時間的變化[11]。采用可降解材料制備的藥物微球可克服前述缺點,藥物被可控釋放。
生物降解性微球能夠讓病變部位實現多次給藥,在腫瘤細胞壞死前,使病變部位始終保持高濃度的藥物;當腫瘤細胞徹底壞死時,生物降解微球能夠被周圍組織逐漸吸收,不僅減輕了全身性給藥引起的副作用,大大減小了手術切除尺寸,甚至避免了手術移除。富血小板血漿在體外具有一定的治療潛力,但在體內卻會被迅速清除,無法實現緩釋,可利用具有生物可降解性的聚乙二醇微球進行負載。由于富血小板血漿的存在,聚乙二醇微球降解效果受血小板聚集和凝血的影響,抑制了微球快速降解,實現了微球降解速度可控,藥物隨著微球緩慢降解實現持續釋放[12]。
化療靶向藥物微球作用于惡性腫瘤中,化療藥物往往殺死腫瘤細胞的同時,也破壞了正常細胞組織的功能,造成免疫系統損害,而靶向藥物可以極大地避免這種情況的出現,靶向藥物進入人體后會向病變部位瞄準或集聚,僅在病變部位釋放有效成分,極大減小了藥物毒負作用。而栓塞微球中負載化療藥物實際上也是使栓塞微球具有被動靶向的功能。
在栓塞微球中負載一些抗體、多肽類主動靶向藥物,則可更大程度上提高靶向藥物的利用率,更快更有效地殺死腫瘤細胞。為使栓塞微球具有主動靶向功能,還可在微球中加載一些金屬磁性粒子,使微球具有磁性運輸、靶向給藥和癌癥熱療。肖文謙等[13]在羥基磷灰石(HA)中加入Fe3O4制備HA/Fe3O4磁性復合微球,使微球可磁性運輸,具有靶向給藥功能。Qiao等[14]利用固體腫瘤內部酸性環境的特點,利用十二烷基硫酸鈉輔助沉淀法制備了由納米羥基磷灰石晶體組成的具有pH值敏感性的空心介孔栓塞微球,該微球可負載各類化療藥物,在正常細胞組織中不釋放藥物,而僅在微球處于腫瘤內部的酸性環境中才釋放藥物,實現靶向給藥。
目前,功能性藥物栓塞微球逐漸成為研究的方向和熱點。比如癌痛尤其是晚期癌痛對癌癥患者來說是難以承受的,而止痛藥特別像非甾體鎮痛藥對人體的胃黏膜損害很大,嚴重時甚至會引起出血和穿孔。因為大部分癌痛都是發生在腫瘤部位,這時就可以通過在微球中負載一些緩解疼痛感的藥物,在介入栓塞治療的同時緩解病人的疼痛,提高生命質量。有些癌痛不嚴重,但進行栓塞手術時也會產生難以忍受的疼痛。為緩解這些疼痛,有研究將止痛藥利多卡因負載在聚丙烯酸栓塞微球[15]。
近年來,光熱治療在腫瘤治療中越來越受到關注,這種療法是利用光熱材料如銅、銀、鉑等金屬納米粒在外部光源的照射下將光能轉化為熱能來殺死癌細胞。這種方法副作用小,療效明顯,但是很難注入到生物體內部。如果采用栓塞微球負載光熱材料則可有效解決其缺點,直接作用于腫瘤部位。Zou等[10]將具有很強的近紅外光吸收和良好的光熱效應的硫化鉍納米粒子負載在藻酸鹽栓塞微球中,使得微球具有光熱治療效果。該研究還同時將化療藥物阿霉素也一起負載,使得栓塞微球同時具有光熱治療與化療的雙重作用。
2 栓塞微球制備的載體材料
栓塞微球要植入體內,與人體肌體、血液、體液直接接觸,因此,需具有生物相容性、化學穩定性和可降解性,同時又易于獲得與加工。藥物載體材料有天然高分子聚合物和合成高分子聚合物。天然高分子聚合物價格低廉,來源廣泛,用作栓塞微球的主要有殼聚糖、海藻酸鹽、明膠等。合成高分子聚合物主要有聚丙烯酸。表1列舉了一些制備栓塞微球的主要高分子聚合物的研究情況。可以看到,目前用來制備栓塞微球的載體材料中,涉及殼聚糖的研究較多,這是因為其具有良好的成球性以及對多種制備方法的適用性,殼聚糖也常與其他一些高分子聚合物如明膠、絲素蛋白等復合制備微球;交聯劑大都采用多聚磷酸鈉、京平尼、多酚、甲醛/戊二醛,醛類交聯效果好但是具有一定的毒性,京平尼雖然沒有毒性但是價格高,多酚類交聯劑毒性低,價格便宜,但是交聯效果欠佳。

表1 高分子聚合物栓塞微球的研究狀況Tab.1 Research on polymer embolic microspheres
2.1 殼聚糖
殼聚糖(CS)是甲殼類動物的外骨骼和真菌細胞壁中具保護和支持作用的聚多糖,是N-乙酰-D-葡糖胺和D-糖胺的共聚物,由甲殼素堿化脫乙酰基制得,其結構和人體骨膠原相似,雙重相似性使其具有優異的生物相容性,是自然界唯一存在的堿性多糖,具有止血鎮痛作用。由于其具有抗菌性,可用來制備抗潰瘍藥物和傷口的滅菌消毒[2-4]。但殼聚糖溶于稀酸,并不溶于水及有機溶劑,因而并不適合用于負載對酸不穩定的藥物,可通過對殼聚糖的結構進行修飾來增加其水溶性[34]。
殼聚糖作為載體材料可裝載5-FU、鹽酸四環素等多種藥物。文獻[2-3]都制備了裝載5-FU的殼聚糖微球,使得緩釋時間增加,緩釋作用明顯。邵麗等[4]制備了載有鹽酸四環素的殼聚糖微球,可更好地治療牙周病。為確定栓塞劑的位置并評估治療效果,可制備裝載超順磁性氧化鐵納米粒子的殼聚糖微球[22]。不同脫乙酰度的殼聚糖微球的性能不同,高乙酰化殼聚糖要比殼聚糖微球降解速度快且粒徑大,對藥物(如阿霉素)的載藥率高[18]。
純殼聚糖微球雖被廣泛制備,但殼聚糖與其他材料的復合使用,更能優化微球性能。殼聚糖帶有正電荷,限制了對阿霉素等正電荷藥物的負載率,且其制備通常以有毒的戊二醛作為交聯劑。為不使用有毒的戊二醛并提高其對阿霉素的負載,可使其與帶負電荷的氧化海藻酸鹽進行自組裝[35]。殼聚糖也可與絲素蛋白[7]或者聚(2-丙烯酰胺-2-甲基丙磺酸)[36]進行復合,提高藥物的可控釋性能,延長緩釋時間。為提升微球的功能性,磁性粒子與殼聚糖的復合[23]可用作放射性核素靶向載體,使放射性核素達到局部高濃度,同時盡量減少對正常組織的照射損傷。
2.2 海藻酸鹽
海藻酸鹽是由β-D-甘露糖基和α-L-葡萄糖基通過1→4糖甙鏈連結而成的水溶性陰離子多聚糖,帶有負電荷,可與陽離子結合,具有良好的生物相容性、生物降解性、一定的pH敏感性、良好的水溶性以及良好的粒徑和溶脹比。海藻酸鹽的種類有很多,常用于栓塞微球制備的有海藻酸鈣、海藻酸鈉等。Rong等[31]基于靜電液滴技術制備了負載凝血酶的海藻酸鈣栓塞微球,球形圓整均一,平均粒徑在350 μm左右。該栓塞微球無刺激性、無遺傳毒性,具有較好的生物相容性,在體內應用時會引起輕微的暫時性炎癥。大型動物實驗表明,該栓塞微球在經動脈栓塞術處理腹部實質臟器的出血方面是有效與安全的。
采用其他方法如乳化交聯法制備海藻酸鹽栓塞微球時,海藻酸鈉成球性較差,不利于栓塞,所以常與帶正電荷的材料進行復合。殼聚糖帶正電,海藻酸鈉帶負電,為制備具有良好緩釋性的海藻酸鈉載藥微球,通過正負電荷的結合作用,可使殼聚糖和海藻酸鈉進行復合,殼聚糖的加入使得微球厚度增加,減緩了藥物分子的釋放速率,從而有效延長釋放時間[25]。絲素蛋白具有良好的柔韌性和抗拉強度,以及較強的可塑性,所以絲素蛋白微球具有良好的成球性。通過自組裝的方法使絲素蛋白和海藻酸鈉復合,制備的微球表面光滑,成球性良好[37-38]。為使海藻酸鈣微球具有多功能性(如光熱效應),可通過在海藻酸鈣微球上負載金屬物質(硫化鉍納米粒子、金納米星)來實現[10,39]。
2.3 聚丙烯酸
聚丙烯酸是具有生物降解性和生物相容性的高分子材料,且性能穩定,也常被用作微球載體。利用聚丙烯酸制備的微球外形圓整,表面光滑,有優異的抗壓縮能力,可均勻裝載阿霉素藥物[40]。為使聚丙烯酸微球具有良好的超順磁性,可被T2加權磁共振成像靈敏檢測到,可在聚丙烯酸微球中加入超順磁性氧化鐵[30]。栓塞過程中或者栓塞后會引起一些疼痛,可在聚丙烯酸微球中加入能緩解疼痛感的利多卡因藥物緩解[15]。
2.4 明 膠
明膠是一種天然的線性聚合物,由氨基酸和多肽組成的膠原蛋白的基本分子單位構成。明膠成品中蛋白質含量(超過80%)最高,其他少量組分有水分和無機鹽。明膠具有良好的生物相容性和可降解性,是制備微球的理想生物材料,但明膠的抗氧化性不好,其可與多酚進行復合,制備得到具有納米級尺寸,又能有較高的氧化穩定性的微球[6]。明膠對帶有正電荷的阿霉素負載率不高,可加入負電荷羧基對明膠微球進行改性,提高對阿霉素的載藥率[5]。殼聚糖與明膠復合可改善微球的成球性,增強其球形的圓滑與剛性[41]。
3 栓塞微球制備方法
栓塞微球的制備方法有很多,主要有乳化交聯法、離子凝膠法、微流控技術、膜乳化技術等。方法的不同決定了栓塞微球中藥物和載體的結合方式不同,成球的尺寸與均一度不同,從而也進一步影響了藥物的釋放行為和藥物活性。
3.1 乳化交聯法
乳化交聯法是在溶液中加入乳化劑,當溶液充分乳化之后加入交聯劑,使溶液固化成球的方法。該方法反應條件溫和,制備載藥微球可保持藥物活性,且在制備過程中無需調節溫度或是加入凝聚劑,就可獲得納米級的微球[42]。雖然乳化交聯法可制備均勻的微米級的栓塞微球[43]和具有良好緩釋性的載藥微球,但使用乳化交聯法時,微球的最終形態受到工藝過程中多種因素的影響,如:攪拌速度、油水二相的相比等,且在乳化過程中也會使用到有毒的交聯劑,如甲醛、戊二醛等。使用乳化交聯法制備一個良好規格的微球,對工藝過程步驟的要求很高。
3.2 離子凝膠法
離子凝膠法被廣泛應用于殼聚糖微球的制備中,通常是在高速攪拌狀態下使得溶液中的陰離子和陽離子進行交聯反應,最終獲得微球。離子凝膠法的反應條件比較溫和,無需有機溶劑就能保持藥物的活性[44]。常規的載藥殼聚糖微球一般采用三聚磷酸鈉作為凝結劑,殼聚糖帶正電荷的氨基與帶負電荷的聚陰離子三聚磷酸鈉發生靜電相互作用。藥物與微球利用靜電作用相結合,所以不牢固且藥物突釋性高。有研究以油脂和油酸酯為乳化劑,使用添加油的乳液凝膠法,制備了包埋兒茶素的海藻酸鈣微球。與無油的乳液凝膠法相比,提高了包覆率,抑制了兒茶素的爆釋[9]。
3.3 微流控技術
微流控技術是基于微流控芯片完成的,微流控芯片具有特定的微通道結構。可控制微流控芯片的內部通道結構,使溶液形成液滴狀或是層流狀。在制備過程中,連續相和分散相是獨立分布于2個微米級通道內,當兩相流到2個通道的接口處時,由于通道內流體的速度很快,極大的剪切力和表面張力會把分散相剪切掉然后分散在連續相中,形成水包油、油包水等形式。該方法的制備原理和乳化交聯法一樣,但因其制備過程中乳化和交聯是獨立完成的,所以又區別于乳化交聯法[45]。
基于液滴的微流控技術已經成為一種強大的微球制備方法,其制備微球的尺寸和微觀結構可控。有些金屬粒子如Gd2O3和Fe2O3可負載在微球中,使得微球具有自顯影的效果,便于確定栓塞劑的位置并評估治療效果,但金屬離子想要包覆在微球中,通過乳化交聯法和離子凝膠法很難實現,這時可采用微流控技術進行制備。Zou等[10]制備的硫化鉍納米粒子微球具有獨特的納米結構,微球粒徑均勻,約為170 μm,且負載抗癌藥物(阿霉素(DOX))的硫化鉍納米粒子微球在近紅外激光照射下具有較好的緩釋性能和釋藥速率,其制備工藝如圖1所示。Wang等[29]基于液滴微流控技術,加入了Gd2O3和Fe2O32種金屬粒子,制備了具有良好的雙模成像性能,可以有效地確定栓塞劑的位置的納米聚乙烯醇微球。
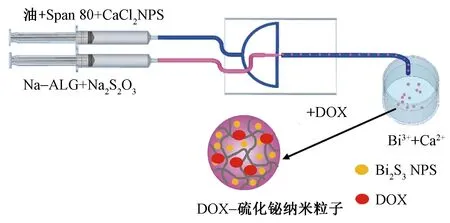
圖1 硫化鉍納米粒子微球的制備工藝Fig.1 Preparation of bismuth sulfide nanoparticles microspheres
3.4 膜乳化技術
膜乳化技術是基于膜乳化器完成的,先利用乳化法獲得粒徑比膜孔孔徑大的預乳液,施加外部壓力使預乳液快速通過微孔膜,形成尺寸均勻的乳滴。此操作重復3~5次,待乳液固化后就能得到尺寸均勻的微球。膜乳化技術制備條件溫和,耗能低。因為微孔膜的尺寸是可供選擇的,因此根據所需要的微球粒徑選擇合適的微孔膜,可有效控制微球粒徑大小[46]。殼聚糖微球對于藥物的負載,通常只需將藥物分散在殼聚糖水相中,就可將藥物包封在微球中。而對于含有氨基的蛋白質類藥物,當殼聚糖微球經交聯固化后,藥物會在微球內發生交聯。可先用膜乳化技術制備了殼聚糖微球,再采用吸附法將蛋白質藥物加載到微球中[20]。
3.5 其他制備方法
除以上幾種常見的微球制備方法,還有噴霧干燥法、溶劑蒸發法、高壓靜電分化法等。噴霧干燥法是運用物理方法包埋藥物,載藥微球中藥物的生物活性能夠被保持,但藥物釋放速度快,并伴有爆釋效應[21]。溶劑蒸發法是通過從乳狀液中去除分散相里的揮發性溶劑來制備微球的方法,可用于制備包覆阿司匹林的載藥微球,藥物的負載率更高[47]。為制備具有較高載藥量并具有適宜相變溫度的載藥微球,可通過乳液聚合制備應用于肝動脈栓塞的N-異丙基丙烯酰胺/丙烯酸無規共聚納米凝膠[48]。高壓靜電分化法是一種利用電流體動力學射流技術制備納米粒子的方法。該方法通過調節靜電分化過程中的參數,可制備尺寸均一、形貌可控的栓塞微球,并且對微球中藥物的活性無不良影響[49]。
4 載藥栓塞微球的制備與應用
對于載藥微球而言,根據所載藥物不同,需要的高分子聚合物材料以及微球粒徑也有所不同。所載藥物分為脂溶性(如阿霉素)和水溶性(5-FU、多酚類等)藥物。除此之外,還有一些像胎牛血清、生長因子等藥物,這些藥物需要無菌、低溫的儲存條件,因此在制備負載這些藥物的微球過程中就需重點關注:在保證藥物生物活性的同時如何提高微球對這些藥物的載藥率。
4.1 脂溶性藥物
有些藥物不溶于水,屬于脂溶性藥物,一般可采用離子凝膠法將其包裹在微球中。阿霉素是蒽環類藥物,自身帶正電荷,不溶于水,具有抗腫瘤作用。通過自身的正電荷和微球中帶有負電荷的材料發生反應,可均勻分散在微球表面[40]。蒽環類藥物(如阿霉素)在治療肝癌方面具有安全性和有效性,即使用于晚期患者也是安全的[32]。利用負載阿霉素的二氧化鈦等不透明材料制備藥物洗脫微球,可滿足藥物洗脫微球經導管動脈化療栓塞過程中直接顯影微球的臨床需要[33]。為增加對阿霉素的負載,通常在微球中加入帶有負電荷的材料,可在微球中加入含有負電荷的COO—的氧化海藻酸鹽或者含有—COOH和—SO3H負電荷基團的材料[35-36]。
4.2 水溶性藥物
水溶性藥物若直接使用(如口服),其藥物活性會因為胃酸消化大大降低,因此可將其用微球包裹,保持藥物活性。5-氟尿嘧啶具有抗代謝抗腫瘤功能,可用來治療肝臟惡性腫瘤、消化道腫瘤等癌癥。但該藥對正常細胞的毒性非常大,不良反應多,常見有胃腸道反應、骨髓抑制、脫發等[2,36],而將5-氟尿嘧啶負載到栓塞微球上直接作用于腫瘤部位,則可大大提高藥物利用率,減小全身性的不良反應。鹽酸四環素[4]具有抗菌和抗寄生蟲功能,載有鹽酸四環素的微球可放在牙周部位,用于牙周病治療。凡德他尼(Vandetanib)可抗血管生成,可負載在用于抗血管生成的微球中[50]。
多酚類化合物由多個酚羥基組成,是水果(白藜蘆醇)、茶葉(綠茶多酚)等植物代謝過程中的產物,具有良好的抗炎效果、抗氧化性、抗衰老活性。在抗糖尿病、預防癌癥方面也有良好效果[51]。Zhao等[52]分別使用多酚和京尼平作為交聯劑來改善明膠性能發現,多酚改性水凝膠具有更致密的表面和交聯度,熱穩定性遠高于京尼平且成本低。多酚類化合物非常不穩定而且不易溶于水,其制成的精油也不穩定且易揮發,這限制了在新配方中的使用,因此,一種用于精油包封的納米載體相繼開發。用殼聚糖包裹白藜蘆醇(Resveratrol),用無毒香草素為交聯劑,可實現藥物的控釋和穩定化[17]。Ravi等[28]用脂質體納米粒(磷脂酰膽堿和膽固醇)作為載體包裹綠茶多酚,其中脂質體納米粒是252 nm的球形顆粒,藥物的釋放率隨著溫度和pH值的升高而增大,實現了綠茶多酚的緩釋,可作為口服給藥的來源。為提高多酚類藥物的生物利用度,可用殼聚糖為原料對多酚類藥物進行包裹[53]。多酚也可同時與2種不同材料(如殼聚糖、海藻酸鈉、明膠)復合,提高微球成球性和緩釋性[54]。
5 結束語
隨著介入治療技術的發展,栓塞微球在各類腫瘤的治療中發揮著積極的作用。栓塞微球的特點是可采用多種方法將各類藥物通過多種材料進行負載。同時因為不同類型的癌癥具有不同的特點,臨床治療方案各異,微球也應向多功能方向發展。未來栓塞微球的研發可從以下幾個方面探索。
1)為更好地發揮栓塞微球的作用,微球應具有較高的載藥率,藥物可控的釋放時間,這一點可以通過采用合適的高分子載體材料來進行控制。目前,栓塞微球制備的載體材料最常用的有殼聚糖、海藻酸鹽、絲素等高分子材料,使用最廣泛的是殼聚糖材料,可以通過改變殼聚糖的脫乙酰度及其與其他材料如明膠、絲素等的復合比來實現微球的藥物可控釋放,來控制微球的降解速度,實現高載藥率。
2)合適的微球制備方法也可獲得理想的載藥率與藥物緩釋的可控性。目前常規制備方法主要有乳化交聯法、離子凝膠法、微流控技術、膜乳化技術等。應根據所負載藥物以及微球尺寸要求來選擇不同的制備方法,一般對于水溶性藥物采用乳化交聯法,對于脂溶性藥物則采用離子凝膠法;對于大尺寸微球的制備往往需要采用2種方法復合使用。而對于小分子藥物且與載體材料不形成任何化學鍵時,采用這兩種方法效果均不理想,這時采用其他制備方法,如噴霧法、微流控技術等則能實現較好的包封率。
3)臨床上腫瘤分惡性腫瘤與良性腫瘤,不同部位的腫瘤特征與治療方法也各不相同。對于良性腫瘤可以僅通過介入栓塞手術減小其大小,使其小于手術指標。對于惡性腫瘤,可能需要反復栓塞負載化療藥物的微球,這時微球就不僅應能夠高效地負載化療藥物,還應具有一定的降解性。有些部位的腫瘤需要實時快速地掌握腫瘤大小變化以及栓塞情況,這時栓塞微球就應具有自顯影性能。除此之外還有負載靶向化療藥的栓塞微球,或者通過負載磁性粒子、載體材料的pH敏感性制備自身具有靶向治療功能的栓塞微球,緩解栓塞疼痛感或癌痛的微球,具有光熱效應的微球,降解速度可控的微球。總之,隨著研究的不斷深入,栓塞微球在治療癌癥方面的應用,特別是中晚期的肝癌治療會更加廣泛。

