基于生物素化納米抗體檢測擬除蟲菊酯代謝物3-苯氧基苯甲酸的研究
張譯豐,郭城釬,柳 彬,沈玉棟,王 弘,陳子鍵,羅 林,徐振林*
(1. 廣東省食品質量安全重點實驗室,華南農業大學 食品學院,廣東 廣州 510640;2. 中國生物蘭州生物制品研究有限責任公司,甘肅 蘭州 730046;3. 福建省東山海關綜合技術服務中心,福建 漳州 363400)
擬除蟲菊酯類農藥是模擬天然擬除蟲菊酯合成的,含有苯氧烷基的環丙烷酯類化合物[1]。此類農藥具有神經毒性、生殖毒性、免疫系統毒性與腫瘤毒性等[2-5],對人畜健康有一定危害。3-苯氧基苯甲酸(3-PBA)是擬除蟲菊酯類農藥最主要的代謝產物,也是其重要的風險暴露評估指標。除蟲菊酯類農藥可通過環境接觸和食物鏈進入機體內,在人體中能被迅速吸收并代謝成極性更高的3-PBA,主要存在于血液和尿液中[6]。研究發現,成人尿液樣本中檢測到3-PBA的占比高達91.3%,中位數水平范圍為0.30~18.3 ng/mL[7-9]。調查顯示,男性不育癥患者尿液中的3-PBA 濃度與精子質量呈負相關[10],同時研究表明3-PBA 具有抗雌激素的特性,會使生物體內分泌代謝紊亂[11]。目前3-PBA 作為尿液分析物已被美國、加拿大等國家納入衛生監測的研究對象[12]。3-PBA 的半衰期比菊酯類農藥更長(180 d),生物毒性更大,在土壤中的遷移速率也較快,人們有可能通過環境接觸3-PBA。因此開展3-PBA 的檢測方法研究,對實現對3-PBA及擬除蟲菊酯類農藥的監控和風險暴露評估具有重要意義。
儀器檢測法是檢測3-PBA的常用方法,主要包括高效液相色譜法(HPLC)[13-14]、液相色譜-質譜聯用技術(LC-MS)[15-16]和氣相色譜-質譜聯用技術(GC-MS)[17-18]。色譜法雖結果準確,但因操作較復雜、成本較高,難以用于大量樣品的篩查。免疫分析法是基于抗原-抗體特異性識別原理的分析技術,具有特異性強、檢出限低、檢測成本低、操作簡便、便攜等特點,適用于大批量樣品的現場快速篩選。針對食品、環境中3-PBA 的免疫分析方法主要有酶聯免疫吸附分析法(ELISA)和競爭性免疫層析技術。Chuang 等[19]建立了尿樣中代謝物3-PBA 的ELISA 檢測方法,并與GC-MS 法進行比較,相關系數達到0.95,檢出限為0.1 ng/mL,回收率為92%~100%。Wang 等[20]制備了抗擬除蟲菊酯類單克隆抗體,并建立了icELISA 法用于水樣中多種擬除蟲菊酯類代謝物的檢測,該方法的IC50為0.8 ng/mL,回收率為74%~108%。Kim 等[21]利用納米抗體建立icELISA 方法用于人尿中3-PBA 的檢測,IC50為1.4 ng/ mL,LOD 為0.1 ng/mL,同時通過使用攜帶噬菌體的納米抗體進一步建立Phage-icELISA 方法,回收率為80%~112%,檢出限低至0.01 ng/mL,比LC-MS/MS法的靈敏度更高。Liu等[22]獲得了抗3-PBA 的單克隆抗體,并制備出相應的試紙條用于河水中3-PBA的檢測,檢出限為1 μg/mL,反應時間僅10 min。
有關納米抗體的報道多為蛋白質等大分子,且納米抗體存在體內半衰期短等缺點[23]。針對小分子的駱駝源納米抗體在實際應用中靈敏度較低的情況,Kim等[21]首次用3-PBA半抗原偶聯甲狀腺球蛋白免疫羊駝,制備得到特異性較好的陽性克隆并用于icELISA法檢測人尿中的3-PBA。本研究在Kim等[21]獲得的3-PBA納米抗體的基礎上,建立了生物素化納米抗體的icELISA方法,從而為3-PBA的快速靈敏檢測提供了思路。
1 實驗部分
1.1 實驗材料
3-PBA 質粒為加州大學戴維斯分校Bruce Hammock 教授饋贈;3-PBA(98%,Alfa Aesar 公司);聚丙烯酰胺溶液(30%,Bio-Rad 公司);甘油(≥99%,Biosharp 公司);多聚辣根過氧化物(HRP)酶標記的鏈霉親和素(2~4 μg/mL,polyHRP-SA,Thermo 公司);HRP 酶標記His 標簽多克隆抗體(1 mg/mL,上海艾博抗貿易有限公司);酵母提取物、胰蛋白胨(分析純,英國OXOID 公司);考馬斯亮藍R-250(≥85%)、吐溫-20(96%)購自廣州速研生物公司;咪唑(≥99%)、卵清蛋白(OVA,98%)、牛血清蛋白(BSA,98.6%)購自美國Sigma 公司;酶標板、96 孔白色發光板(深圳金燦華實業有限公司);N,N,N,N-四甲基乙烯二胺(98%)、十二烷基磺酸鈉(95%)、過硫酸銨(≥98%)、甘氨酸(≥99%)購自廣州健陽生物科技有限公司;葡萄糖(≥99.8%,上海博奧公司);四環素(95%)、氨芐青霉素(≥85%)、異丙基硫代半乳糖苷(IPTG≥99%)購自上海源葉生物科技有限公司;生物素-NHS(85%,天津希恩思生化科技有限公司)。
1.2 3-PBA納米抗體的表達純化
挑取攜帶pComb3x-3-PBA 納米抗體表達載體的TOP 10F’大腸桿菌單菌落,接種到10 mL含氨芐青霉素(100 μg/mL)和鹽酸四環素(100 μg/mL)的LB 培養基(LB-Amp-TC)中搖菌(下文搖菌條件均為37 ℃,250 r/min)過夜。將過夜菌擴大培養到1 L 的LB-Amp-TC 中,搖菌至OD600nm值達到0.6~0.8時,加入IPTG 溶液(1 mmol/L)誘導表達12 h。菌液離心,棄去上清,加入5 mL TES 溶液(12.1 g Tris,0.093 g EDTA,85.575 g 蔗糖,500 mL 水,鹽酸調至pH 8.0),攪拌至沉淀完全分散,~80 ℃凍結,37 ℃解凍,反復凍融3次。最后一次解凍后加入12 mL純水和3 mL TES溶液,放入搖床10 ℃,180 r/min搖30 min,離心取上清液。上清液加入咪唑-磷酸鹽緩沖溶液(PBS)使咪唑終濃度為10 mmol/L,再加入1 mL Ni-NAT 填料充分混勻后轉移到層析柱中,使未與填料結合的非特異成分流穿。分別用10、20 mmol/L咪唑-PBS洗去未結合的非特異性成分,再用濃度為50、100、200 mmol/L的咪唑-PBS分別洗脫納米抗體并收集洗脫液。取適量流穿液及不同濃度咪唑洗脫液進行SDS-PAGE檢測。用0.01 mol/L PBS透析納米抗體洗脫液將咪唑除去,超濾管將蛋白溶液濃縮至1 mg/mL以上,-80°C保存。
1.3 3-PBA納米抗體生物素化
稱取5 mg 生物素-NHS 溶于200 μL DMSO,逐滴加入到5 mg 溶于pH 8.0 PBS 緩沖液的納米抗體(生物素與納米抗體的摩爾比為50∶1)中,4 ℃反應過夜,次日用PBS 透析未反應的生物素-NHS。透析結束后,進行icELISA驗證生物素化后抗體活性。其余分裝放置-80 ℃冰箱備用。
1.4 基于生物素化納米抗體的icELISA程序
將包被原用碳酸緩沖液稀釋至所需濃度,以100 μL/孔加入酶標板中,37 ℃水浴箱靜置過夜。次日洗滌2 次(每次用300 μL 含吐溫-20 體積分數為0.005%的PBS(PBST)),然后在吸水紙上拍干酶標板。加入120 μL/孔蛋白封閉液,37 ℃靜置3 h,然后倒掉孔中液體,在吸水紙上拍干,37 ℃烘干后使用或4 ℃密封保存備用。
用PBS將3-PBA納米抗體和3-PBA標準藥物稀釋至所需濃度,酶標板中每孔加入50 μL抗體稀釋液以及50 μL 3-PBA標準溶液,37 ℃孵育40 min,洗板5次,拍干。用PBST將polyHRP-SA 稀釋至合適濃度,每孔加100 μL,37 ℃孵育30 min,洗板5 次,拍干。TMB 顯色液A 液和B 液等體積混勻后,每孔加100 μL,37 ℃反應10 min,然后每孔加入50 μL終止液(10%H2SO4),用酶標儀測定450 nm處各孔的吸光值(A450nm)。
1.5 icELISA條件的優化
采用棋盤滴定法,分別對包被原和抗體進行稀釋(包被原質量濃度為500、250、125、62.5 ng/mL;抗體稀釋倍數為1∶500、1∶1 000、1∶2 000、1∶4 000、1∶8 000、1∶16 000、1∶32 000,體積比),用icELISA 法測定3-PBA 質量濃度為0的條件下各抗原抗體濃度組合的A450nm,選擇A450nm在1~1.5之間的抗原抗體稀釋組合,用icELISA 檢測不同3-PBA 濃度下的A450nm,用Logistics 函數擬合標準曲線,得出各個不同抗原抗體濃度組合下的IC50和最大吸光值Amax。
配制不同pH 值(5.4、6.4、7.4、8.4、9.4),不同PO3-4濃度(10、20、40、60、80 mmol/L),不同吐溫(Tween-20)體積分數(0.005%、0.01%、0.025%、0.05%)的PBS用于稀釋納米抗體和3-PBA標準藥物。在優化的緩沖液條件下,將polyHRP-SA稀釋不同倍數(1∶3 000、1∶4 000、1∶5 000、1∶6 000、1∶7 000,體積比),用icELISA 法檢測不同濃度3-PBA 下的A450nm,用Logistics 函數擬合標準曲線,得出各不同抗原抗體濃度組合下的IC50和最大吸光值Amax。
綜合考慮Amax/IC50值較大且曲線擬合度較好的條件為優化條件。
1.6 樣品前處理
將環境水樣品(湖水、水庫水、自來水、飲用水)以8 000 r/min離心20 min,0.22 μm水系濾膜過濾后直接用于測定。
2 mL人尿液樣品用0.22 μm濾膜過濾后加400 μL 6 mol/L HCl,100 ℃水解1 h;加入4 mL pH 4.5的0.2 mol/L醋酸鈉緩沖液進行中和,再加入6 mol/L NaOH調至pH 4.0左右。用C8固相萃取(SPE)柱純化水解后的尿液樣品,具體操作如下:空柱依次加入2 mL 甲醇、2 mL ddH2O 以及2 mL 醋酸鈉緩沖液(0.2 mol/L,pH 4.0)活化SPE柱;向SPE柱中加入2 mL水解后的尿樣;向SPE柱中依次加入3 mL ddH2O、3 mL甲醇洗滌雜質,真空干燥10 min;用正己烷-乙酸乙酯(7∶3)加1%醋酸配成洗脫液,用3 mL洗脫液洗脫SEP柱上的3-PBA。洗脫液氮吹至近干后,用2 mL含10%甲醇的PBS復溶,-20°C保存。
2 結果與討論
2.1 3-PBA納米抗體制備及生物素化后活性表征
3-PBA 納米抗體經Ni-NAT 純化后的SDS-PAGE 結果如圖1 所示,控制上樣體積一致時,200 mmol/L 咪唑洗脫液的條帶明顯深于50 mmol/L和100 mmol/L時,說明用200 mmol/L 咪唑洗脫納米抗體的效果最佳;同時,由于抗3-PBA 納米抗體的等電點在8.1 附近,為避免納米抗體在純化過程中沉淀,需將洗脫液pH值調至遠離等電點。因此選擇pH 7.4的200 mmol/L咪唑溶液為洗脫液。
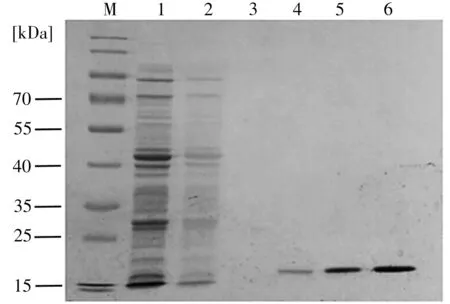
圖1 經Ni-NAT純化后3-PBA納米抗體的SDS-PAGEFig.1 SDS-PAGE image of 3-PBA nanobody purified by Ni-NAT
生物素化后的納米抗體用polyHRP-SA作為酶標物進行icELISA 檢測,當包被質量濃度為125 ng/mL,納米抗體的工作質量濃度為500 ng/mL 時,在1 μg/mL 3-PBA 標準溶液中的抑制率為92.2%,說明3-PBA 納米抗體生物素化成功。
2.2 icELISA反應條件的優化及優化條件下的標準曲線
本研究所建立的方法示意圖如圖2A 所示。抗原包被濃度、緩沖液離子濃度、pH 值、吐溫濃度、二抗稀釋倍數等條件是icELISA 方法的穩定性與靈敏度的重要影響因素,因此需優化上述因素以確定最佳的icELISA實驗條件。
2.2.1 icELISA 抗原、抗體濃度組合的優化 選定的包被原和抗體濃度范圍內,當包被原濃度越高,A450nm達到1.0~1.5時所需的抗體稀釋倍數越小,反之亦然。一方面,減少包被原濃度有利于3-PBA 與包被原競爭抗體結合位點;另一方面,減少抗體濃度有利于抗體與相對低濃度的3-PBA充分結合,從而提高檢測靈敏度。但由于A450nm達到1.0~1.5之間的抗原、抗體濃度呈此消彼長的關系,因此必須進一步通過3-PBA抑制曲線來選擇最優條件。選擇包被原質量濃度(ng/mL)-抗體稀釋倍數為500-1∶4 000,250-1∶3 000,125-1∶2 000,62.5-1∶500的條件測定3-PBA的抑制曲線。
如圖2B 所示,在包被原質量濃度從500 ng/mL 降低到125 ng/mL 的過程中,IC50值呈現減小趨勢,說明靈敏度增強;而當包被原質量濃度降低到62.5 ng/mL后,IC50值突然激增。從Amax/IC50值亦能看出,當包被原質量濃度為125 ng/mL,抗體稀釋2 000倍時,其比值最大。
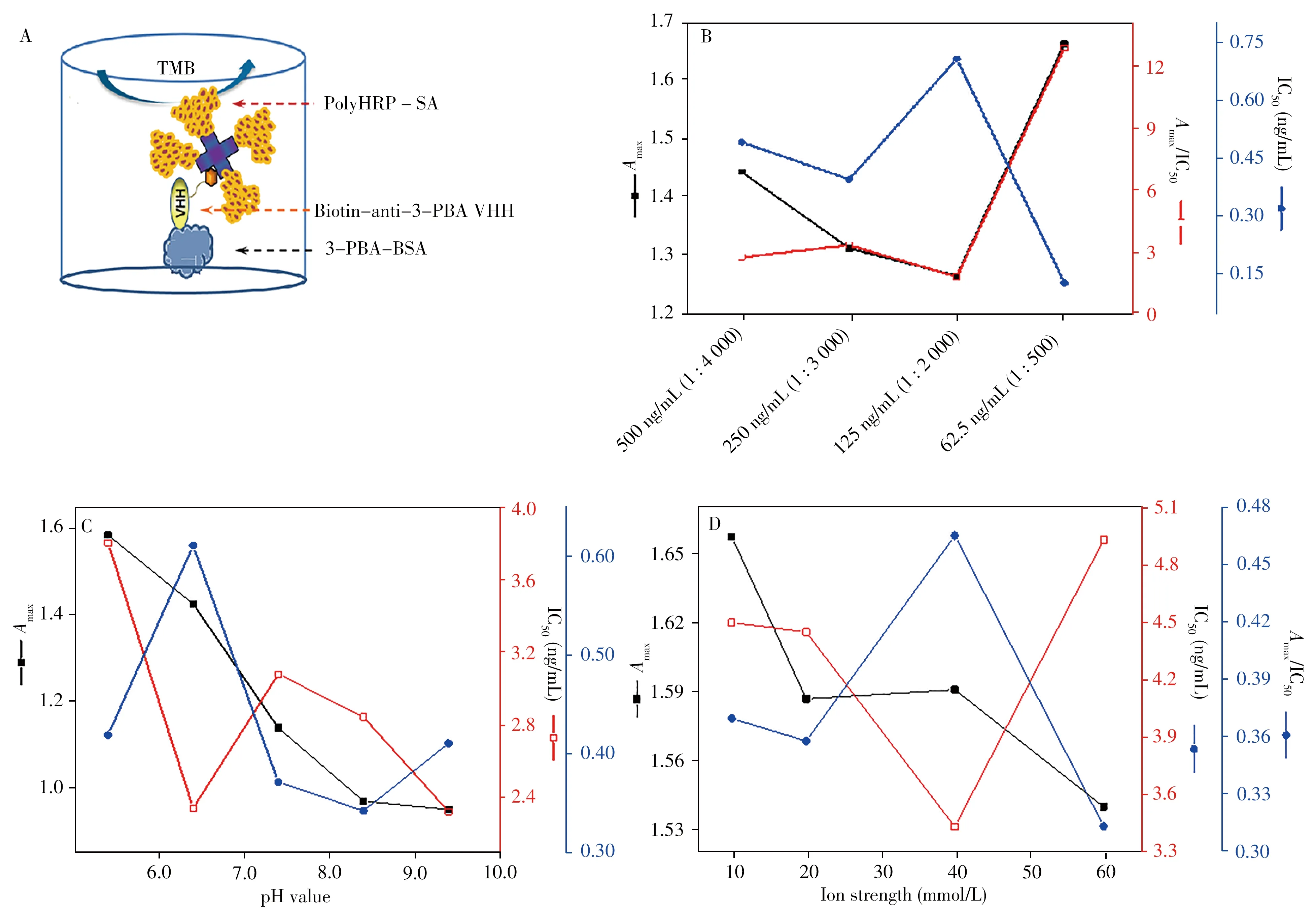
圖2 基于生物素化納米抗體icELISA方法的示意圖及實驗條件的優化Fig.2 Illustration of the biotinylated nanobody based icELISA for 3-PBA and the optimization for experimental conditions
2.2.2 緩沖液pH 值的優化 抗體為具有活性的蛋白因子,pH 值過高或過低均會對其活性造成影響,也會影響抗體和藥物的溶解度。本文選定pH 值分別為5.4、6.4、7.4、8.4、9.4的PBS 作為反應體系測定3-PBA抑制曲線,結果如圖2C所示。在pH 6.4左右,Amax/IC50值達到最大。
2.2.3 緩沖液離子濃度優化 離子濃度對icELISA 反應有重要影響,本實驗分別選定10、20、40、60 mmol/L 等一系列磷酸鹽濃度的PBS 作為反應體系測定3-PBA 的抑制曲線。如圖2D 所示,隨著離子濃度的上升,Amax值呈下降趨勢,IC50值先降后升,當離子濃度為40 mmol/L 時,Amax/IC50值最高,說明此時icELISA反應的靈敏度最大。
2.2.4 吐溫濃度的優化 為研究吐溫-20含量對icELISA 法靈敏度的影響,本實驗在PBS中添加不同體積分數(0.005%、0.01%、0.025%、0.05%)的吐溫-20。結果顯示,當吐溫-20 的體積分數為0.005%時Amax/IC50值最高。因此,選擇在PBS中添加0.005%吐溫-20。
2.2.5 polyHRP-SA 稀釋倍數的優化 在確定3-PBA 納米抗體的最佳稀釋倍數和包被濃度后,polyHRP-SA 和前者反應的量也需優化。用上述確定的最優緩沖液條件將polyHRP-SA 分別按照1∶3 000、1∶4 000、1∶5 000、1∶6 000和1∶7 000倍(體積比)稀釋后進行icELISA 檢測。結果顯示,當稀釋倍數為1∶4 000時,Amax/IC50值最高。因此,選擇polyHRP-SA的最佳稀釋倍數為1∶4 000。
按照上述優化條件,得到本實驗的最佳icELISA 反應條件:3-PBA-BSA 包被質量濃度為125 ng/mL,3-PBA 納米抗體稀釋倍數為1∶2 000,反應緩沖液體系為pH 6.4,離子濃度為40 mmol/L,吐溫-20體積分數為0.005%的PBST溶液,二抗稀釋倍數為1∶4 000。
2.3 線性范圍及檢出限
在最佳實驗條件下,用質量濃度分別為200、40、8、1.6、0.32、0.064、0.012 8 ng/mL的3-PBA系列標準溶液建立icELISA 標準曲線,經擬合得到該標準曲線的IC50為1.7 ng/mL,線性范圍為0.37~7.4 ng/mL(見圖3)。檢出限定義為抑制率10%對應的待測物濃度(IC10),經計算,得到LOD(即IC10)為0.15 ng/mL。
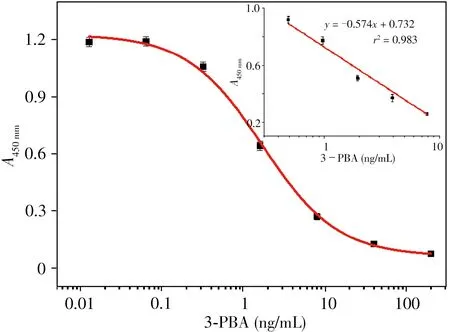
圖3 優化條件下3-PBA的標準曲線Fig.3 Standard curve of 3-PBA under the optimized conditions
2.4 樣品基質效應的消除
2.4.1 人尿樣品 采集4 個來源于不同人的尿液(陰性),過0.22 μm 濾膜后用pH 6.4 的40 mmol/L PBST 進行1、2、4、8 倍稀釋后,分別用于稀釋3-PBA 標準藥物,同時用PBST稀釋3-PBA 標準藥物作為對照組,分別進行icELISA 測定并繪制標準曲線。結果顯示,人尿液樣品通過0.22 μm 濾膜過濾后,需稀釋20 倍才能消除基質干擾,方法的靈敏度降低。圖4A為濾膜過濾后,不同稀釋倍數對其中一尿液樣品基質效應的影響。
為了優化前處理方法,尿樣先經過高溫酸水解,然后用SPE 柱進行純化和富集,再進行稀釋。由圖4B 可知,經過酸水解和SPE 純化的尿樣僅需稀釋8 倍后的標準曲線與PBST 標準曲線基本重合,即稀釋8 倍可消除基質效應。與直接過膜稀釋相比,酸水解和SPE 純化的前處理方法能顯著提高實際樣品的檢測靈敏度。
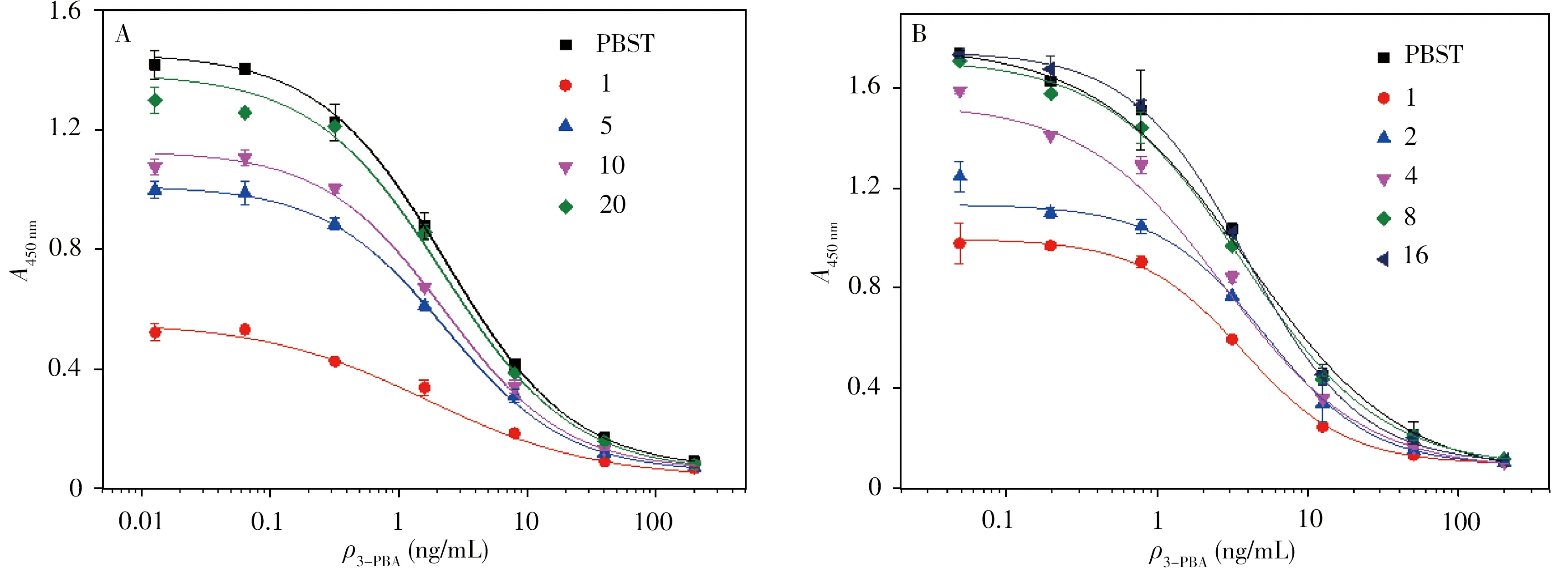
圖4 不同樣品前處理方法對人尿樣品基質效應的影響Fig.4 Influence of different sample pretreatment methods on matrix effect of a human urine sample
2.4.2 水樣品 取4 種不同環境水樣(湖水、水庫水、自來水、飲用水)經離心、過濾膜處理后,用pH 6.4的40 mmol/L PBST 進行1、2、4倍稀釋后,分別用于稀釋3-PBA 標準藥物,同時用PBST 稀釋3-PBA 標準藥物作為對照組,分別進行icELISA 測定并繪制標準曲線。結果顯示,環境水樣品稀釋不同倍數后,其標準曲線與PBST標準曲線高度重合,說明環境水樣品基質效應較小,不會對樣品檢測造成干擾。因此,環境水樣品經離心、過膜處理后,無需稀釋即可直接用于icELISA檢測。
2.5 加標回收率與相對標準偏差
采集人尿、湖水、水庫水、自來水和飲用水共8種陰性空白樣品,在本方法的線性范圍內選擇低、中、高3 個加標水平,按優化方法進行加標回收實驗,每種樣品測定3 次,取平均值。測得人尿樣品的加標回收率為87.6%~97.8%,相對標準偏差(RSD)為3.2%~10%;環境水樣品的加標回收率為78.0%~127%,RSD為0.83%~9.3%(見表1)。

表1 icELISA對實際樣品中3-PBA的回收率及相對標準偏差Table 1 Recoveries and RSDs of 3-PBA in actual samples by icELISA
3 結 論
本研究在前期獲得的抗3-PBA 納米抗體的基礎上,以pComb3X-3-PBA 表達載體制備3-PBA 納米抗體并進行生物素化。所得生物素化納米抗體以多聚HRP 標記的鏈霉親和素為酶標物建立了3-PBA 的icELISA 分析方法,優化了包被源濃度、抗體濃度、反應緩沖體系中離子濃度、pH 值、多聚HRP標記鏈霉親和素稀釋倍數等參數。最優條件下,3-PBA的檢出限為0.15 ng/mL,IC50為1.7 ng/mL,線性范圍為0.37~7.4 ng/mL。8 種實際樣品的加標回收率為78.0%~127%,RSD 均不大于10%。該方法的準確性高、操作簡便,可作為擬除蟲菊酯類農藥使用的暴露評價。

