安徽合肥地區2018—2019年犬細小病毒遺傳進化分析
姬凱元, 邱月陽, 程 敖, 蔣書東, 彭夢玲
(安徽農業大學 安徽省畜禽遺傳資源保護與生物育種重點實驗室,安徽 合肥 230036)
犬細小病毒(Canineparvovirus,CPV)屬于細小病毒科(Parvoviridae),細小病毒亞科(Parvovirinae),原細小病毒屬(Protoparvovirus)[1],可引起犬急性出血性腸炎和幼犬心肌炎。雖然CPV是DNA病毒,但其顯示出與RNA病毒相似的高突變率,VP2基因每年每個位點的替換量約為10-4[2]。自1978年在美國首次報道原始CPV-2亞型以來,在世界范圍內相繼發現CPV-2a[3]、CPV-2b[4]、CPV-2c[5]、New-CPV-2a[6]、New-CPV-2b[7]、CPV-2c(a)[6]和CPV-2c(b)[6]等8種亞型。
CPV是一種沒有包膜結構的單股線狀DNA病毒,基因組全長5.3 kb,包括兩個主要開放閱讀框(open reading frame,ORF)[1]。ORF1編碼非結構蛋白(NS1 和 NS2),其中,NS1是一種多效性核磷蛋白,主要誘導機體細胞凋亡,對于病毒在機體內的復制至關重要[8];ORF2主要編碼衣殼蛋白(VP1和VP2),VP2作為主要的結構蛋白,決定CPV的組織嗜性和宿主范圍[9];兩側為非編碼區(untranslated region,UTR)。流行病學調查發現,目前國內流行株主要以New-CPV-2a、New-CPV-2b和CPV-2c為主[10-12]。為了解近年安徽地區CPV的遺傳變異情況,本研究通過采集2018—2019年安徽地區動物醫院疑似犬細小病毒感染犬糞便或肛門拭子,提取的DNA進行鑒定并隨機選取10株進行全基因組序列分析,了解安徽地區犬細小病毒主要亞型和遺傳變異情況,期望為CPV的研究提供參考。
1 材料與方法
1.1 病料的收集
采集2018—2019年安徽部分地區(合肥市區、長豐縣、馬鞍山市)動物醫院具有犬細小病毒感染癥狀的疑似病例糞便53份(合肥市區28份,命名為AHhf 1-28;長豐縣7份,命名為AHcf 1-7;馬鞍山市18份,命名為AHmas 1-18)。
1.2 主要試劑
pMD TM 19-T載體、DL2000 DNA Marker、PrimeSTAR HS DNA聚合酶、PrimeSTAR MAX聚合酶、EsTaq聚合酶、質粒小提試劑盒、病毒基因組DNA/RNA提取試劑盒、瓊脂糖凝膠DNA回收試劑盒、DH5α感受態細胞。
1.3 引物設計與合成
參考GenBank中CPV-SH1516株(MG013488)基因序列,采用Primer Premier 5設計CPV鑒定引物(CPV-F/R)和3對特異性引物(C1-F/R-C3-F/R)用于擴增中間片段;參照Han等[11]和Yu等[13]的方法設計特異性引物Y1、Y2,U1、U2分別用于擴增CPV 3′端的Y型發夾結構和5′端的U型發夾結構。引物由通用生物系統有限公司合成(表1)。

表1 鑒定與全基因組序列擴增引物
1.4 CPV基因組DNA提取與鑒定
DNA提取試劑提取樣品DNA,具體步驟按說明書進行。以提取的DNA作為模板進行PCR檢測,反應體系:2×TaqPlus MasterMix(Dye)DNA聚合酶5 μL、CPV-F/R各0.5 μL、DNA模板1 μL,ddH2O補足至10 μL。PCR反應條件:95 ℃ 5 min;95 ℃ 30 s、55 ℃ 30 s、72 ℃ 30 s、35個循環;72 ℃ 10 min。1.0%瓊脂糖電泳檢測PCR產物,南京擎科生物科技有限公司測序。
1.5 CPV分型鑒定
為鑒定安徽地區31組陽性病料感染CPV所屬亞型,PCR法擴增CPV的VP2基因序列,根據測序結果鑒定合肥地區流行毒株的所屬亞型。
1.6 CPV全基因組擴增與結構分析
根據PCR鑒定結果,隨機選擇10株CPV陽性樣品,采用表1引物分7段擴增CPV全基因組。使用DNAStar軟件對擴增的7段CPV基因片段進行拼接,獲得完整的CPV序列,分析CPV的基因結構。
1.7 CPV遺傳進化分析
使用MEGA 6.0軟件分析安徽10株CPV與NCBI中28株CPV參考株(表2)的遺傳進化特點,繪制遺傳進化樹。根據序列特點分析NS1基因和VP2基因在遺傳進化分支中是否同步,初步探究CPV在進化的過程中是否涉及基因重組現象。

表2 CPV-2參考毒株
2 結果與分析
2.1 CPV的PCR鑒定結果
PCR鑒定結果顯示,53份待檢樣品中,有31份樣品擴增出約1 031 bp大小的單一條帶(隨機選8株結果進行展示,如圖1所示),測序檢測確定為CPV陽性樣品。
2.2 CPV分型鑒定
31份陽性樣品CPV-VP2氨基酸序列分析發現,4株VP2第297位氨基酸為Ala,且426位為Asn,屬于New CPV-2a,占總體12.90%;1株第297位氨基酸為Ala,且426位為Asp,屬于New CPV-2b,所占比例為3.23%;27株第297位氨基酸為Ala,且426位為Glu,屬于CPV-2c,占絕對優勢,比例為83.87%(表3)。綜上可見,安徽地區以CPV-2c為主要流行毒株。

表3 CPV安徽分離株關鍵氨基酸位點信息
2.3 CPV全基因組測序結果
以AHhf1擴增結果為例,7對特異性引物均可擴增出單一的核酸片段,且大小與預期一致(圖2)。測序分析發現,7段擴增產物均為CPV片段。
2.4 CPV基因組結構分析
使用DNAStar軟件拼接10株CPV測序數據,獲得10株完整的CPV序列。分析發現,安徽地區分離的10株CPV的基因組序列長度在5 055~5 061 bp,長度存在一定差異。ORF1和ORF2分別編碼主要的非結構蛋白(NS1、NS2)和結構蛋白(VP1、VP2),10株CPV的編碼區長度相同;3′UTR長度相同,均為269 bp,Y型回文結構長度均為120 bp;5′UTR長度為516~522 bp不等,U型回文結構長度為193~199 bp(表4),由此可見,10株CPV基因序列長度差異主要是5′UTR核苷酸的突變、插入和缺失造成。

表4 10株CPV安徽株基因組結構分析
2.5 遺傳進化分析
基因組遺傳進化分析發現,38株CPV分為兩個進化分支,其中,亞洲地區流行的24株(22株中國株、1株越南株和1株泰國株)形成一個單系群,而國外株(包括歐洲、美洲和大洋洲共14株)形成另一個單系群(圖3)。在中國株的單系群中,又可分為兩個進化分支,安徽地區分離的10株CPV和其他14株CPV均起源于CPV-2aB004(EF011664)和CPV-LZ1(JQ268283)兩株,合肥地區流行的CPV主要以CPV-2c亞型為主,正在形成一個獨立的分支。NS1和VP2基因遺傳進化樹顯示,同一進化分支中,NS1和VP2基因遺傳進化樹之間不完全相同(圖4、圖5)。對于病毒而言,表面抗原(VP)和內部抗原(NS)所經歷的選擇壓力不同,為逃避宿主的免疫監視,CPV的表面抗原突變的頻率會顯著高于內部抗原[14],因此VP2的變異比NS1發生得更快。同時,NS1和VP2基因在遺傳進化分支中的不同步現象,也為CPV的重組提供了依據。
2.6 VP2抗原突變特征
氨基酸差異分析發現,安徽地區分離的6株CPV-2c毒株(AHhf1、AHcf4、AHhf1、ANhf7、AHhf27、AHhf28)的VP2蛋白與表2中CPV-2c參考毒株同源性高,沒有發生特異性的突變;安徽地區分離的3株NEW-CPV-2a(AHmas2、AHmas16、AHmas17)與表2中11株NEW-CPV-2a參考毒株相比,AHmas2的VP2蛋白存在4個新的氨基酸突變位點(第5位氨基酸由Asn突變為Gly,第13位氨基酸由Pro突變為Ser,第370位氨基酸由Gln突變為Arg,第426位氨基酸由Asn突變為Glu);安徽地區分離的1株NEW-CPV-2b與表2中4株NEW-CPV-2b參考毒株相比,存在部分氨基酸位點的突變,具體位點見表5。這種新的突變表示合肥毒株在形成地方特色的同時,也在不斷地進化。但是這種突變是否引起VP2蛋白結構和功能的變化,還需要進一步研究。
3 討論
CPV 呈世界性分布,在中國和其他亞洲國家(包括韓國、泰國、日本、印度、蒙古[15]、越南[16]、老撾[17]等)以CPV-2a毒株為主要毒株,而許多歐洲、北美、拉丁美洲和非洲國家以CPV-2c毒株為主要流行毒株[18-20]。流行病學調查發現,2009—2015年,在中國北京[21]、河南[22]、甘肅[11]、黑龍江[6]、四川[23]和南京[24]等省份流行的CPV毒株以New CPV-2a為主,且有少量New CPV-2b。2016年至今,我國以CPV-2c毒株感染發病的比例在逐漸增加,CPV-2c和New CPV-2a在中國部分區域成為優勢毒株[25]。本研究對31株安徽地區分離的CPV分型發現,2018—2019年安徽地區流行的CPV主要以CPV-2c型(27/31株)為主。遺傳進化分析發現,安徽地區分離的CPV正在形成了遠離國外CPV-2分離株的單簇,這表明安徽地區流行的CPV主要毒株可能來源于原始CPV-2分離株,從而在中國地區進一步適應與進化,而不是直接自國外引入。
VP2蛋白作為構成CPV衣殼的主要成分,暴露于衣殼表面,決定病毒感染的宿主范圍、凝集血紅細胞等功能,是刺激機體產生中和抗體的主要抗原[9]。CP的防控主要以荷蘭英特威(Intervet)、美國輝瑞(Pfizer)、法國梅里亞(Merial)和美國富道(Fort Dog)等公司生產的CPV弱毒疫苗為主。調查發現,富道公司的CPV弱毒苗以CPV-2b毒株為疫苗株制備,其余公司的CPV弱毒苗都是以CPV-2為疫苗株制備。雖然有研究表明,疫苗株為CPV-2和CPV-2b的CPV疫苗對CPV-2a、CPV-2b和CPV-2c突變體具有保護作用[26],但是由于VP2抗原的高突變頻率,可能導致CPV毒株的中和抗原表位發生變化,導致已接種CPV疫苗株的犬群感染CPV[27]。分析安徽地區10株CPV的VP2氨基酸序列特點發現,表2中11株NEW-CPV-2a參考毒株相比,安徽地區分離的部分NEW-CPV-2a毒株存在4個新的氨基酸突變位點(第5位氨基酸由Asn突變為Gly,第13位氨基酸由Pro突變為Ser,第370位氨基酸由Gln突變為Arg,第426位氨基酸由Asn突變為Glu);安徽地區分離的1株NEW-CPV-2b與表2中4株NEW-CPV-2b參考毒株相比,存在部分氨基酸位點的突變(表5)。但是這種突變是否引起VP2蛋白結構和功能的變化,還需要進一步研究。
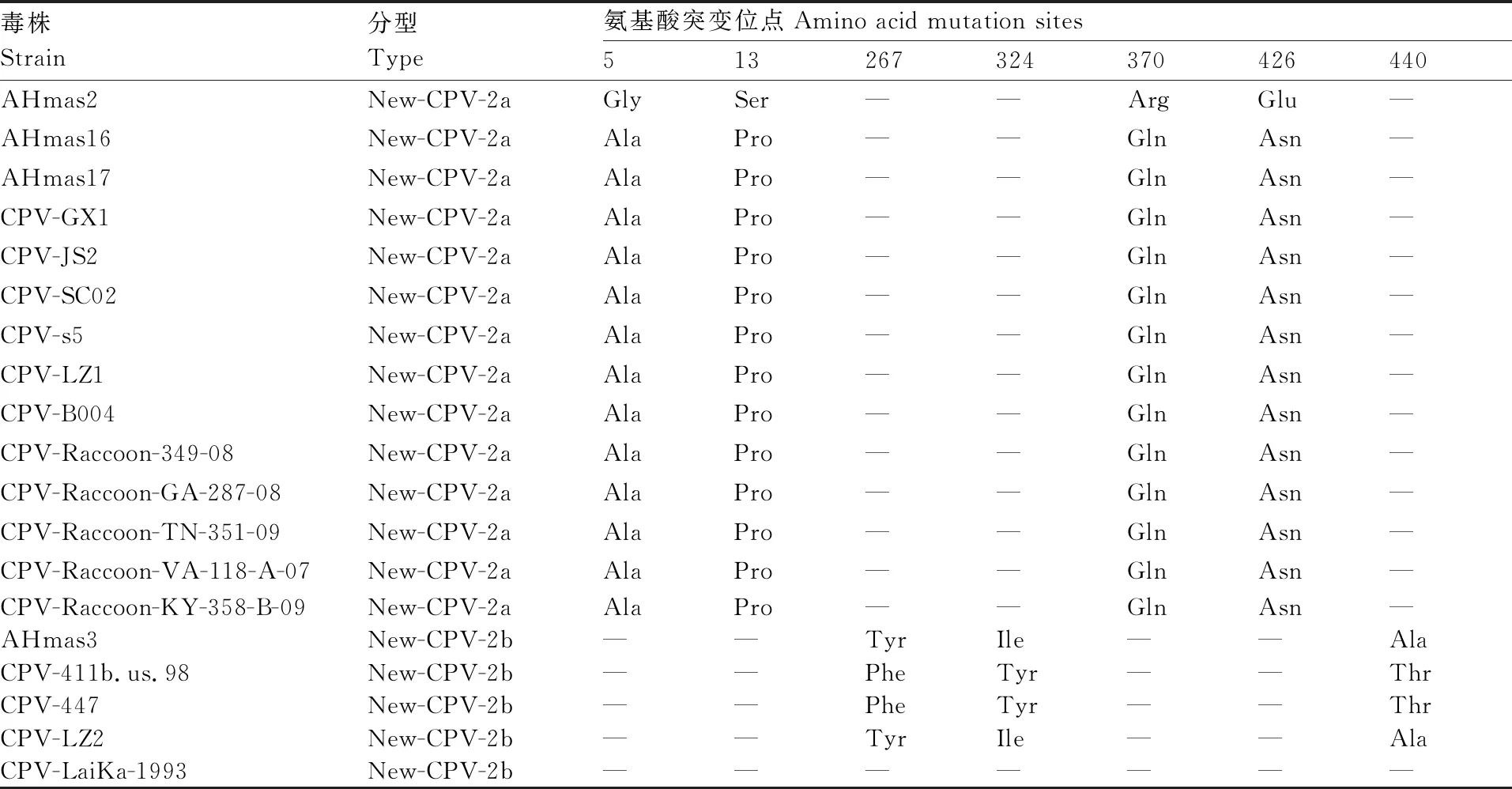
表5 VP2蛋白氨基酸突變位點統計表
由于成年犬和已免疫犬發生犬細小病毒感染的數量日趨增加,因此,加強本地區CPV的流行病學研究和遺傳進化分析具有重要意義。結合本研究和以往年份中國地區CPV亞型流行情況分析,CPV-2c已然成為安徽地區CPV-2的優勢毒株,同時CPV-New2a與CPV-New2b共同參與循環。期望本研究可以為CPV的研究提供參考。

