膳食纖維聯合美沙拉嗪治療潰瘍性結腸炎的療效與機制
于沛,何賀,鈔艷惠,聶會娟
(鄭州大學第一附屬醫院藥學部,鄭州 450052)
炎癥性腸病是臨床常見腸道疾病,包括克羅恩病和潰瘍性結腸炎(ulcerative colitis,UC)[1-2]。UC發病機制至今尚不明確,有研究表明其發病具有家族遺傳性[3]。臨床上UC治療難度較大,治療過程中易復發,表現為嚴重反復的腹瀉、便血和腹痛,患者體質量持續下降[4]。患者生活質量低下,身心備受折磨,并且長時間持續炎癥反應會增加癌癥風險,嚴重威脅患者生命安全[5]。基于此,在現有臨床治療基礎上尋找更好的治療方案成為研究重點。美沙拉嗪(5-aminosalicylic acid,5-ASA)是臨床治療急性UC的首選藥物,具有良好的治療效果,但治療過程中復發率較高,臨床應用受到限制[6-7]。近年來研究表明,UC發生與患者腸道菌群失調密切相關[8-11]。腸道菌群穩態對腸道健康至關重要,二者相互影響,密不可分。因此,維持腸道菌群穩態是治療UC的新途徑[12]。膳食纖維是良好的益生元,可以調控腸道菌群[13-16]。筆者在本研究比較膳食纖維聯合5-ASA和5-ASA治療UC的療效,并對其治療機制進行初步探索,現報道如下。
1 材料與方法
1.1實驗試劑 葡聚糖硫酸鈉(dextran sulfate sodium,DSS,美國MP公司,平均相對分子質量36 000~50 000,批號:160110),隱血試劑盒(南京建成生物工程研究所,批號:C027-1-1);髓過氧化物酶(myeloperoxidase,MPO)試劑盒(南京建成生物工程研究所,批號:A044-1-1);羧甲基纖維素鈉(carboxymethylcellulose sodium,CMC-Na,國藥集團化學有限公司,批號:170610);5-ASA(上海愛的發制藥有限公司,批號:160306);小鼠白細胞介素1β(IL-1β)、IL-6、腫瘤壞死因子α(TNF-α)及IL-10酶聯免疫吸附測定(enzyme linked immunosorbent assay,ELISA)試劑盒(上海酶聯生物科技有限公司,批號分別為ml028611、ml00209、ml06315和ml037873);燕麥、玉米、紅豆、花生和蓮子購于超市;動物組織裂解液(上海生物工程有限公司,批號:C500028);RNA提取、逆轉錄以及定量試劑盒[寶日醫生物技術北京有限公司TaKaRa(中國),批號分別為9767、RR036A、6396760];其余試劑均為國產分析純。
1.2實驗儀器 BioTek Epoch 酶標儀(美國BioTek公司,Epoch),LXJ2I 型離心機(上海醫用分析儀器廠),85-2型恒溫磁力攪拌機(上海斯樂儀器廠),定量聚合酶鏈反應(polymerase chain reaction,PCR)擴增儀(美國羅氏公司,Light Cycle-96),電子分析天平E11140(德國梅特勒公司,感量:1 mg),GZX-9023 MBE數顯鼓風干燥箱(上海博訊實業醫療設備廠),NURO-5T自動雙重純水蒸餾器(寧波科學儀器有限公司),MiSeq高通量測序儀(美國Illumina公司)。
1.3實驗動物 雌性6~8周齡無特定病原體(SPF)級C57BL/6小鼠,實驗動物合格證號:NO.201615478,體質量18~20 g,購自揚州大學比較醫學研究中心,實驗動物生產許可證編號:SCXK(蘇)2017-0007。小鼠飼養在光照12 h/黑暗12 h房間,溫度25 ℃,恒濕(相對濕度30%)。
1.4模型的建立 小鼠適應性飼養7 d,自由飲用3.5%DSS溶液(以純化水配制)7 d,建立急性UC模型,42只小鼠建模成功[17]。
1.5膳食纖維飼料的制備 稱取50 ℃烘干過夜的燕麥、玉米、紅豆、花生各100 g,蓮子30 g,粉碎成粉末,以料液比1:100加入純化水,50 ℃攪拌2 h,50 ℃烘干1 h,得含少量水分的糊狀混合成分。將糊狀混合成分裝入飼料模具定型,烘干后得膳食纖維飼料[18]。
1.6動物分組與給藥 設未造模小鼠為正常對照組,將模型小鼠根據體質量按完全隨機分組方法[19]分為模型對照組、5-ASA組和膳食纖維聯合5-ASA組(F-5-ASA組)。5-ASA組與F-5-ASA 組以5-ASA灌胃(5-ASA以0.5% CMC-Na配制成混懸液),200 mg·kg-1;正常對照組與模型對照組灌胃相同劑量0.5% CMC-Na。正常對照組、模型對照組及5-ASA組給予正常飼料喂養7 d,F-5-ASA組給予膳食纖維飼料喂養7 d。
1.7檢測指標與檢測方法 每天記錄小鼠體質量、便血及腹瀉情況,并按文獻方法進行疾病活動指數(disease activity index,DAI)評分。末次給藥后處死,解剖,取回腸至肛門處結腸,測量長度并攝相。縱向剪開結腸,取結腸內容物置EP管,-80 ℃冰箱保存。剪取適當長度(約1.0 cm),10%多聚甲醛固定,石蠟包埋,切片,蘇木精-伊紅(HE)染色。剩余組織立即置液氮保存。
1.8結腸組織炎癥相關蛋白質表達情況檢測 取液氮保存的結腸組織100 mg,置研缽,分3次加液氮,每次10 mL,快速充分研磨,加入組織裂解液1 mL,繼續研磨,直至無明顯塊狀組織。取液體500 μL,轉移至1.5 mL EP管,冰浴超聲處理20~30 s,10 000 r·min-1離心10 min(r=8 cm)。取上清液。按照ELISA試劑盒說明書操作流程,檢測結腸組織IL-1β、IL-6、TNF-α以及IL-10蛋白表達情況。
1.9小鼠腸道菌群的檢測 取-80 ℃冰箱凍存的小鼠結腸內容物50 mg,每組小鼠樣本5只,進行腸道菌群16 s RNA測序(金唯智生物科技有限公司,蘇州)。即采用包含“CCTACGGRRBGCASCAGKVRVGAAT”序列的上游引物和包含“GGACTACNVGGG-TWTCTAATCC ”序列的下游引物擴增細菌V3和V4區,構建測序文庫,使用Illumina MiSeq儀器進行雙端測序,并對數據進行生物信息學分析。利用PICRUSt(phylogenetic investigation of communities by reconstruction of unobserved states )預測菌群代謝途徑,采用STAMP軟件比較組間可視化差異菌群代謝途徑。
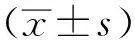
2 結果
2.1小鼠一般情況 見圖1。正常對照組小鼠體質量無明顯變化;模型對照組、5-ASA組及F-5-ASA組小鼠從第5 天開始體質量明顯下降,給予5-ASA或者F-5-ASA后小鼠體質量緩慢上升。實驗第14天,與正常對照組比較,模型對照組小鼠體質量顯著降低(P<0.01);與模型對照組比較,5-ASA組與F-5-ASA組體質量明顯上升(P<0.01)。小鼠DAI評分見圖1B,正常對照組實驗過程中DAI無明顯波動,模型對照組呈逐漸上升趨勢,5-ASA組與F-5-ASA組先上升后逐漸下降。與正常對照組比較,模型對照組第14天DAI評分顯著增高(P<0.01);與模型對照組比較,5-ASA組與F-5-ASA組DAI評分較低。第14天各組小鼠結腸長度見圖1C、D。與正常對照組比較,模型對照組小鼠結腸顯著縮短(P<0.01);與模型對照組比較,5-ASA組與F-5-ASA組結腸明顯更長(P<0.01),提示5-ASA與F-5-ASA能有效緩解小鼠結腸炎癥反應。
2.2小鼠結腸切片形態學 見圖2。正常對照組小鼠結腸黏膜完整,固有層黏膜下層及肌肉層分層明顯,結構整齊清晰,隱窩排列整齊,無炎性細胞浸潤;模型對照組小鼠結腸組織無明顯結構層次,黏膜脫落,腺體和隱窩消失且有大量炎性細胞浸潤;5-ASA組與F-5-ASA組小鼠結腸組織結構層次重構,黏膜重塑,隱窩可見且有少量炎性細胞浸潤。病理檢查結果表明,5-ASA與F-5-ASA對小鼠腸黏膜有良好保護作用,可改善腸黏膜損傷,減輕炎癥反應。
2.3炎癥因子測定結果 見圖3。與正常對照組比較,模型對照組小鼠結腸大量表達IL-1β、IL-6及TNF-α,差異有統計學意義(P<0.01);與模型對照組比較,5-ASA組IL-1β和TNF-α表達均下調;與模型對照組比較,5-F-ASA組上述3種促炎細胞因子表達均顯著下調。IL-10檢測結果見圖3D,與正常對照組比較,模型對照組表達量顯著下調(P<0.01);與模型對照組比較,5-ASA組和5-F-ASA組均顯著上調(均P<0.01)。上述結果表明,5-ASA與5-F-ASA對小鼠結腸炎癥具有治療作用,且5-F-ASA療效優于5-ASA。
①與正常對照組比較,P<0.01;②與模型對照組比較,P<0.01。

A.正常對照組;B.模型對照組;C.5-ASA組;D.F-5-ASA組。

①與正常對照組比較,P<0.01;②與模型對照組比較,P<0.01。
2.4小鼠腸道菌群多樣性測定結果 由圖4A可知,與正常對照組比較,模型對照組小鼠腸道菌群多樣性降低;與模型對照組比較,5-ASA組與F-5-ASA組腸道菌群多樣性增加,表明5-ASA和F-5-ASA對小鼠腸道菌群有調控作用。由圖4B PCoA分析可知,主成分Axis.1和Axis.2之和達到64.7%,4組之間差異有統計學意義,表明4組小鼠腸道菌群組成有明顯差異。
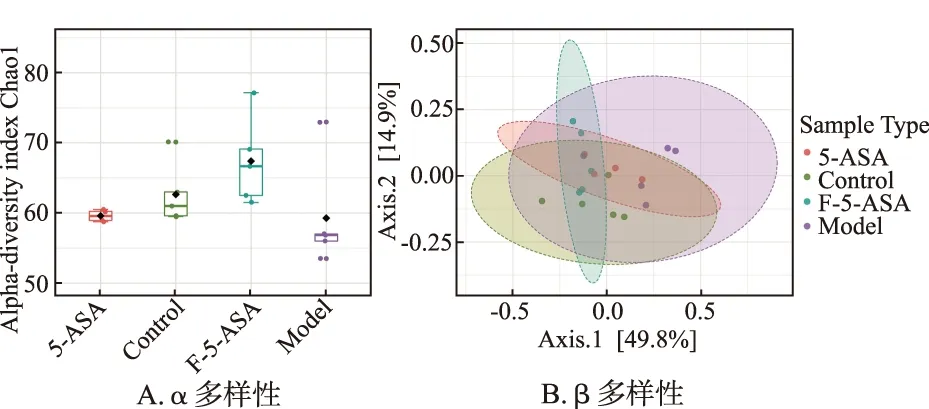
圖4 4組小鼠腸道菌群測定的α 和 β多樣性
2.5小鼠腸道菌群豐度測定結果 由圖5A-D可知,在門分類水平上,正常對照組、5-ASA組及F-5-ASA組主要以擬桿菌門(bacteroidetes)為主,相對豐度分別為47.0%,45.0%和49.0%;其次是厚壁菌門(firmicutes),分別為35.0%,31.0%和26.0%;模型對照組主要以厚壁菌門為主(相對豐度51.0%),其次是擬桿菌門(相對豐度31.0%)。表明5-ASA與F-5-ASA能夠改善由DSS所致腸道菌群紊亂。圖5E-F顯示在屬水平上各組小鼠菌群分布差異情況。4組小鼠腸道菌群豐度差異可從LEFse分析看出,模型對照組與其他3組比較,差異有統計學意義(LDA>2)的菌屬有5種,分別是Oscillospira、Odoribacter、Dorea、Lactobacillus和Coprococcus。5-ASA組有3種,分別為MUcispirillum、Butrricimonas和Pseudomonas。F-5-ASA組差異有統計學意義的菌屬有9種,其中差異最大的屬是Bacteroides,其次是Parabacteroides、Campylobacter、Helicobacter和Eubacterium等。
2.6小鼠腸道菌群代謝功能 見圖6。通過與Clusters of Orthologs Groups (COG) 數據庫比對,DSS處理小鼠后共有25種代謝途徑顯著改變。其中腸阿米巴病(amoebiasis)代謝、氨基酸代謝(amino acid metabolism)及脂肪酸代謝(fatty acid metabolism)途徑被顯著上調,而包括硫胺素代謝(thiamine metabo-lism)、原發性免疫缺陷(primary immunodeficiency)和半乳糖代謝(galactose metabolism)在內的22種代謝途徑被顯著抑制(圖6A)。與模型對照組比較,5-ASA組12種代謝途徑顯著改變。其中硫胺素代謝(thiamine metabolism),苯丙氨酸、酪氨酸和色氨酸生物合成(phenylalanine,tyrosine and tryptophan biosynthesis),碳水化合物代謝(carbohydrate metabolism),氮代謝(nitrogen metabolism)以及限制酶(restriction enzyme)代謝途徑被顯著下調,丁酸代謝(butanoate metabolism)、丙酸代謝(propanoate metabolism)、氯代烷烴和氯代烯烴降解(chloroalkane and chloroalkene degradation)、醚脂代謝(ether lipid metabolism)、RIG-I樣受體信號通路(RIG-I-like receptor signaling pathway)、氨基酸代謝(amino acid metabolism)和萘降解(naphthalene degradation)代謝途徑顯著上調(圖6B),表明5-ASA可提高小鼠腸道內細菌功能。F-5-ASA組小鼠腸道細菌功能有極大改變(圖6C)。由圖6可知,與模型對照組比較,F-5-ASA組有45種代謝途徑被顯著改變,其中22種上調,23種下調。上調代謝途徑包括碳水化合物代謝(carbohydrate metabolism)、酪氨酸和色氨酸生物合成(phenylalanine,tyrosine and
tryptophan biosynthesis)和氨基酸代謝(amino acid metabolism)等,下調途徑包括丙酸代謝(propanoate metabolism)、細菌趨化性(bacterial chemotaxis)和細菌運動蛋白(bacterial motility proteins)等代謝途徑(圖6C)。

A.正常對照組門分類水平相對豐度;B.模型對照組門分類水平相對豐度;C.5-ASA組門分類水平相對豐度;D.F-5-ASA組門分類水平相對豐度;E.屬分類水平菌群豐度熱圖;F.LEfSe分析中顯示的各組差異菌屬。
3 討論
UC常年反復發作,極大地影響患者生活質量,威脅患者生命。5-ASA是已經上市的急性UC治療藥物,其主要藥理作用機制為抑制前列腺素及白三烯生物合成。口服5-ASA可有效緩解炎癥,改善臨床癥狀,短期治療可以達到良好效果,但遠期治療易復發,效果不佳。
以DSS建立UC模型由日本學者于1985年提出,小鼠在自由飲用一定濃度DSS后會自發出現腸炎,此種腸炎病理學表現與臨床UC患者相似,在研究UC發生和發展中發揮著重要作用。筆者在本研究中采用3.5%DSS造模,小鼠自由飲用4 d后出現明顯體質量減輕、便血和腹瀉癥狀,14 d后病理切片顯示結腸部位炎癥細胞浸潤嚴重,結腸組織完整結構破損,提示模型建立成功。
在盲腸和結腸,腸道菌群代謝產物是腸黏膜上皮細胞主要能量和營養來源。研究表明,腸道微生物在維持腸道微環境穩態中發揮重要作用。短鏈脂肪酸(如乙酸、丙酸和丁酸)是腸道微生物發酵食物中難消化的碳水化合物產生的小分子化合物。短鏈脂肪酸被小腸上皮細胞吸收,通過以下途徑發揮抗炎作用:①為腸上皮細胞提供直接能量;②激活上皮細胞G蛋白耦聯受體(G protein-coupled receptors,GPCRs,主要有GPR41、GPR43和GPR109A);③抑制組蛋白去乙酰化酶(histone deacetylase,HDAC)活性,從而調控基因表達。IBD 中短鏈脂肪酸顯著降低,可能是影響內部和免疫穩態的關鍵因素。研究表明,臨床UC患者糞便腸道菌群表現為多樣性降低,有益菌群豐度減少或消失,有害菌群大量繁殖[10]。機體發生炎癥時,有害菌群代謝物(如脂多糖)會損傷腸道黏膜,使腸道免疫系統紊亂,加劇炎癥進程。研究表明,調控炎癥所致腸道菌群紊亂是治療UC的新思路新方法。膳食纖維已被大量研究證明對腸道菌群具有良好調控作用。ZHAO等[20]研究表明,將燕麥、玉米、紅豆、薏米、蕎麥、山藥、花生和蓮子做成復合膳食,2型糖尿患者使用3個月,能夠通過調控患者失衡的腸道菌群,從而極大改善患者臨床癥狀。

A.正常對照組與模型對照組比較;B.模型對照組與5-ASA組比較;C.模型對照組與F-5-ASA組比較。
本研究中,筆者選擇燕麥、玉米、紅豆、花生和蓮子制備膳食,飼喂腸炎小鼠7 d,同時給予5-ASA治療7 d。結果表明,F-5-ASA組小鼠治療后體質量、DAI以及結腸長度均明顯低于模型對照組,且效果優于5-ASA組。病理切片和結腸組織炎癥因子檢測表明,F-5-ASA組小鼠腸黏膜再生,炎性細胞浸潤減少,IL-1β、IL-6及TNF-α促炎細胞因子表達下調,抑炎細胞因子IL-10顯著上調。以上結果說明,膳食纖維聯合5-ASA治療具有協同效果,可在5-ASA治療基礎上進一步提升腸道黏膜屏障修復能力,調控細胞因子釋放分泌,從而提升治療效果。為評估膳食對小鼠腸道菌群的調控效果,筆者在本研究中對小鼠腸道菌群豐度和代謝途徑進行測序分析。結果表明膳食纖維聯合5-ASA治療可改善小鼠腸道菌群多樣性,調控特定腸道菌群在門和屬水平豐度,并顯著改變特征菌群代謝途徑。
綜上所述,膳食纖維聯合5-ASA治療UC可通過調控小鼠腸道菌群和改變菌群代謝途徑,有效改善腸道炎癥癥狀,調控炎性細胞因子分泌,達到良好的治療效果。

