FOXJ1通過調控MMP2/9和β-catenin抑制胃癌轉移的機制研究*
王靜,李靈敏,劉曉峰,樊代明
250000 濟南,中國人民解放軍聯勤保障部隊第九六〇醫院 消化內科(王靜、李靈敏、劉曉峰);710032 西安,空軍軍醫大學西京消化病醫院 腫瘤生物學國家重點實驗室(王靜、樊代明)
胃癌是全球致死率第三的惡性腫瘤[1],也是我國發病率最高的消化道惡性腫瘤,進展期胃癌患者的5年生存率僅約20%[2]。因此,探討胃癌惡性進展的關鍵分子機制,是預防胃癌轉移、改善患者預后的關鍵環節。叉頭框蛋白J1(forkhead box J1, FOXJ1)在胃彎曲的發育形成中發揮重要轉錄調控功能[3]。我們前期率先發現FOXJ1是抑制胃癌增殖和轉移的重要轉錄因子,并可作為影響胃癌患者生存的獨立預測因素[4]。然而FOXJ1在胃癌中的作用機制仍未明確。
胃癌的侵襲轉移是一個多階段進展過程,而細胞外基質(extracellular matrix,ECM)降解、基底膜破壞是腫瘤細胞轉移最初環節。基質金屬蛋白酶(matrix metalloproteinases,MMPs)可降解ECM,有利于腫瘤細胞穿破基底膜,發生浸潤和遠處轉移。其中,IV型膠原酶MMP-2、MMP-9的作用最為直接[5]。我們前期發現FOXJ1可抑制胃癌細胞分解Matrigel從而穿過微孔濾膜的能力[4],而Matrigel的主要成分即為Ⅳ型膠原、層黏連蛋白等。另外,Wnt/β-catenin通路異常活化在胃癌的增殖、侵襲、轉移、耐藥等多種病理過程均發揮重要作用[6]。有研究報道,FOXJ1-Wnt/β-catenin軸調控斑馬魚Kuffer’s囊泡纖毛的形成[7],Wnt通路可能是FOXJ1轉錄調控纖毛形成網絡中的重要通路[8]。因此,本研究針對參與腫瘤侵襲轉移的關鍵分子MMPs和通路Wnt/β-catenin,探討FOXJ1抑制胃癌轉移的分子機制,為進一步拓展對胃癌轉移信號通路的新認識、開發干預胃癌轉移的潛在靶點提供新的思路。
1 材料與方法
1.1 細胞培養
高/低轉移潛能胃癌細胞系MKN28M/MKN28NM由空軍軍醫大學西京消化病醫院腫瘤生物學國家重點實驗室建立并保存,即將人胃癌細胞系MKN28經反復Transwell遷移和侵襲實驗篩選獲得的高/低轉移潛能胃癌細胞亞系,病毒包裝細胞293T購自ATCC。MKN28M-FOXJ1、MKN28M-control、MKN28NM-shFOXJ1、MKN28NM-shcontrol使用含2 μg/mL嘌呤霉素的完全培養基常規培養。
1.2 慢病毒穩定轉染細胞系建立
過表達慢病毒和RNA干擾慢病毒載體系統購自上海吉凱基因化學技術有限公司,包括:GV166載體、GV248載體、pHelper 1.0載體和pHelper 2.0載體。根據MOI值1∶100進行慢病毒感染,加入嘌呤霉素(2~4 μg/mL)篩選7~10 d,獲得穩定感染細胞株,利用Real-time PCR和Western blot鑒定感染效率。
1.3 Real-time PCR
各靶基因的引物序列為:FOXJ1(F):5’- TGGATCACGGACAACTTCTGCTA-3’;FOXJ1(R):5’- CACTTGTTCAGAGACAGGTTGTGG-3’;MMP2(F):5’- ACGATGATGACCGCAAGT-3’;MMP2(R):5’-GGTTCATTTGGCGGACTG-3’;MMP9(F):5’- TCCCTGGAGACCTGAGAACC-3’;MMP9(R):5’-AAACTACTCGGAAGACTTGCC-3’;TIMP1(F):5’- TCTGGAAACGACATTTATGG-3’;TIMP1(R):5’- GTTGGAGGCCTGCTTATGGG-3;TIMP2(F):5’-ACTGTTGGTGGGAACTCAGAAG-3’;TIMP2(R):5’-CAAGGTCAATGTCAGGAGAGG-3’;GAPDH(F):5’- GCACCGTCAAGGCTGAGAAC-3’;GAPDH(R):5’- TGGTGAAGACGCCAGTGGA-3’。
使用SYBR?Premix Ex TaqTMII試劑盒,進行Real-time PCR反應。
1.4 Western blot
分別提取總蛋白與核蛋白,應用不連續Tris-SDS聚丙烯酰胺凝膠垂直平板電泳系統,采用半干電轉法,稀釋相應一抗:FOXJ1(Abcam,ab220029,1∶1 000),MMP2、MMP9、TIMP1、TIMP2(Santa Cruz,sc13595、sc21733、sc365905、sc21735,1∶500),β-catenin、c-Myc、N-cadherin(Cell Signalling,#8480、#18583、#13116,1∶1 000),β-actin(Sigma,A 1978,1∶2 000),Histone H3(Cell Signalling,#4499,1∶2 000)孵育過夜,孵育對應二抗(1∶2 000),在化學發光檢測儀上記錄顯色情況。
1.5 免疫組織化學染色
105例胃癌及其對應癌旁組織石蠟標本取自2007年11月至2009年2月西京消化病醫院的手術病例,并經HE染色確診。所有患者術前均未接受放化療,術后接受常規化療。患者相關信息及臨床病理資料通過病例系統獲取,其中男性67例,女性38例,臨床分期依據美國癌癥聯合會第七版TNM分期標準。本研究經倫理委員會審核通過并獲得知情同意。
采用SP免疫組化染色法,各一抗孵育濃度如下: FOXJ1(Abcam,ab220029)1∶400,β-catenin(Cell Signaling Technology,#8480)1∶200。
在對患者臨床病理資料未知的前提下,由2名病理科醫生參考Sinicrope[9]評分標準,采用半定量法,主要依據染色強度和染色細胞所占比率分別綜合評分。
1.6 細胞免疫熒光染色
取對數生長期的細胞爬片,4%多聚甲醛固定20 min,1%BSA室溫封閉30 min,稀釋對應一抗(鼠抗人FOXJ1單克隆抗體1∶400,兔抗人β-catenin多克隆抗體1∶200)分別孵育,加入綠色熒光標記羊抗鼠二抗和紅色熒光標記羊抗兔二抗(1∶200),加入DAPI染細胞核(1∶1 000),激光共聚焦顯微鏡下觀察并拍照。
1.7 雙熒光素酶報告基因實驗
各組細胞以每孔6 000個細胞的濃度接種于96孔板上。將180 ng TOPflash或FOPflash表達質粒與12 ng pRL-TK(Renilla-TK-熒光素酶載體,Promega)共轉染細胞,以pRL-TK 為內參,24 h后測定TOPflash/FOPflash值。TOPflash為報告質粒,FOPflash為陰性對照。
1.8 統計學分析
采用SPSS 20.0統計學軟件進行分析。采用Spearman相關系數分析FOXJ1和β-catenin在胃癌中的表達相關性;采用t檢驗或χ2檢驗分析各實驗中的組間差異。以P<0.05為差異有統計學意義。
2 結 果
2.1 FOXJ1可抑制胃癌細胞的遷移和侵襲能力
前期細胞劃痕實驗結果顯示:上調FOXJ1可抑制胃癌細胞遷移,而下調FOXJ1可促進胃癌細胞遷移;Transwell遷移和侵襲實驗結果提示:FOXJ1可抑制胃癌細胞遷移及侵襲入ECM的能力[4]。
2.2 FOXJ1抑制胃癌細胞中MMP2和MMP9的表達
采用real-time PCR和western blot分別檢測上調/下調FOXJ1對高/低轉移潛能胃癌細胞亞系MKN28M/MKN28NM中MMP2和MMP9表達的影響,結果顯示,過表達FOXJ1可顯著降低MKN28M中MMP2、MMP9的表達,而干擾FOXJ1可明顯增加MKN28NM中MMP2、MMP9的表達(圖1)。
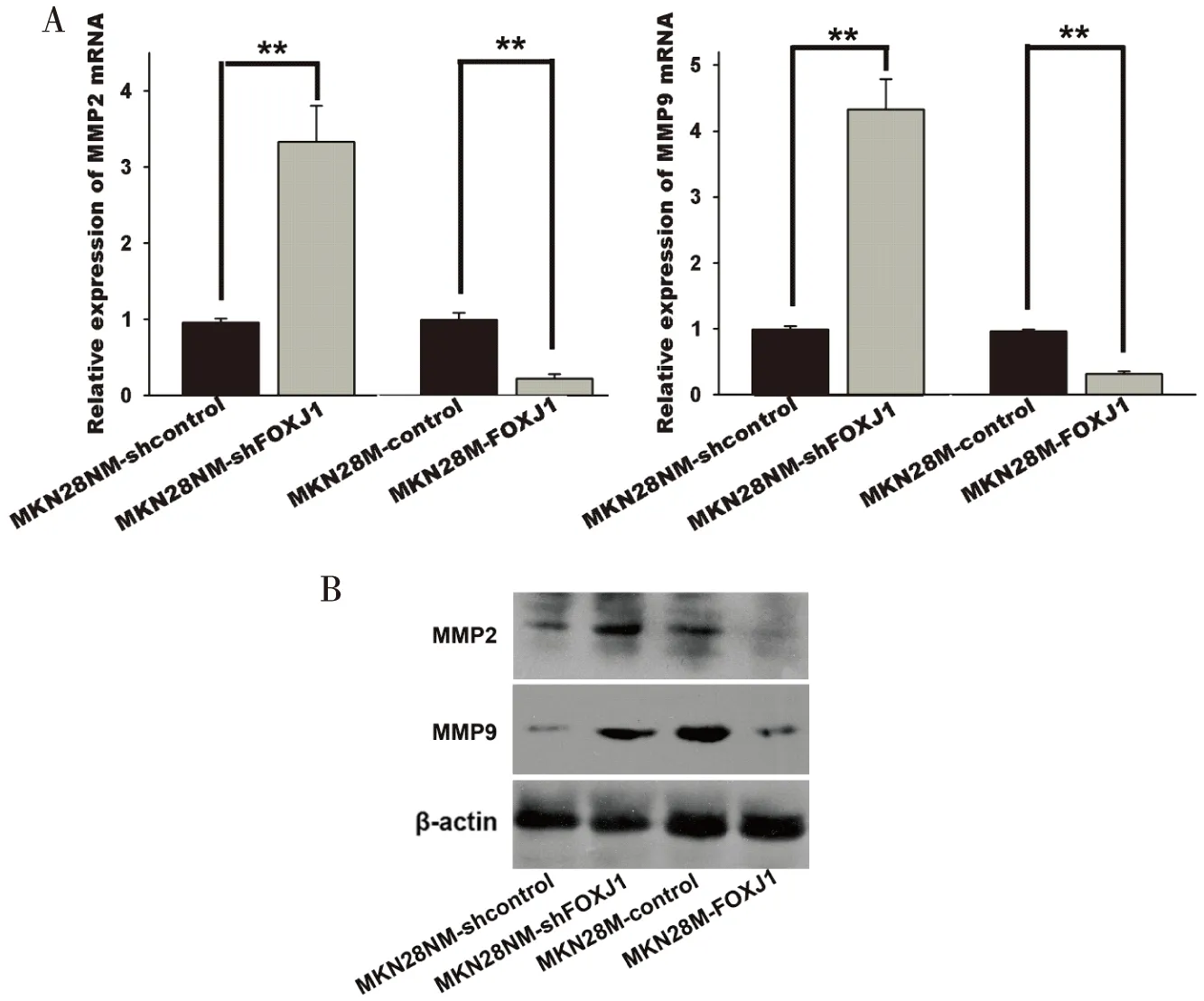
圖1 FOXJ1抑制胃癌細胞MMP2和MMP9的表達
2.3 FOXJ1促進胃癌細胞中TIMP1、TIMP2的表達
對上調/下調FOXJ1的胃癌穩轉細胞系中TIMP1、TIMP2表達水平進行mRNA和蛋白水平檢測,結果表明,MKN28NM-shFOXJ1細胞中TIMP1、TIMP2表達明顯減弱,而MKN28M-FOXJ1細胞中,雖然TIMP1表達變化不明顯,但是TIMP2表達明顯增強(圖2)。
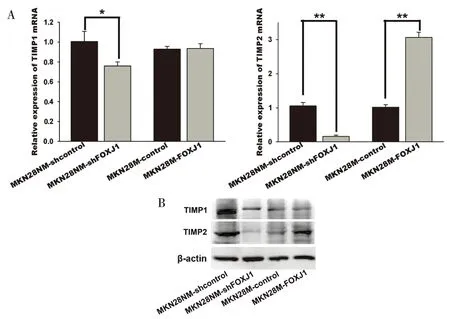
圖2 FOXJ1促進胃癌細胞TIMP2的表達
2.4 FOXJ1與β-catenin在胃癌中的表達呈負相關
通過免疫組化檢測FOXJ1和β-catenin在胃癌組織中的表達,并分析二者表達相關性,結果發現,在105例胃癌組織中(TNM Ⅲ+Ⅳ期50例,淋巴結轉移74例,遠處轉移12例),有42例呈β-catenin核表達陽性,51例呈FOXJ1表達陽性(圖3),Spearman分析提示,胃癌組織中β-catenin核表達與FOXJ1表達呈負相關(相關系數為-0.228,P=0.003,表1)。
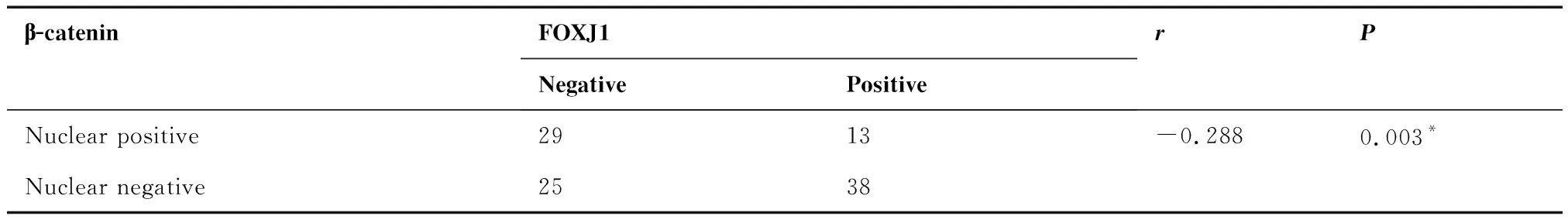
表1 FOXJ1和β-catenin在胃癌中的表達負相關
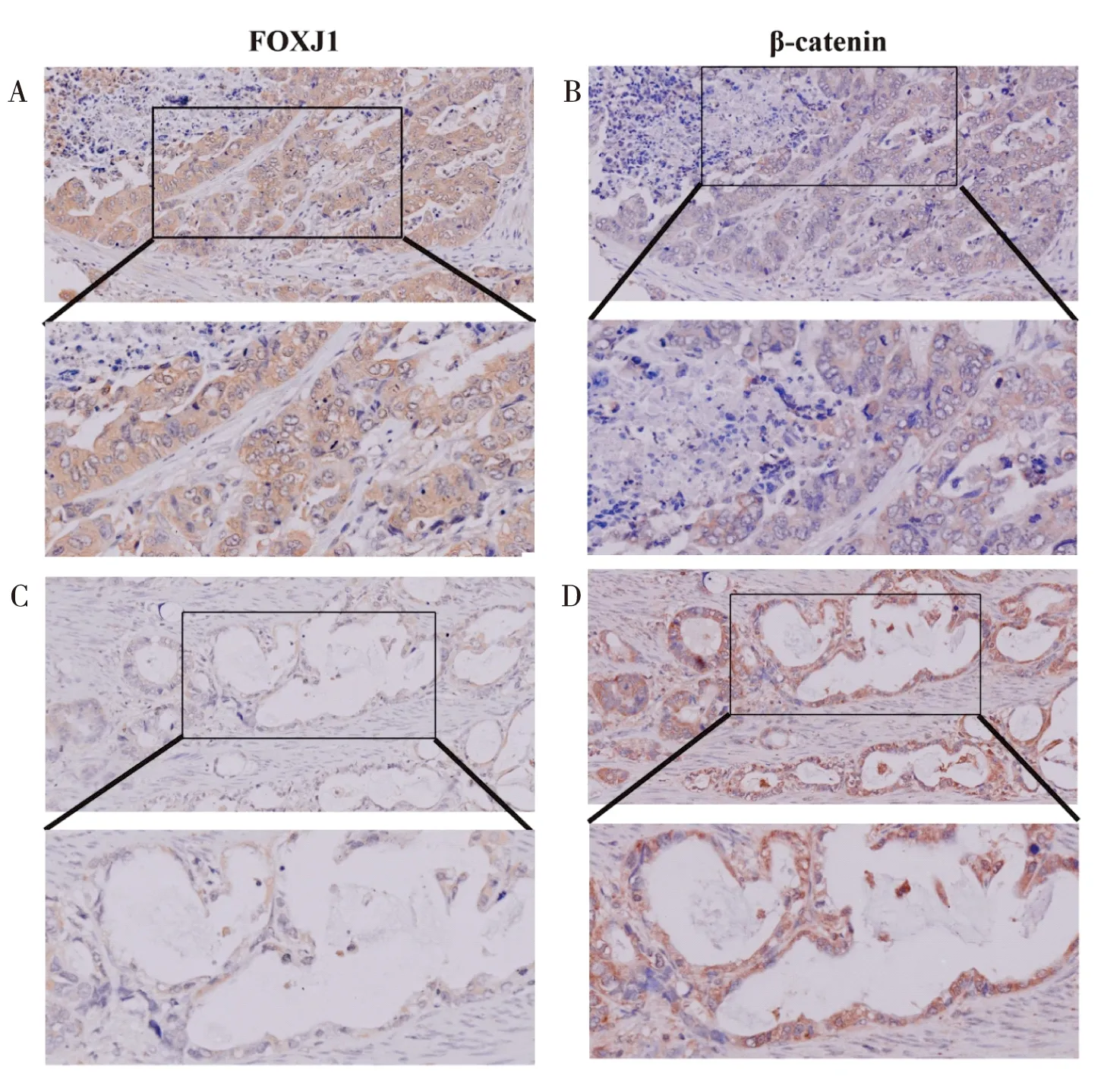
圖3 免疫組化檢測FOXJ1和β-catenin在胃癌中的表達負相關
2.5 FOXJ1可能參與調控胃癌細胞Wnt/β-catenin信號通路
首先通過免疫熒光染色,檢測上調/下調FOXJ1對各穩轉胃癌細胞系中β-catenin表達定位的影響,結果顯示:下調FOXJ1可促進β-catenin在MKN28NM細胞漿中聚集,并增加細胞核中β-catenin表達;而上調FOXJ1可明顯減少MKN28M細胞漿中β-catenin聚集,并抑制細胞核中β-catenin表達(圖4A)。進一步檢測β-catenin在胞核/胞漿中的分布,如圖4B和圖4C所示,FOXJ1對各亞系細胞總蛋白中β-catenin的量影響不大,但是下調FOXJ1可以增加MKN28NM細胞核蛋白中β-catenin的表達量,而上調FOXJ1可降低MKN28M細胞核蛋白中β-catenin的表達量。提示FOXJ1可能抑制β-catenin由細胞漿向細胞核移動。同時,我們還檢測了FOXJ1對Wnt/β-catenin信號通路重要下游基因c-Myc、N-cadherin的表達量(圖4D)和胃癌細胞中內源性T細胞因子(T cell factor,TCF)轉錄活性(圖4e)的影響,發現下調FOXJ1可以顯著升高MKN28NM細胞中c-Myc、N-cadherin表達量和TCF轉錄活性,而上調FOXJ1可降低MKN28M細胞中c-Myc、N-cadherin表達量和TCF轉錄活性。以上結果均提示FOXJ1部分抑制胃癌細胞Wnt/β-catenin通路活性。

圖4 FOXJ1可能抑制胃癌細胞Wnt/β-catenin信號通路
3 討 論
侵襲與轉移是影響胃癌轉歸的最重要因素。但我們對胃癌轉移的調控網絡仍知之有限,其中涉及多個基因、多條信號通路的交互作用,發現調控、連接胃癌轉移的多條信號通路的關節點,對理解胃癌轉移的分子機制,開發治療胃癌的靶向藥物具有重要意義。
FOX家族是一類新的參與腫瘤發生發展的重要轉錄分子。FOX家族成員在胃癌中的作用也受到廣泛關注,研究發現,一方面,FOXCs[10-12]、FOXM1[13-14]、FOXK1[15-16]、FOXQ1[17]可能在胃癌中發揮促癌作用;另一方面,FOXD3[18]、FOXOs[19-21]、FOXF2[22]、FOXA1[23]可能抑制胃癌發生。FOXJ1是FOX家族的成員之一,除了在纖毛形成、胚胎發育分化、抑制自身免疫等生物學行為中起著重要調控作用外,近年也發現FOXJ1在不同腫瘤中發揮著不同作用。我們前期率先發現FOXJ1是抑制胃癌增殖和轉移的重要轉錄因子:FOXJ1在胃癌中的表達下調,并與腫瘤浸潤深度、TNM分期、淋巴結轉移及遠處轉移密切相關,可作為影響胃癌患者生存的獨立預測因素;FOXJ1陰性表達的患者多傾向于發生淋巴結轉移;FOXJ1參與抑制胃癌細胞增殖、侵襲、遷移等多種惡性生物學行為。那么,FOXJ1抑制胃癌發生發展的分子機制是什么呢?目前國內外尚無研究報道。
MMPs與腫瘤細胞的侵襲和轉移密切相關。其中,MMP-2和MMP-9直接參與腫瘤血管發生、降解ECM、破壞基底膜完整性。在本研究中,我們發現,過表達FOXJ1可顯著降低MKN28M中MMP2、MMP9的表達,而干擾FOXJ1可明顯增加MKN28NM中MMP2、MMP9的表達,提示FOXJ1可能通過抑制MMP2、MMP9抑制胃癌細胞的侵襲和轉移。這與FOXL1抑制腎癌細胞侵襲和轉移的機制相似[24]。另外,MMPs的活性受內源性因子組織型金屬蛋白酶抑制物的特異調節。我們前期發現MMPs和TIMPs的表達失衡促進胃癌的發展過程[25]。因此,我們通過檢測上調/下調FOXJ1的穩轉胃癌細胞系中TIMP1、TIMP2的表達水平,發現MKN28M-FOXJ1細胞中TIMP2表達明顯增強,而MKN28NM-shFOXJ1細胞中TIMP1、TIMP2表達明顯降低,提示FOXJ1可能通過TIMP1、TIMP2抑制MMP9和MMP2的活性,進而減少胃癌ECM降解,抑制侵襲和轉移的發生。
Wnt/β-catenin通路的異常活化是調控胃癌發生發展的關鍵機制。本實驗中,我們首先通過Pearson相關性分析FOXJ1和β-catenin在胃癌中的共定位情況,發現二者的核表達呈負相關。進一步免疫熒光染色和核蛋白測定發現,FOXJ1可抑制β-catenin在胃癌細胞漿中聚集及核轉位的發生。而β-catenin由胞漿進入胞核是Wnt/β-catenin激活的重要標志,β-catenin從細胞膜脫離,且胞漿內降解復合體形成受到抑制,導致β-catenin在胞漿中不斷積聚,繼而向核內轉移,與TCF/LEF結合,啟動MMP2、c-Myc等經典下游靶基因轉錄活化,促進細胞異常增殖分化、侵襲轉移[26]。同時,Wnt/β-catenin通路還參與胃癌上皮間質轉化(epithelial-mesenchymal transitions,EMT),間質標志物N-cadherin作為β-catenin的下游分子參與EMT,促進腫瘤細胞的侵襲與轉移[27]。本實驗進一步分析了FOXJ1是否通過Wnt/β-catenin信號轉導調控胃癌進程,結果顯示FOXJ1能夠明顯抑制β-catenin/TCF的轉錄活性以及Wnt/β-catenin通路下游靶蛋白c-Myc、N-cadherin的表達。因此,FOXJ1可能部分通過阻斷Wnt/β-catenin激活,抑制胃癌侵襲和轉移。而FOXJ1如何抑制Wnt/β-catenin信號通路尚有待深入探討。
綜上所述,本實驗在課題組前期研究的基礎上進一步驗證了FOXJ1抑制胃癌侵襲和轉移;FOXJ1通過TIMP1、TIMP2的內源性調節作用抑制MMP9和MMP2的活性,減少胃癌ECM降解;部分通過抑制Wnt/β-catenin通路的異常激活,進而抑制胃癌侵襲和轉移。為揭示胃癌進展的機制網絡、探尋胃癌預后靶點提供新的科學依據。
作者聲明:本文全部作者對于研究和撰寫的論文出現的不端行為承擔相應責任;并承諾論文中涉及的原始圖片、數據資料等已按照有關規定保存,可接受核查。
學術不端:本文在初審、返修及出版前均通過中國知網(CNKI)科技期刊學術不端文獻檢測系統的學術不端檢測。
同行評議:經同行專家雙盲外審,達到刊發要求。
利益沖突:所有作者均聲明不存在利益沖突。
文章版權:本文出版前已與全體作者簽署了論文授權書等協議。

