IL-6對肝細胞癌患者CD8+T淋巴細胞程序性死亡受體1表達和功能的影響
薛 松, 黃高鉑, 楊曉飛, 張 野, 李 彧
1 西安市人民醫院 泌尿外科, 西安 710000; 2 西安交通大學第一附屬醫院 肝膽外科, 西安 710061;3 空軍軍醫大學第二附屬醫院(第四軍醫大學唐都醫院)傳染科, 西安 710038;4 陜西省人民醫院 感染性疾病科, 西安 710068
惡性腫瘤患者外周血和腫瘤微環境中的CD8+T淋巴細胞由于長期接受腫瘤抗原刺激造成免疫檢查點分子表達水平升高,細胞應答和效應功能明顯減弱,造成CD8+T淋巴細胞功能衰竭,不能清除腫瘤細胞,導致疾病進展和腫瘤轉移[1-2]。針對程序性死亡受體-1(programmed death-1, PD-1)、程序性死亡配體(programmed death-ligand 1, PD-L1)等免疫檢查點分子的抑制劑已應用于多種惡性腫瘤的臨床治療中,取得了良好的臨床療效[3-4]。但調控免疫細胞中PD-1表達的機制尚未完全闡明。阻斷IL-6信號通路可通過抑制PD-1/PD-L1信號通路增強機體抗腫瘤活性[5],IL-6介導的信號通路參與了肝細胞癌(HCC)的發病[6]。但IL-6是否能夠通過調控HCC患者PD-1表達從而影響CD8+T淋巴細胞功能尚不清楚。因此,本研究觀察PD-1在HCC患者外周血CD8+T淋巴細胞中的表達,并利用體外細胞培養系統研究IL-6對HCC患者CD8+T淋巴細胞PD-1表達的影響,初步探討HCC患者CD8+T淋巴細胞的功能狀態及其在HCC發病中的機制。
1 資料與方法
1.1 研究對象 本研究嚴格按照《赫爾辛基宣言》原則進行,招募于2019年1月—2019年9月期間在陜西省人民醫院或空軍軍醫大學第二附屬醫院(第四軍醫大學唐都醫院)就診的HCC患者(HCC組)。納入標準:(1)年齡18~60歲;(2)診斷符合《原發性肝癌診療規范(2019年版)》[7]的要求;(3)入組前未接受過手術、介入、放療、免疫及靶向等治療。排除標準:(1)合并重要臟器(心臟、肝臟、腎臟、神經系統)功能障礙;(2)合并其他惡性腫瘤;(3)合并其他精神障礙;(4)合并獲得性免疫缺陷綜合征;(5)合并自身免疫性疾病。同時,招募19例年齡和性別匹配的健康對照者(HC組)。
1.2 方法
1.2.1 實驗試劑和材料 Ficoll淋巴細胞分離液購自美國Sigma公司;IL-6、IFNγ和TNFα ELISA試劑盒購自武漢華美生物公司;抗人IL-6中和抗體購自美國InvivoGen公司;抗人CD3-PerCP、抗人CD8-APC Cy7、抗人PD-1(CD279)-FITC購自美國BD公司;CD8+T淋巴細胞分選試劑盒購自德國美天旎公司;CCK-8試劑盒購自武漢碧云天公司;Trizol試劑購自美國Invitrogen公司;反轉錄試劑盒和TB Green實時定量PCR試劑盒購自TaKaRa公司;兔抗信號傳導及轉錄激活蛋白3(signal transducer and activator of transcription 3, STAT3)、兔抗STAT3(phospho Y705)、兔抗Src、兔抗Src(phospho Y418)、兔抗GAPDH、山羊抗兔IgG均購自美國Abcam公司。FACS Calibur流式細胞儀為美國BD公司產品;ABI 7500型熒光定量PCR儀為美國Applied Biosystem公司產品。
1.2.2 外周血單個核細胞(PBMC)和血漿分離 清晨、空腹采集所有入組志愿者EDTA抗凝外周血10 mL,4 ℃、1000 r/min離心10 min后收集上層血漿凍存備用,下層血細胞使用Ficoll淋巴細胞分離液,采用密度梯度離心法分離PBMC,以107個/mL的濃度凍存備用。
1.2.3 流式細胞檢測CD8+T淋巴細胞表面PD-1的表達 取106個PBMC,使用抗人CD3-PerCP、抗人CD8-APC Cy7、抗人PD-1-FITC對其進行染色,使用FACS Calibur流式細胞儀對染色后的細胞進行檢測,使用FlowJo V10軟件進行分析。
1.2.4 CD8+T淋巴細胞分選和培養 取107個PBMC,使用CD8+T淋巴細胞分選試劑盒按說明書要求分選CD8+T淋巴細胞,采用流式細胞術對分選后的細胞進行純度鑒定,純化比例>95%。參考既往文獻[8]報道中的操作,使用抗人IL-6中和抗體(終濃度為20 ng/mL)刺激分選的CD8+T淋巴細胞24 h,收集細胞和上清進行后續實驗。
1.2.5 細胞增殖試驗 將分選的CD8+T淋巴細胞接種于96孔板,每個志愿者的CD8+T淋巴細胞設立4個復孔,每孔中加入2×105個純化的CD8+T淋巴細胞,其中2個孔加入終濃度為20 ng/mL的抗人IL-6中和抗體培養(為實驗組),另外2個孔加入等量的培養液(為對照組),培養12 h后收集上清和細胞。使用CCK-8細胞增殖檢測試劑盒按說明書要求對細胞增殖檢測。以OD450 nm表示細胞增殖水平。
1.2.6 ELISA檢測細胞因子含量 對血漿中IL-6、培養上清中IFNγ和TNFα使用ELISA試劑盒進行檢測。
1.2.7 實時定量PCR 對抗人IL-6中和抗體處理后的CD8+T淋巴細胞提取總RNA,按TaKaRa反轉錄試劑盒要求逆轉錄cDNA,采用TB Green實時定量PCR法對CD8+T淋巴細胞中穿孔素、顆粒酶B和顆粒溶素mRNA的相對表達量進行檢測。引物序列見表1。

表1 實時定量PCR引物序列
1.2.8 Western blot 取抗人IL-6中和抗體處理后的CD8+T淋巴細胞,加入含有Protease/Phosphatase Inhibitor Cocktail的2×SDS buffer,于冰上裂解細胞15 min,再于95 ℃孵育10 min后,于12 000 r/min離心2 min,收集上清。BCA法進行蛋白定量。配置SDS-PAGE(5%濃縮膠、10%分離膠),以30 μg/泳道上樣、電泳,電轉移至PVDF膜,5%脫脂奶粉/TBST封閉,洗滌后加入兔抗STAT3、兔抗STAT3(phospho Y705)、兔抗Src、兔抗Src(phospho Y418)、兔抗GAPDH,4 ℃孵育過夜,洗滌后加入山羊抗兔IgG室溫孵育2 h,洗滌后加入ECL,曝光。
1.3 倫理學審查 本研究方案經陜西省人民醫院醫學倫理委員會(批號:省醫倫2017-082號)和空軍軍醫大學第二附屬醫院(第四軍醫大學唐都醫院)醫學倫理委員會批準(批號:TDLL-201505-013),所有入組志愿者均簽署知情同意書。

2 結果
2.1 一般資料 HCC組和HC組一般資料見表2。兩組在性別比例、年齡之間的差異均無統計學意義(P值均>0.05)。
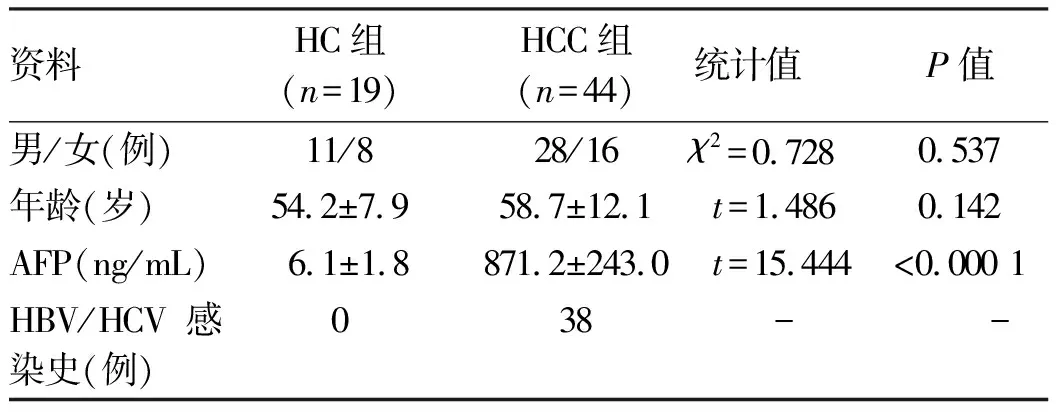
表2 入組志愿者一般資料
2.2 兩組患者血漿IL-6表達水平的比較 HCC組血漿IL-6的水平較HC組[(99.67±20.92)pg/mL vs (81.05±16.76)pg/mL]顯著升高(t=3.427,P=0.001 1)(圖1)。
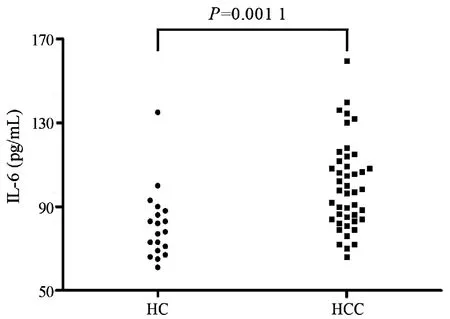
圖1 HC組和HCC組血漿IL-6水平比較
2.3 兩組患者外周血CD8+T淋巴細胞比例與PD-1陽性比例的比較 HC組和HCC組CD3+CD8+T淋巴細胞以及PD-1在CD8+T淋巴細胞中表達的典型流式散點圖見圖2a。外周血CD3+CD8+T淋巴細胞的比例在HC組和HCC組之間的差異無統計學意義(26.37%±6.59% vs 29.43%±6.99%,t=1.618,P=0.111)(圖2b),但HCC組患者中PD-1+CD8+細胞的比例(3.79%±1.36%)則顯著高于HC組(2.20%±0.47%),差異具有統計學意義(t=5.335,P<0.000 1)(圖2c)。
2.4 HCC患者外周血CD8+T淋巴細胞在抗人IL-6中和抗體處理后細胞增殖、PD-1表達以及分泌細胞因子的變化 CCK-8結果提示,抗人IL-6中和抗體對CD8+T淋巴細胞增殖無明顯影響(t=1.285,P=0.206)(圖3a),但PD-1+細胞占CD8+T淋巴細胞的比例在抗人IL-6中和抗體處理后顯著下降(3.33%±1.12% vs 2.67%±0.91%,t=2.177,P=0.035)(圖3b)。抗人IL-6中和抗體處理后CD8+T淋巴細胞分泌IFNγ的水平顯著升高[(10.82±1.37)pg/mL vs (13.50±3.82)pg/mL,t=3.170,P=0.002 8](圖3c),但TNFα在抗人IL-6中和抗體處理與未處理組中分泌水平的差異無統計學意義[(96.66±15.78)pg/mL vs(103.20±16.06)pg/mL,t=1.385,P=0.173](圖3d)。
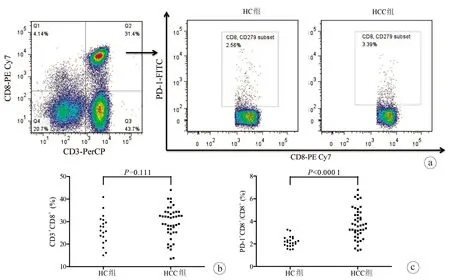
注:a,典型流式散點圖;b,CD3+CD8+T淋巴細胞比例;c,PD-1+CD8+細胞比例。

注:a,細胞增殖;b,PD-1+CD8+細胞比例;c,IFNγ水平; d,TNFα水平。
2.5 HCC患者外周血CD8+T淋巴細胞在抗人IL-6中和抗體處理后穿孔素、顆粒酶B和顆粒溶素mRNA以及STAT3和Src蛋白磷酸化的變化 取上述刺激后的CD8+T淋巴細胞,分別提取mRNA和蛋白,實時定量PCR結果提示,抗人IL-6中和抗體處理后CD8+T淋巴細胞中穿孔素和顆粒酶B mRNA的相對表達量均顯著升高(t值分別為6.161、14.140,P值均<0.000 1)(圖4a、b),但顆粒溶素mRNA的相對表達量在抗人IL-6中和抗體處理和未處理的CD8+T淋巴細胞之間的差異無統計學意義(t=1.493,P=0.143)(圖4c)。對Western blot結果進行半定量分析發現,抗人IL-6中和抗體處理后總STAT3和總Src的水平均無顯著變化,對Src的磷酸化亦無明顯影響,但STAT3磷酸化水平在抗人IL-6中和抗體處理后顯著降低(P<0.000 1)(圖4d、e)。
3 討論
在免疫功能紊亂和腫瘤發生發展之間,細胞因子/趨化因子、免疫細胞和免疫分子所構成的免疫網絡發揮重要作用。HCC的發生與不同病因(包括慢性乙型肝炎、慢性丙型肝炎、酒精性肝病、非酒精性脂肪性肝病等)造成的慢性炎癥和纖維化密切相關,以TNFα和IL-6為代表的炎癥細胞因子及其下游信號轉導通路不但可誘導HCC發生,還能促進炎癥,加重肝損傷[9]。同時,促炎細胞因子亦可調控T淋巴細胞表面免疫檢查點分子PD-1的表達,參與機體免疫和炎癥應答調控[10]。因此,本研究探討了促炎因子IL-6對HCC患者CD8+T淋巴細胞功能的調節作用和初步機制。結果顯示,HCC患者外周血IL-6水平以及CD8+T淋巴細胞表面PD-1水平均顯著升高,阻斷IL-6介導的信號通路可降低HCC患者CD8+T淋巴細胞PD-1表達,增加IFNγ分泌和穿孔素、顆粒酶B mRNA相對表達量,提示抑制IL-6可能增強了HCC患者CD8+T淋巴細胞的功能。
IL-6是固有免疫應答中重要的細胞因子之一,主要由單核巨噬細胞分泌,發揮促炎作用。IL-6還能調控巨噬細胞極化,在HCC發生過程中,IL-6/STAT3信號通路可抑制M1型巨噬細胞、活化M2型巨噬細胞,從而促進HCC細胞活性、增殖、遷移和侵襲[11]。因此,無論是經典的IL-6信號通路還是IL-6跨信號通路(trans-signaling)均可通過不同的機制(包括: 抑制p53抑癌基因、 增強β-連環蛋白活性、保護腫瘤細胞免受DNA損傷所致的凋亡、直接促進內皮細胞增殖等)誘導HCC發生發展[12]。IL-6/STAT3信號通路還可通過調控肝臟腫瘤干細胞活性誘導針對索拉非尼耐藥的肝癌細胞[13],降低IL-6的表達則可增強肝癌細胞對索拉非尼的敏感性[14]。本研究發現,HCC患者外周血IL-6的水平較健康志愿者顯著升高,進一步提示IL-6參與了HCC的發生發展,但其中的機制仍有待深入研究。

注:a,穿孔素mRNA;b,顆粒酶B mRNA;c,顆粒溶素mRNA;d,總STAT3、磷酸化STAT3、總Src、磷酸化Src Western blot檢測;e,條帶灰度比較。
通過流式細胞術檢測發現,HCC患者外周血CD8+T淋巴細胞所占比例與健康對照者的差異無統計學意義。但是,HCC患者CD8+T淋巴細胞中PD-1水平顯著升高,PD-1作為重要的免疫檢查點分子,已證實在腫瘤、感染性疾病、自身免疫性疾病中發揮重要的免疫調控作用[15],PD-1的表達升高可能誘導CD8+T淋巴細胞功能衰竭,使HCC疾病惡化。在炎癥性關節病中,以IL-6為代表的促炎細胞因子可增加膜型和可溶型PD-1的表達[10]。在腫瘤微環境中,抗IL-6中和抗體和抗PD-1/PD-L1抗體亦可發揮協同作用,打破腫瘤微環境中的免疫耐受,抑制腫瘤生長[16-17]。這提示IL-6和PD-1之間可能存在相互作用。新近的研究[18]發現,在HCC發病過程中,IL-6可通過抑制受體型蛋白酪氨酸磷酸酶O促進單核巨噬細胞中PD-L1表達。由于本研究發現HCC患者IL-6和PD-1的表達均升高,因此,本研究利用抗人IL-6中和抗體處理HCC患者分選的CD8+T淋巴細胞,觀察抑制IL-6對CD8+T淋巴細胞的影響,并分析其初步機制。結果發現,抑制IL-6可增強HCC患者CD8+T淋巴細胞的功能,主要表現為PD-1的表達降低、IFNγ分泌增加、穿孔素和顆粒酶B mRNA的相對表達量增加。這一結果與在病毒感染中所發現的IL-6促進病毒特異性細胞毒性CD8+T淋巴細胞增殖和分化的結果[19-20]不盡相同,這可能與不同的疾病類型有關。因此,進一步對IL-6的下游信號通路進行了分析,結果發現,抑制IL-6主要影響HCC患者CD8+T淋巴細胞中的JNK-STAT3信號通路,而對Src信號通路無顯著影響。但值得注意的是,本研究納入的樣本量相對較少,且腫瘤免疫網絡的調控非常復雜,本研究結果仍需擴大樣本量并進行體內動物實驗加以證實。
綜上,本文研究表明HCC患者中IL-6和CD8+T淋巴細胞中PD-1的表達升高,抑制IL-6可能通過降低PD-1表達、增加IFNγ分泌和升高穿孔素及顆粒酶B水平發揮增強HCC患者CD8+T淋巴細胞的作用。
利益沖突聲明:本研究不存在研究者、倫理委員會成員、受試者監護人以及與公開研究成果有關的利益沖突。
作者貢獻聲明:薛松、黃高鉑負責實驗操作,文章撰寫;楊曉飛負責患者入組,資料分析;李彧、張野負責課題設計,患者入組,資料分析;李彧負責擬定寫作思路,指導撰寫論文并最后定稿。

