膽汁酸代謝調節膽汁淤積性肝病的作用機制及藥物研發
李 靜, 鄭葵陽, 張蓓蓓
徐州醫科大學病原生物學與免疫學教研室, 徐州醫科大學感染與免疫實驗室,江蘇省免疫與代謝重點實驗室, 江蘇 徐州 221004
膽汁淤積性肝病(cholestatic liver disease,CLD)是各種原因導致肝臟內外膽汁的生成、分泌排泄發生障礙,使得膽汁流無法正常流入十二指腸而進入血液的一類肝膽疾病的統稱[1-2]。通常將其分為肝內膽汁淤積和肝外膽汁淤積。引起膽汁淤積的原因主要包括遺傳因素、藥物損傷、酒精刺激、腫瘤、病毒、微生物、寄生蟲感染等[3-4]。目前對該病的發病機制、診斷、治療手段的認識尚不夠完善,因此該病的預防及治療存在一定挑戰。
CLD最重要的病理學表現是膽汁淤積,膽汁淤積必然伴隨肝臟中膽汁酸濃度及成分的變化。越來越多的研究顯示,膽汁酸不僅可以作為清潔劑促進組織營養吸收,還可作為重要的信號分子作用于膽汁酸受體,通過調節相關信號通路,最終影響CLD的疾病發展過程。本文將重點論述膽汁酸代謝在CLD中的作用及機制,以及用于治療該病的膽汁酸及其相關衍生物藥物的研發進展,以期提高人們對此類疾病的認識和理解,為今后CLD預防及治療的研究提供參考。
1 膽汁酸代謝與CLD
1.1 膽汁酸代謝生理功能 膽汁酸是膽固醇代謝的終末產物,分為初級膽汁酸和次級膽汁酸兩大類,主要存儲于肝臟、膽囊、腸道中。膽汁酸合成是促進膽固醇分解代謝重要的生物學過程,負責機體大約90%的膽固醇輸出。初級膽汁酸主要在肝臟中合成,存儲于膽囊,經過十二指腸進入到腸道,腸道中95%的膽汁酸經過腸肝循環重吸收至肝臟中。膽汁酸除了調節肝腸營養吸收,其還可作為信號分子激活膽汁酸受體調節宿主免疫應答,糖、脂和能量代謝及腸道菌群穩態等生理活動[3,5-6]。
膽汁酸的生物活性與其在組織內的濃度密切相關。一般情況下,15~25 μmol/L的膽汁酸可作為信號分子,濃度達到50~200 μmol/L則可以引起細胞凋亡,濃度高于200 μmol/L則作為炎癥因子引起炎癥反應,而濃度在200~2000 μmol/L甚至高于2000 μmol/L時可造成細胞壞死[7]。研究[8]證實膽汁酸濃度的變化嚴重影響肝臟生理功能,高濃度的膽汁酸具有細胞毒性作用。另一方面膽汁酸代謝發生改變后,打破肝臟代謝的穩態,可誘發肝臟炎癥,促進非酒精性脂肪性肝病的發生發展,促進肥胖、糖尿病、炎癥性腸病等疾病進展。
1.2 膽汁酸代謝在CLD中的作用
1.2.1 調節自身代謝 肝臟膽汁酸流的正常轉運依賴多種轉運蛋白及酶的參與。如肝細胞合成膽汁酸后,膽汁酸輸出泵是膽汁酸分泌到膽小管內的主要流出通道,肝血竇轉運蛋白Na+依賴牛磺膽酸鈉協同轉運蛋白(sodium taurocholate cotransporting polypeptide,NTCP)、有機陰離子轉運蛋白是介導膽汁酸進入肝細胞的主要轉運蛋白[9]。正常的腸肝循環在肝臟膽汁酸流穩態中發揮重要的作用。病理狀態下,膽汁酸流腸肝循環受阻,肝臟中膽汁酸大量聚集使得肝細胞中膽汁酸濃度過高,肝細胞完整性被破壞,從而引起細胞凋亡、壞死、促炎基因的表達等,即引起CLD。此時肝細胞基底膜表達的多藥耐藥相關蛋白4以及有機溶質轉運體α/β表達上調,代償性促進肝細胞膽汁酸的分泌[10]。另外,高濃度的膽汁酸通過活化核受體法尼醇X受體(farnesoid X receptor,FXR)、孕烷X受體、組成性雄烷受體及小異二聚體伴侶受體應激性抑制肝臟膽汁酸流[11],其中FXR起主導作用,其主要通過以下途徑緩解肝臟膽汁酸沉積造成的肝毒性作用:(1)抑制膽汁酸合成限速酶膽固醇7α-羥化酶(mitochondrial sterol 7-hydroxylase,CYP7A1)的表達,抑制肝細胞膽汁酸合成能力;(2)腸道中FXR活化后上調纖維母細胞生長因子15/19(fibro-blast growth factor 15/19,FGF15/19)的表達并轉移至肝臟中與肝細胞表面的FGFR4受體結合也可以抑制CYP7A1的表達;(3)通過下調NTCP的表達抑制肝細胞吸收膽汁酸的能力;(4)直接作用于膽汁酸輸出泵,促進膽汁酸分泌到膽汁中[8,12]。因此,膽汁酸受體和膽汁酸相關轉運蛋白成為CLD藥物研發的關鍵作用靶點。
1.2.2 細胞毒性作用 病理狀態下,炎癥反應會破壞膽-血屏障,肝細胞和膽管上皮細胞的基底外側質膜暴露在毒性膽汁酸鹽中,導致細胞凋亡或壞死[13]。膽汁酸還可通過激活NF-κB通路來介導細胞因子如IL-6、TNFα的產生促進炎癥反應[2]。也有研究發現,在過表達肝再生增強因子的細胞中,由于死亡受體DR5的表達減少,甘氨鵝脫氧膽酸誘導的凋亡減少。這一結果在人的樣本中亦得到驗證。在膽汁淤積患者的肝臟中發現,肝再生增強因子和肝再生增強因子表達的誘導物FOXA2下調,膽汁酸誘導的細胞凋亡顯著增加。研究[14]認為不同膽汁酸對組織細胞的增殖和炎癥有不同的作用,親水性膽汁酸對組織細胞具有一定的保護作用,而疏水性膽汁酸則會引起肝細胞凋亡和肝損傷。當膽汁酸引起細胞毒性損傷后,膽汁酸核受體FXR和膜受體G蛋白耦聯膽汁酸受體5(takeda G protein-coupled receptor 5,TGR5)可通過負性調節發揮肝保護作用。FXR通過控制膽汁酸的合成和分泌維護肝臟膽汁酸的穩態,進而抑制高濃度膽汁酸造成的細胞氧化應激和損傷,其可通過膽汁酸激動劑增加FXR基因的表達來抑制細胞凋亡和腫瘤的發生[15]; TGR5不同于FXR,其可通過Gs蛋白將細胞外的信號轉移到胞內,在磷脂酰肌醇3-羥激酶的催化下,激活第二信使AKT,AKT蛋白磷酸化后能夠抑制凋亡蛋白Bcl-2的表達。有研究發現石膽酸刺激MCF-7細胞后,TGR5表達的升高可促進促凋亡P53蛋白的表達,而抑制抗凋亡蛋白Bcl-2細胞的表達,所以石膽酸能夠促進MCF-7細胞凋亡[16]。因此,膽汁酸產生細胞毒性作用的同時,又可通過相關受體以負反饋的方式抑制膽汁酸的過度累積或直接調節細胞損傷過程。
1.2.3 調節炎癥反應 肝臟中高濃度膽汁酸可殺傷肝細胞和膽管上皮細胞,是造成肝臟炎癥反應的啟動因素。另外,膽汁酸可以作為炎性因子促進多種炎癥因子分泌,包括細胞因子、趨化因子、黏附分子以及花生四烯酸通路相關限速酶的產生和分泌[17]。在小鼠膽管結扎模型中研究顯示,疏水性膽汁酸鵝去氧膽酸和膽酸可通過促進肝細胞分泌中性粒細胞細胞間黏附分子1和CXC趨化因子配體1誘導中性粒細胞大量募集[4],膽汁酸通過促進肝細胞分泌IL-23誘導輔助性T淋巴細胞炎性浸潤,在IL-17A的作用下促進肝組織中性粒細胞促炎性細胞因子的釋放。而中性粒細胞通過釋放反應氧物質引起細胞氧化應激而導致細胞壞死,以正反饋的方式加劇肝細胞損傷[18]。另外膽汁酸還可通過調節耐受性樹突狀細胞轉變成高反應型,進而調節T淋巴細胞分泌炎癥細胞因子[17]。在巨噬細胞研究[19]中發現,膽汁酸通過直接作用于巨噬細胞表面TGR5受體,抑制炎癥小體的活性,從而誘導巨噬細胞產生抗炎性表型。因此,膽汁酸可通過多細胞、多途徑調節炎癥反應狀態參與CLD的疾病進程。
1.2.4 細胞自噬 自噬是細胞通過降解自身的細胞質或細胞器為生物合成提供可循環利用的原料,從而維持細胞內環境穩定和蛋白代謝平衡的生理過程。當細胞處于饑餓、低氧、損傷等不利環境時,自噬的發生對維持細胞存活、抑制凋亡是非常重要的[20]。有研究[21]表明,鵝去氧膽酸和奧貝膽酸等部分膽汁酸以及膽汁酸受體激動劑可以抑制自噬的發生。膽汁淤積癥狀態下膽汁酸激活FXR后,通過作用于靶蛋白Rubicon抑制自噬溶酶體的形成,從而使得細胞自噬功能受損[22]。然而,熊去氧膽酸(ursodeoxycholic acid,UDCA)是肝臟細胞自噬的有效誘導劑,其可促進溶酶體和自噬體的融合,同時誘導自噬體形成,降低自噬抑制蛋白Rubicon的表達以增強自噬流,從而抵消膽汁淤積對自噬的負面影響。甘氨鵝去氧膽酸是膽汁淤積患者肝臟主要的膽汁酸分子,可促進膽管結扎小鼠肝細胞自噬的發生,當抑制細胞自噬后,膽管結扎引起的肝損傷加重[23]。最新的研究[24]顯示,甘氨鵝去氧膽酸可通過促進肝癌細胞的自噬提高細胞的侵襲能力。但是這些研究均缺乏對細胞自噬流的細致研究。而最近有研究[20]揭示膽汁酸誘導細胞LC3自噬小體產生后,自噬小體與溶酶體融合能力下降,自噬流產生受阻。
2 膽汁酸代謝調節CLD的分子機制
2.1 FXR 核受體FXR廣泛表達于肝臟、腸道等富含膽汁酸的組織中,膽汁酸如鵝去氧膽酸、去氧膽酸、石膽酸是其內源性配體。研究[16]顯示,FXR信號通路是調節肝臟膽汁酸合成及分泌的重要途徑,其主要通過調節膽汁酸代謝相關限速酶以及轉運蛋白抑制肝細胞膽汁酸合成、吸收以及促進膽汁酸分泌到膽汁中緩解膽汁濃度過高造成的毒性損傷。如FXR活化后通過抑制CYP7A1和CYP27A1的表達,減少膽汁酸合成,上調膽汁酸輸出泵、多藥耐藥相關蛋白2以及NTCP促進肝臟膽汁酸的轉運分泌[25]。
原發性硬化性膽管炎(primary sclerosing cholangitis,PSC)患者肝臟中FGF-Src-FXR信號是顯著缺失的,研究[26]發現通過上調FGF19介導FXR Y67位點磷酸化可促進FXR核轉移,從而調節膽汁酸水平,緩解肝膽汁淤積性病理損傷。而β-catenin通過抑制FXR的核轉移,阻止FXR/RXRα復合體的形成,從而降低FXR抑制膽汁合成的能力[27]。腸道菌群在CLD中的作用日益受到關注,最新研究[28]發現,乳桿菌GG移植通過活化小鼠FXR-FGF-15軸抑制膽汁酸合成及促進膽汁酸分泌。因此,在基礎研究以及臨床藥物研發工作中,FXR已成為治療CLD重要的作用靶點。
2.2 TGR5 TGR5是G蛋白偶聯受體超家族成員之一,主要表達于膽囊、肝、腸等組織,參與體內多種代謝性疾病的發生和發展[29]。在肝臟中,TGR5主要表達在髓竇內皮細胞、巨噬細胞、膽管上皮細胞以及活化的肝星狀細胞中,而在肝細胞、靜息狀態下的肝星狀細胞中幾乎不表達[30]。TGR5與膽汁酸結合后活化,通過激活下游信號通路如CAMP/PKA、AKT信號通路,調節細胞因子、炎癥小體的形成,發揮抗炎、抗膽汁淤積和抗細胞凋亡的作用[29]。CLD致病機制研究[31]發現,CA和結合性石膽酸刺激TGR5-/-小鼠引起的膽汁淤積性肝損傷較野生型小鼠嚴重。同時,研究發現在PSC患者體內TGR5 mRNA水平顯著下調。膽管上皮細胞TGR5表達下降后,其更容易遭受膽汁酸引起的細胞毒性作用,并促進PSC以及原發性膽汁性膽管炎(primary biliary cholangitis,PBC)的疾病進展[32],但TGR5表達下調是PSC的疾病起因還是結果目前是不明確的。而在肝內膽管細胞癌中,TGR5與癌細胞的增殖及遷移密切相關,抑制TGR5的表達將是膽管細胞癌治療的又一重要途徑[22,33]。
TGR5對膽管疾病的調節作用主要是通過影響膽管上皮細胞狀態及功能。研究[32,34]顯示,膽汁酸刺激誘導膽管上皮細胞TGR5活化后可促進反應氧物質以及cSrc表達上調,由此介導上皮生長因子的高表達以及ERK1/2磷酸化,最終促進膽管上皮細胞的增殖。另外,TGR5活化后,還可促進下游信號cAMP表達升高,通過囊性纖維化跨膜電導調節因子誘導氯化物大量分泌,從而促進膽管上皮細胞分泌富含碳酸氫鹽的膽汁,形成具有保護作用的“碳酸氫鹽保護傘”。因此,TGR5除了促進膽管上皮細胞的增殖之外,也可發揮抗凋亡的作用[30]。
2.3 腸道菌群 初級膽汁酸在肝細胞合成后與甘氨酸或牛磺酸結合并分泌到膽管中,大部分結合膽汁酸進入腸道,并在回腸末端被重吸收,在頂端鈉離子依賴膽汁酸轉運蛋白的作用下再次進入肝臟并分泌到膽汁中,即完成“腸肝循環”,進入到回腸和結腸的結合膽汁酸在腸道菌群的作用下代謝形成次級膽汁酸[35]。正常狀態下,二者相互協調維持各自穩態。而在CLD中,肝臟、膽囊和十二指腸膽汁酸過度淤積,異常的膽汁酸通過腸肝循環進一步影響腸道菌群穩態,而腸道菌群通過代謝分解膽汁酸影響膽汁酸的組成和疏水性。在小兒膽汁淤積癥[36]、PSC[37]、PBC[38]患者體內腸道菌群的組成及多樣性均發生顯著改變,并且Rühlemann等[39]指出腸道菌群韋榮球菌的物種豐度可作為PSC的潛在診斷指標。
而腸道菌群的改變又會反過來影響膽汁酸代謝。如在Mdr2-/-引起的PSC小鼠模型中,腸道菌群的失調引起腸道屏障功能障礙和菌群易位,易位的菌群釋放的內毒素通過腸肝循環誘發NLRP3介導的固有免疫反應,最終促進疾病的發展和膽汁酸代謝紊亂[40]。同時,外周血中IL-17水平上調,肝臟IL17A+γδTCR+細胞數目增加,并伴隨肝臟和腸道中乳酸桿菌Lactobacillusgasseri豐度增加。研究者[41]通過體內外實驗進一步證實Lactobacillusgasseri可促進IL-17水平升高以及肝臟IL17A+γδTCR+細胞浸潤。因此Lactobacillusgasseri通過IL-17誘導IL17A+γδTCR+細胞活化是CLD另一重要的致病機制。除了Lactobacillusgasseri豐度增加,肝臟中腸球菌Enterococcus的豐度也是上調的, 但其在CLD中的作用目前還未有研究。乳桿菌GG通過抑制膽汁酸的合成和促進膽汁酸的分泌,降低肝臟中膽汁酸淤積引起的毒性損傷作用,從而有效抑制肝臟纖維化病變[28]。巨噬細胞可通過提高炎癥小體活化破壞腸道滲透性,因此來影響腸道菌群組成及物種豐度,協同膽汁酸促進肝細胞損傷,促進膽汁淤積病變的發展[42](圖1)。
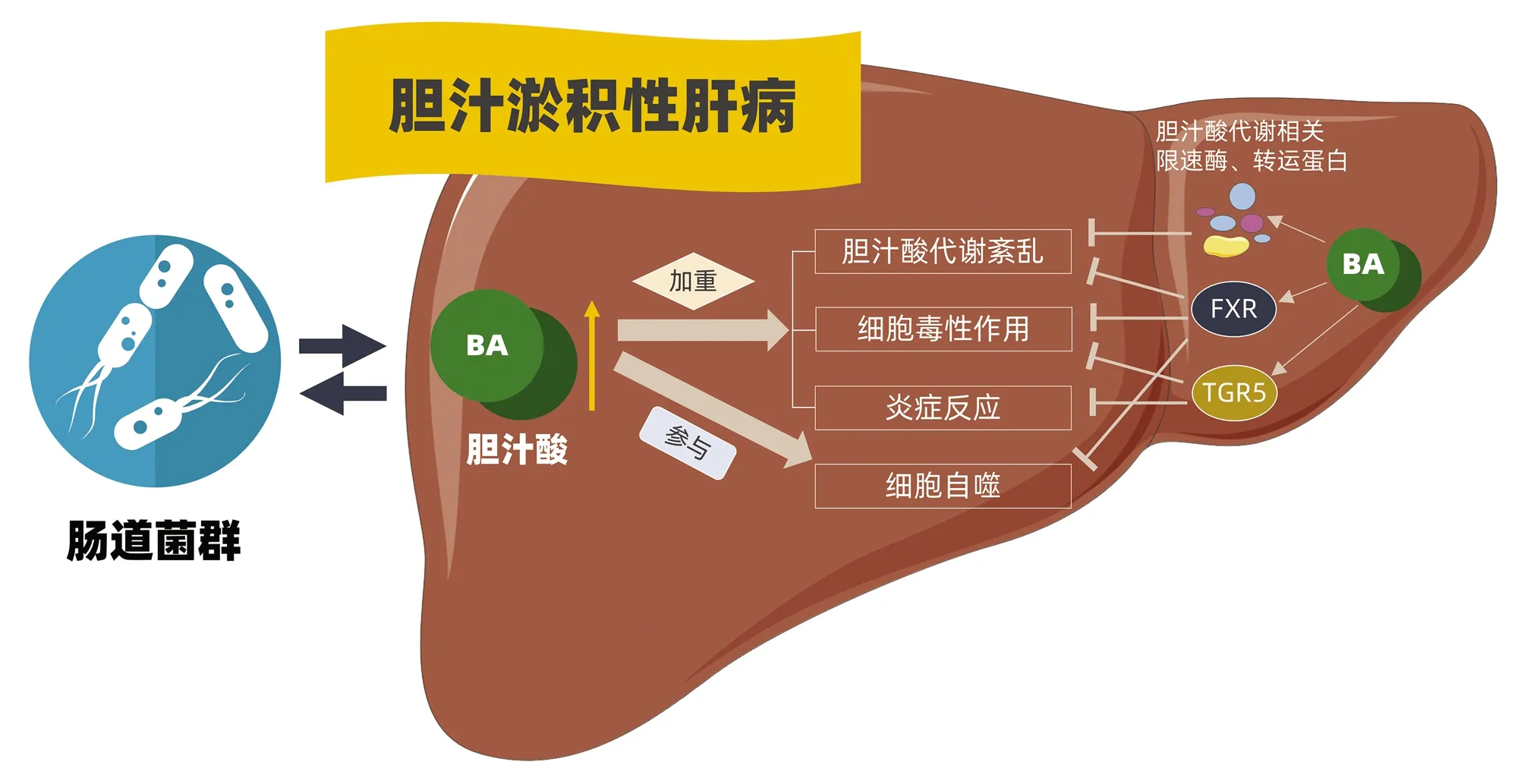
圖1 膽汁酸代謝調節CLD的分子機制
膽汁淤積性肝病表現為肝臟膽汁淤積,一方面與腸道菌群相互作用,影響肝臟膽汁酸代謝,參與膽汁酸含量過高引起的肝臟膽汁酸代謝紊亂、肝細胞和膽管上皮細胞細胞毒作用、炎癥反應、自噬等現象的發生。肝臟膽汁酸水平過高又可通過膽汁酸代謝相關限速酶和轉運蛋白、FXR、TGR5等受體抑制膽汁酸引起的膽汁淤積性病理損傷。
3 基于膽汁酸代謝的CLD治療靶點和藥物研發進展
去除病因和對癥治療是CLD治療最主要的手段,如病毒感染、酒精、藥物引起的急性CLD,一旦去除病因,可以很快恢復。而自身免疫性CLD如PBC和PSC,由于病因無法消除,此類CLD主要依靠藥物治療緩解癥狀,延緩疾病的發展。而隨著膽汁酸代謝在CLD中的作用機制研究的深入,基于膽汁酸代謝的靶向藥物的研發成為CLD治療策略研究領域的熱點。其中具有前景的藥物如下。

3.2 膽汁酸受體激動劑 目前應用于臨床的FXR的激動劑主要有INT7-747、奧貝膽酸和GW4064等。其中奧貝膽酸是鵝去氧膽酸的合成衍生物,也是最早被食品藥品監督管理局批準用于治療PBC患者的臨床藥物。臨床試驗[45]證明奧貝膽酸激活FXR后,可以使患者血清ALP、GGT和ALT的活性下降,顯著改善PBC患者的肝功能損傷。GW4064是一種選擇性非甾體FXR激動劑,其在小鼠體內以FXR依賴的方式降低CYP7A1和膽固醇12α羥化酶(sterol 12alpha-hydroxylase,CYP8B1)轉錄,并誘導小異二聚體伴侶受體和FGF15的表達控制膽汁酸的過度合成。研究發現,在短腸綜合征相關性肝病大鼠模型中中,經FXR激動劑GW4064干預后,肝臟FXR表達水平升高,其靶基因被激活,大鼠的肝臟組織學病變和ALT、AST活性均有改善,同時,肝組織、腸內容物、血清中膽汁酸成分恢復,且與對照組成分接近。與此相一致的是,CYP7A1、CYP8B1、CYP27A1的表達水平下調,最終通過維持膽汁酸穩態來逆轉肝損傷[46]。
INT-767(奧貝膽酸的衍生物)是TGR5和FXR的激動劑,其與TGR5的結合能力遠高于與FXR的結合能力。研究[47]顯示,INT-767通過促進碳酸氫鹽的分泌,同時可以通過誘導FGF15和小異二聚體伴侶受體的表達抑制膽汁酸的合成,以及通過抑制NF-κB調節免疫應答反應,有效降低膽汁酸對肝臟的毒性作用,最終改善肝功能損傷、肝臟炎癥以及膽管周圍纖維化病變 。目前INF-767作為膽汁淤積癥的治療藥物已經進入I期臨床試驗。
3.3 成纖維化生長因子19(FGF19)類似物 FGF19類似物FGF19-M70(NGM282),與野生型FGF19不同之處在于其有5位點氨基酸的缺失以及氨基端3個氨基酸的替換。在肝內外膽汁淤積阻塞性小鼠模型中,M70通過調節FGFR4信號,抑制肝臟CYP7A1的表達,從而降低肝內膽汁酸濃度以及血清肝酶,保護肝臟免受膽汁淤積的損害[48]。除此之外,其亦可以減輕非酒精性脂肪性肝炎小鼠肝損傷。鑒于其在膽汁淤積疾病治療中的作用,現有大量研究探索FGF19-M70是否也可以用于肝細胞癌的治療。另外,研究[49]證明,一種新的非致瘤的FGF19類似物FGF19-M52,通過抑制膽汁酸經典合成途徑中關鍵酶基因的表達,減少膽汁酸池中的循環量并將其轉變為更親水的形式,顯著降低肝損傷的生化指標,一定程度上抑制肝細胞增殖和炎癥基因的表達,使得FXR-/-小鼠免受膽汁酸誘導的自發性肝損傷。臨床上,NGM282一般用于對UDCA治療無效的患者,目前該藥已經進入Ⅱ期臨床試驗。研究[50]發現,與安慰劑組相比,NGM282能夠有效降低ALP、ALT、AST水平。
4 小結與展望
綜上所述,膽汁酸通過多受體、多信號、多途徑形成的復雜的分子調控網絡調節其自身代謝、炎癥反應、細胞毒性、細胞自噬等生物學過程,從而調節CLD的發生發展。另外,膽汁酸與腸道菌群的相互作用在CLD的發病進程中亦不可被忽視。目前雖有大量令人振奮的藥物研發和臨床使用成果,但在經濟性和高效性上仍有不足。對膽汁酸代謝在CLD中作用機制的研究,以及新而高效的藥物靶點和藥物的研發,將為臨床膽汁淤積患者的治療提供更全面、更科學有效的方案。
利益沖突聲明:所有作者均聲明不存在利益沖突。
作者貢獻聲明:李靜負責文獻收集,分析,撰寫;鄭葵陽負責修改文章;張蓓蓓負責擬定寫作思路,指導撰寫文章及最后定稿。

