金屬偽影對鼻咽癌放療危及器官自動勾畫的影響
宋威,鹿紅,馬珺,趙迪,王逸君,黃維,秦亮,于大海
江蘇省中醫院放療科,江蘇南京210029
前言
放療是非轉移性鼻咽癌首選的治療方法[1]。調強放療技術由于其高度適形的劑量分布和靶區外劑量的快速跌落,現已成為鼻咽癌最主要的治療手段[2]。準確勾畫靶區和危及器官(Organs-at-Risk,OAR)是調強放療成功實施的前提[3]。由于鼻咽癌靶區鄰近眾多對射線敏感且精細的解剖結構,放療醫師人工勾畫OAR 需要投入大量的時間和精力,面臨巨大的工作量和一致性差異[4]。近年來基于深度學習的自動勾畫方法為提升臨床OAR輪廓勾畫的準確性和工作效率提供了可能[5-6]。深度學習方法能夠學習大量樣本中蘊含的OAR共同的強度模式和多層次多尺度的特征。已有很多研究報道在頭頸部放療中,深度學習方法分割OAR 的性能優于傳統圖譜庫方法[7-9]。臨床治療中鼻咽癌放療患者安裝有不可移除的高密度牙齒修復物是常見的情形,在江蘇省中醫院,這類患者的比例約為20%。牙齒修復物所含金屬材料易引起射束硬化、散射等效應,在放療定位影像中產生明暗交替的條紋狀偽影,掩蓋鄰近解剖結構真實的CT 值,對基于深度學習的自動勾畫算法的分辨能力可能會產生不利影響,其影響程度尚不明確[10-12]。
本研究使用深度學習自動勾畫平臺AccuContour實現頭頸部多種OAR的自動分割,通過比較有無牙齒修復物偽影的鼻咽癌患者各器官輪廓的二維、三維相似性指標以及勾畫時間的差異,評估牙齒修復物金屬偽影對基于深度學習的自動勾畫算法臨床應用的影響。
1 材料與方法
1.1 患者選取
選取32 例在江蘇省中醫院接受調強放療的鼻咽癌患者。男性24例,女性8例;中位年齡53歲(33~81歲),其中16例放療前安裝有無法去除的口腔牙齒修復物。所有患者定位均采用仰臥位,使用頭頸肩熱塑膜固定,雙臂放置于身體兩側,在自由平靜呼吸狀態下使用飛利浦大孔徑CT(Philips Big bore,USA)行增強掃描,掃描范圍從頭頂至氣管分叉水平,掃描層厚為3 mm。
1.2 AccuContour自動勾畫平臺
本研究使用MANTEIA 公司的自動勾畫平臺AccuContour軟件(版本號1.1.3.374)實現鼻咽癌頭頸部OAR 的自動分割,其自動勾畫功能實現基于傳統算法與卷積神經網絡結合的深度學習模型,可以完成頭頸、胸部、腹部、盆腔部位超過60 種OAR 以及鼻咽癌、肝癌、肺癌、宮頸癌、直腸癌和食道癌6 種臨床靶區的自動勾畫,其頭頸部OAR 勾畫方式參考國際勾畫標準共識[13]。軟件運行工作站的處理器為i7-8700,主頻3.2 GHz,內存16 GB,配置顯卡為NVIDIA GeForce GTX 1060 6GB。
1.3 OAR勾畫
定位CT 圖像經治療網絡首先傳至瓦里安Eclipse 8.6 治療計劃系統(Varian Medical Systems,USA),由一位具有25年頭頸部腫瘤放療經驗的醫師參照前述的頭頸部OAR勾畫標準文獻[13],在CT影像上勾畫OAR,包括腦干、脊髓、左右視神經、視交叉、左右晶體、左右眼球、左右顳葉、垂體、左右腮腺、左右頜下腺、左右顳頜關節、下頜骨、口腔、喉、咽縮肌、甲狀腺、左右耳蝸和身體外輪廓。同時將所有患者的CT 圖像傳至MANTEIA 工作站,由AccuContour軟件自動勾畫相同的OAR。
1.4 評估方法
以人工勾畫的OAR 輪廓為基準,利用科室內部編寫的MATLAB 程序評估自動勾畫輪廓的準確性[14]。比較不同OAR 三維形狀相似性系數(Dice Similarity Coefficient, DSC)和豪斯多夫距離(Hausdorff Distance,HD),定義如下:
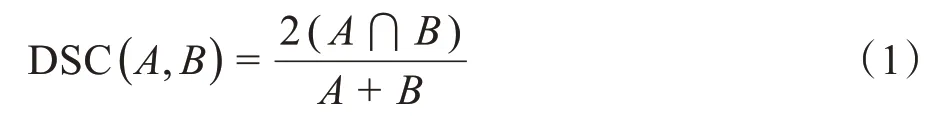
其中,A和B表示待評價的目標輪廓區域或基準輪廓區域。DSC 取值范圍為0~1,越接近1 表示兩輪廓的相似性越高。通常認為當DSC>0.7 時,兩輪廓重合較好[15]。
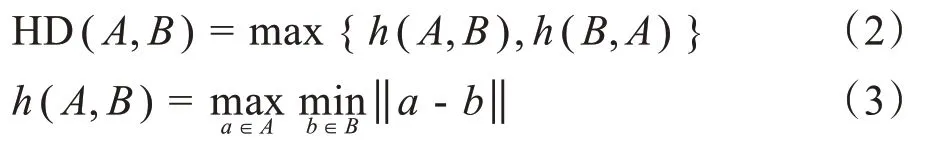
其中,A、B意義同上;a、b分別表示輪廓線A、B上的任意一點。HD 值越小表示兩輪廓線的最大歐式距離越小,相似性越高[16]。
此外,對于有牙齒修復物的患者,在偽影分布區域上下延伸2 cm范圍內,比較下頜骨和口腔的二維DSC和HD在有無金屬偽影橫斷面內的差異;同時記錄不同患者組人工勾畫和自動勾畫全部OAR所用時間。
1.5 統計學分析
使用SPSS 25.0軟件進行統計學分析。不同分組的變量若均服從正態分布則差異采用獨立樣本t檢驗,否則采用Mann-WhitneyU檢驗。參數值以平均值±標準差表示,以雙側P<0.05 為差異有統計學意義。
2 結果
如表1,腦干、脊髓、左右視神經、視交叉、左右晶體、左右眼球、左右顳葉、垂體、左右腮腺、左右頜下腺、左右顳頜關節、下頜骨、口腔、喉、咽縮肌、甲狀腺、左右耳蝸和身體外輪廓的三維DSC和HD在有無金屬偽影的患者組間均無顯著差異(P>0.05)。
表1 有無金屬偽影患者不同危及器官三維DSC和HD比較(± s)Tab.1 Comparison of three-dimensional Dice similarity coefficient(DSC)and Hausdorff distance(HD)of different OAR in patients with or without metal artifacts(Mean±SD)
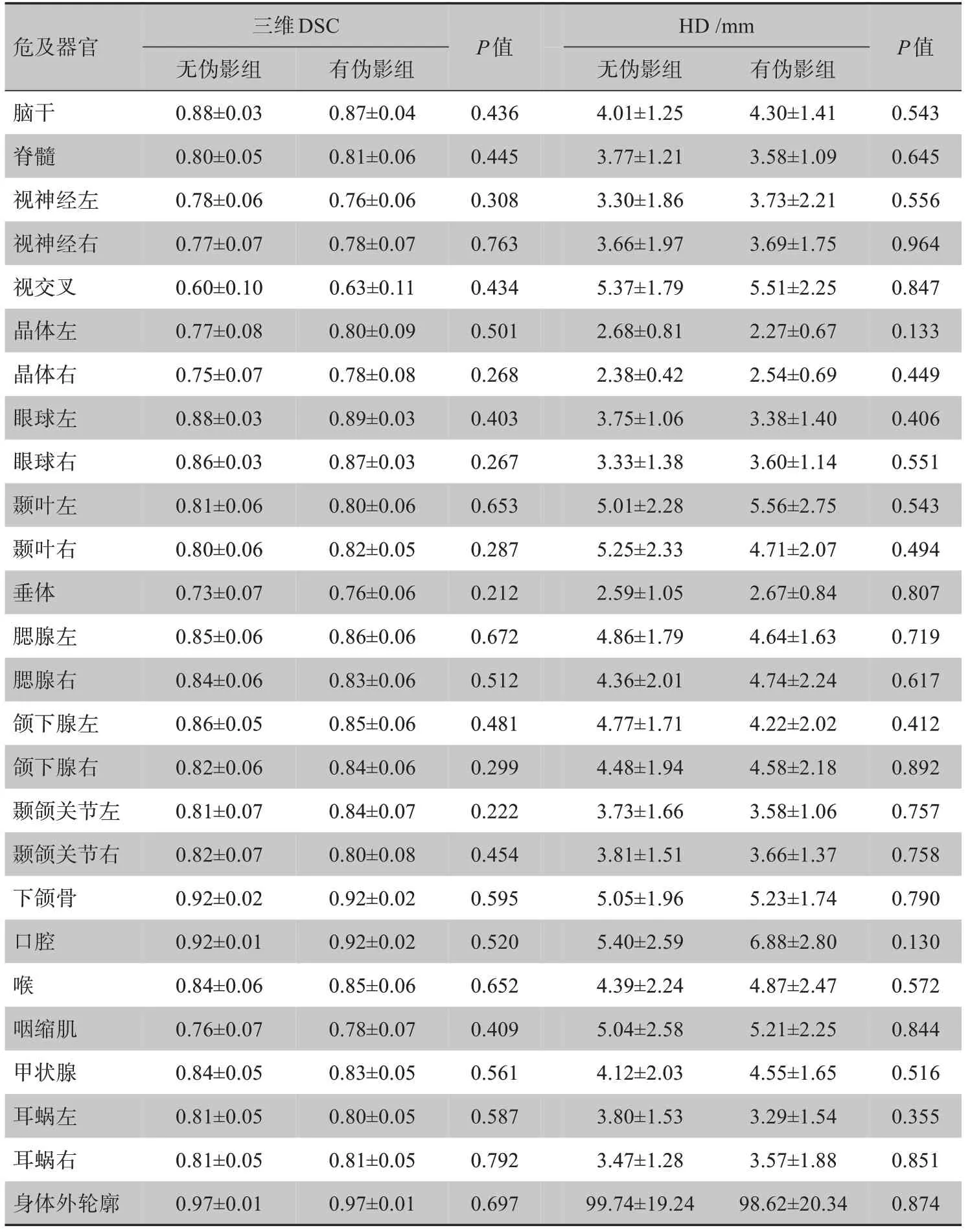
表1 有無金屬偽影患者不同危及器官三維DSC和HD比較(± s)Tab.1 Comparison of three-dimensional Dice similarity coefficient(DSC)and Hausdorff distance(HD)of different OAR in patients with or without metal artifacts(Mean±SD)
危及器官P值P值三維DSC無偽影組有偽影組HD/mm無偽影組有偽影組腦干脊髓視神經左視神經右視交叉晶體左晶體右眼球左眼球右顳葉左顳葉右垂體腮腺左腮腺右頜下腺左頜下腺右顳頜關節左顳頜關節右下頜骨口腔喉咽縮肌甲狀腺耳蝸左耳蝸右身體外輪廓0.436 0.445 0.308 0.763 0.434 0.501 0.268 0.403 0.267 0.653 0.287 0.212 0.672 0.512 0.481 0.299 0.222 0.454 0.595 0.520 0.652 0.409 0.561 0.587 0.792 0.697 0.88±0.03 0.80±0.05 0.78±0.06 0.77±0.07 0.60±0.10 0.77±0.08 0.75±0.07 0.88±0.03 0.86±0.03 0.81±0.06 0.80±0.06 0.73±0.07 0.85±0.06 0.84±0.06 0.86±0.05 0.82±0.06 0.81±0.07 0.82±0.07 0.92±0.02 0.92±0.01 0.84±0.06 0.76±0.07 0.84±0.05 0.81±0.05 0.81±0.05 0.97±0.01 0.87±0.04 0.81±0.06 0.76±0.06 0.78±0.07 0.63±0.11 0.80±0.09 0.78±0.08 0.89±0.03 0.87±0.03 0.80±0.06 0.82±0.05 0.76±0.06 0.86±0.06 0.83±0.06 0.85±0.06 0.84±0.06 0.84±0.07 0.80±0.08 0.92±0.02 0.92±0.02 0.85±0.06 0.78±0.07 0.83±0.05 0.80±0.05 0.81±0.05 0.97±0.01 4.01±1.25 3.77±1.21 3.30±1.86 3.66±1.97 5.37±1.79 2.68±0.81 2.38±0.42 3.75±1.06 3.33±1.38 5.01±2.28 5.25±2.33 2.59±1.05 4.86±1.79 4.36±2.01 4.77±1.71 4.48±1.94 3.73±1.66 3.81±1.51 5.05±1.96 5.40±2.59 4.39±2.24 5.04±2.58 4.12±2.03 3.80±1.53 3.47±1.28 99.74±19.24 4.30±1.41 3.58±1.09 3.73±2.21 3.69±1.75 5.51±2.25 2.27±0.67 2.54±0.69 3.38±1.40 3.60±1.14 5.56±2.75 4.71±2.07 2.67±0.84 4.64±1.63 4.74±2.24 4.22±2.02 4.58±2.18 3.58±1.06 3.66±1.37 5.23±1.74 6.88±2.80 4.87±2.47 5.21±2.25 4.55±1.65 3.29±1.54 3.57±1.88 98.62±20.34 0.543 0.645 0.556 0.964 0.847 0.133 0.449 0.406 0.551 0.543 0.494 0.807 0.719 0.617 0.412 0.892 0.757 0.758 0.790 0.130 0.572 0.844 0.516 0.355 0.851 0.874
如表2,對于有牙齒修復物的患者,下頜骨的二維DSC和HD值在有無金屬偽影的橫斷面內無顯著差異(P>0.05);而口腔的二維DSC和HD值均有顯著差異,無偽影層面的勾畫準確性優于有偽影層面(P=0.000)。
表2 有無金屬偽影橫斷面內下頜骨、口腔的二維DSC和HD比較(±s)Tab.2 Comparison of two-dimensional DSC and HD of oral cavity and mandibles on axial slices with or without metal artifacts(Mean±SD)
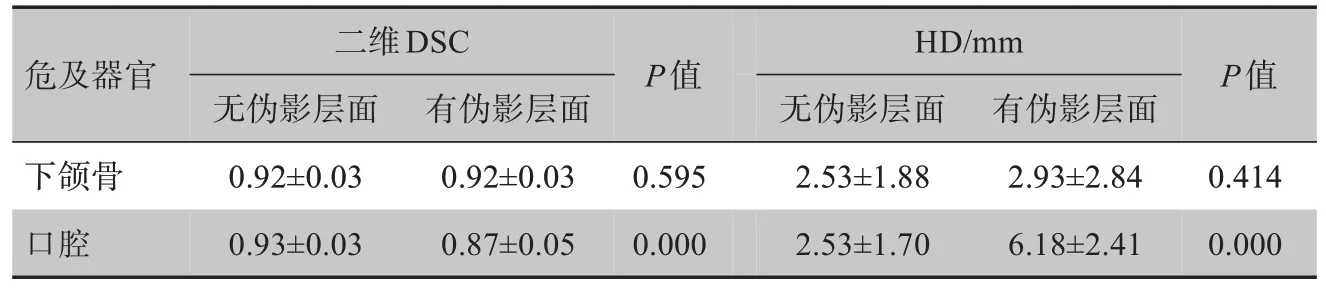
表2 有無金屬偽影橫斷面內下頜骨、口腔的二維DSC和HD比較(±s)Tab.2 Comparison of two-dimensional DSC and HD of oral cavity and mandibles on axial slices with or without metal artifacts(Mean±SD)
危及器官P值P值二維DSC無偽影層面有偽影層面HD/mm無偽影層面有偽影層面下頜骨口腔0.92±0.03 0.93±0.03 0.92±0.03 0.87±0.05 0.595 0.000 2.53±1.88 2.53±1.70 2.93±2.84 6.18±2.41 0.414 0.000
圖1顯示不同偽影分布范圍的CT 橫斷面內下頜骨、口腔自動勾畫和人工勾畫輪廓的差異。偽影越嚴重,自動勾畫的口腔輪廓局部偏離基準值越明顯。
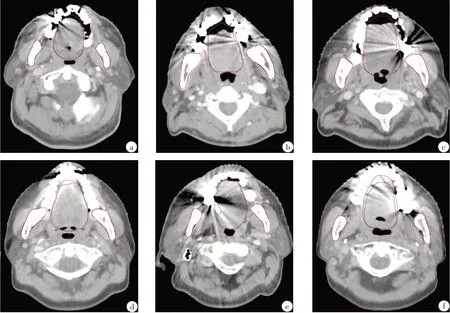
圖1 有金屬偽影的CT橫斷面內下頜骨、口腔人工勾畫和自動勾畫輪廓比較Fig.1 Comparison of the manual and automatic segmentation results on axial slices with metal artifacts
人工勾畫有無金屬偽影患者所有OAR的時間分別為(78.2±10.8)和(73.9±6.5)min(P=0.181),自動勾畫方法用時分別為(1.8±0.3)和(1.6±0.4)min(P=0.107),均無顯著差異,但自動勾畫的效率顯著優于人工勾畫方法(P=0.000)。所記錄自動勾畫用時不包括人工修改的時間。
3 討論
在臨床治療中,口腔安裝有金屬材料牙齒修復物的鼻咽癌患者占有相當的比例。這些植入物在放療患者的定位影像上易產生偽影,改變鄰近解剖結構的CT 值對基于深度學習方法的自動勾畫準確性的影響尚不明確。本研究顯示牙齒修復物偽影并未對鼻咽癌患者所有OAR 自動勾畫輪廓的三維DSC產生顯著影響。進一步分析定位圖像存在金屬偽影的鼻咽癌患者最接近偽影分布區域的下頜骨和口腔輪廓的二維DSC,發現自動勾畫的下頜骨輪廓在有無偽影的CT 斷層上都能夠保持較高的準確性;而在有偽影的CT斷層上口腔的二維DSC和HD較無偽影橫斷面有顯著下降,但其二維DSC 均值仍然超過0.85,只是在高密度偽影區域附近自動勾畫的口腔輪廓局部發生收縮而偏離了基準邊界,其引起的絕對體積差異相對于口腔總體積較小[(0.78±1.01)cm3vs(93.04±13.63)cm3]。而對體積較大的結構,三維DSC 對局部小體積的偏差并不敏感,同時三維HD 值也易受口腔起止層面定義不明確的影響,因此口腔的三維DSC 并未表現出顯著的差異[17-18]。綜合這些指標來看,牙齒修復物偽影對本研究采用的深度學習自動勾畫平臺分割準確性的影響有限,其偏差可能來源于偽影強度特征的復雜性和訓練集中有金屬偽影的樣本相對較少。同時口腔輪廓的局部偏差與偽影分布范圍和嚴重程度存在一定的關聯,對于偽影嚴重程度較低的患者這種影響相對更小。總體上該算法的準確性可以滿足臨床要求,絕大部分OAR的DSC 均值超過了0.75,HD 均值小于5 mm,與已有研究報道的結果相近[4,17-18]。所有OAR 中僅有視交叉的DSC 低于0.7,這與其體積較小且軟組織對比度較低有關[4]。此外人工勾畫方法根據CT值搜索人體外輪廓時會包含定位板結構,而自動勾畫方法未包括這部分結構從而導致HD 較大。考慮到本研究所使用的自動勾畫算法訓練數據來自外部多家醫院,與本單位鼻咽癌患者定位圖像質量和對OAR勾畫標準理解的差異會在一定程度上降低算法預測的性能。因此,通過使用本單位的臨床數據重新訓練算法并且增加有金屬偽影患者的樣本量,該平臺的勾畫準確性仍有進一步提升的空間。
此外,本研究采用的自動勾畫平臺表現出很高的工作效率,勾畫26種OAR的平均總耗時低于2 min。van der Veen等[17]將深度學習算法用于頭頸部腫瘤的OAR 勾畫,結果顯示自動勾畫和人工修改輪廓流程較完全人工勾畫節省了33%的時間。van Rooij 等[18]研究提示當自動勾畫的頭頸部OAR 輪廓DSC 達到0.7 后,對于絕大多數OAR,直接基于自動勾畫輪廓制定的計劃與根據人工勾畫結果制定的計劃相比未觀察到明顯的劑量學差異。對于自動勾畫準確性較高的OAR,只需要做少量必要的修改即能實現臨床可接受的計劃[19-20]。本研究中安裝有金屬牙齒修復物的鼻咽癌患者OAR自動勾畫總體表現出較高的準確性且偽影只影響到有限的層面,人工檢查和修改輪廓不會明顯增加自動勾畫流程的用時。相較于完全人工勾畫超過1 h 的工作量,自動勾畫方法依然能夠加速OAR 勾畫環節,提高臨床放療計劃設計的效率,因此基于深度學習的自動勾畫算法仍然適用于這類患者OAR的自動分割。此外為了提高劑量計算的準確性,對于偽影區域和金屬材料需要進行密度校正和使用擴增動態范圍的CT 值/相對電子密度轉換曲線[11-12]。在未來的研究,自動勾畫CT 偽影的算法應能夠進一步提高放療流程的自動化程度。
綜上所述,牙齒修復物偽影對基于深度學習的鼻咽癌放療OAR自動勾畫的準確性和工作效率影響有限,較人工勾畫方法仍然具備明顯優勢。