不同發酵條件對糙米酵素中植酸酶和GABA的影響
楊闖,邢志超,李境藝,李帥,于靖輝,王俊玲
吉林農業科技學院(吉林 132101)
發芽糙米是一種具有全營養概念及特殊營養價值的功能性主食或配料[1]。發芽糙米制備工藝研究是實現發芽糙米產業化的首要環節[2]。糙米酵素是以糙米為營養來源,加入一定量的蜂蜜、玉米胚油,利用酵母菌發酵制得的[3]。經過發酵后,其中所含有的γ-氨基丁酸(GABA)等生理活性成分含量均顯著提高。
植酸,因其含有6個磷酸基團,又被稱為肌醇六磷酸,是一種抗營養因子,具有很強的金屬螯合能力,與金屬反應容易產生不易溶解的鹽類[4]。植酸酶,是能將磷酸殘基從植酸上水解下來的一類酶的總稱[5],廣泛存在于植物、微生物、動物組織中,微生物中的細菌、酵母菌和霉菌都可以產生植酸酶[6]。植酸酶的使用可替代飼料中所添加的無機磷,從而可以緩解中國磷資源匱乏、磷供應不足的局面,其社會效應顯著[7]。
植酸酶和GABA是糙米酵素中的關鍵營養元素,因此,試驗以發芽糙米為原料,利用酵母菌發酵制備糙米酵素,以植酸酶酶活力和γ-氨基丁酸質量濃度為指標探究最佳發酵條件,為進一步提高糙米酵素中的營養成分及生產糙米酵素相關食品奠定基礎。
1 材料與方法
1.1 材料
馬鈴薯、糙米等(市售);安琪活性干酵母(市售);次氯酸鈉、氯化鈣、葡萄糖、硫酸鎂、磷酸氫二鉀、硫酸銨、氯化鈉、γ-氨基丁酸標準品、碳酸鈉、四硼酸鈉、苯酚、乙醇、瓊脂、蔗糖、磷酸二氫鉀、植酸鈣、鉬酸銨、釩酸銨、硝酸、乙酸等(均為分析純)。
1.2 儀器與設備
MLS-3750高壓蒸汽滅菌鍋(三洋電機株式會社);SW-CJ-2FD凈化工作臺(上海新苗醫療器械制造有限公司);UV-2700紫外分光光度計(日本島津公司);AL204-IC電子天平(梅特勒-托利多儀器上海有限公司);DK-V205三用恒溫水浴鍋(上海精宏實驗設備有限公司);HZQ-F160A高低溫恒溫振蕩培養箱(上海一恒科技有限公司);DHG-9240A電熱鼓風干燥箱(上海一恒科學儀器有限公司);HC-100T多功能粉碎機(河城工貿有限公司);GL-20G-Ⅱ高速離心機(上海安亭科學儀器廠)。
1.3 糙米的預處理
參照侯利娟等[8]的方法處理后,備用。
1.4 菌種的制備
將酵母菌接種到2%蔗糖溶液中,調節pH 4.5~5.0,于38 ℃水浴30 min,于恒溫搖床中培養過夜。第2天,將其接種至PDA平板培養基上培養過夜。第3天,培養基上生長出菌落后,篩選出長勢良好、活力旺盛、表面光滑有光澤的單菌落,接種于PDA液體培養基中,振蕩培養過夜即為可直接用于接種的酵母菌菌種。
1.5 植酸酶酶活力測定
無機磷標準曲線的繪制[9-10]:按需求精確稱取已烘至恒重的KH2PO4粉末,充分溶解,用容量瓶定容,制備成濃度50.0 mmol/L的KH2PO4溶液。將配制好的KH2PO4溶液按比例稀釋成25,12.5,6.25,3.125和1.5625 mmol/L不同梯度濃度。分別取0.1 mL不同梯度濃度的標準液,分別加入0.9 mL 0.25 mol/L的乙酸緩沖液,充分振蕩后,在37 ℃水浴鍋中放置5 min,依次加入2 mL 7.5 mmol/L的植酸鈣溶液,充分振蕩后,放置于37 ℃水浴鍋中反應30 min,向各個反應體系中分別加入2 mL提前配制好的釩鉬終止液,充分混勻,在波長415 nm處測定吸光度。繪制相應的無機磷標準曲線。
酶活性單位(U)定義為在37 ℃的條件下,每分鐘從0.005 mol/L的植酸鈣溶液中釋放出1 nmol無機磷所需要的酶量為1個酶活單位。
樣品中植酸酶酶活力的測定[11]:將所制得的樣品離心,取其上清液,按照表1反應順序進行反應,在波長415 nm處測定吸光度。將所測定的吸光度代入到所制得的方程中,同時結合所繪制的標準曲線,計算樣品中無機磷濃度,進而計算出樣品中植酸酶酶活力。
1.6 GABA的測定
1.6.1 GABA標準曲線的繪制
準確稱取GABA標準品,分別配制成0,0.1,0.2,0.3,0.4和0.5 mg/mL的標準品溶液。取1.0 mL不同質量濃度標準品溶液置于冰浴中,加入0.2 mL 1.0 mol/L碳酸鈉溶液,1.0 mL 0.01 mol/L四硼酸鈉緩沖液,終止反應。加入1.0 mL質量分數6%的苯酚溶液,5.0 mL質量分數7.5%的次氯酸鈉溶液,充分振蕩混勻后放置于沸水浴中反應10 min,為防止試管破碎,先用流水冷卻后,放置于冰水浴中冷卻20 min。等待試管中的反應體系出現藍綠色后加入2.0 mL 60%乙醇,充分振蕩混勻后在波長640 nm處測定吸光度。繪制相應的GABA標準曲線。
1.6.2 樣品中GABA的測定
參考Berthelot比色法[12],并做出一些改進,從而對GABA質量濃度進行測定,將樣品離心,取其上清液,按照表2反應順序進行反應,在波長640 nm處測定吸光度。將所測定的吸光度代入到所制得的方程中,同時結合所繪制的標準曲線,計算樣品中GABA質量濃度。空白管中不含GABA,操作同樣品管。

表2 GABA含量測定反應流程
2 結果與分析
2.1 無機磷標準曲線的繪制
以無機磷濃度作為橫坐標,吸光度作為縱坐標,繪制相應的無機磷標準曲線(見圖1),得到方程y=0.04x-0.0233,其相關系數R2=0.9974。
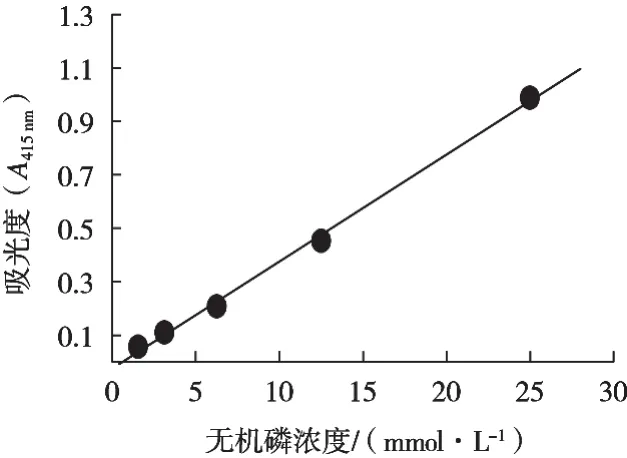
圖1 無機磷標準曲線
2.2 GABA標準曲線的繪制
繪制GABA的標準曲線(見圖2),其中橫坐標為GABA質量濃度,縱坐標為吸光度(A),得到方程y=1.6916x+0.0339,其相關系數R2=0.9959。
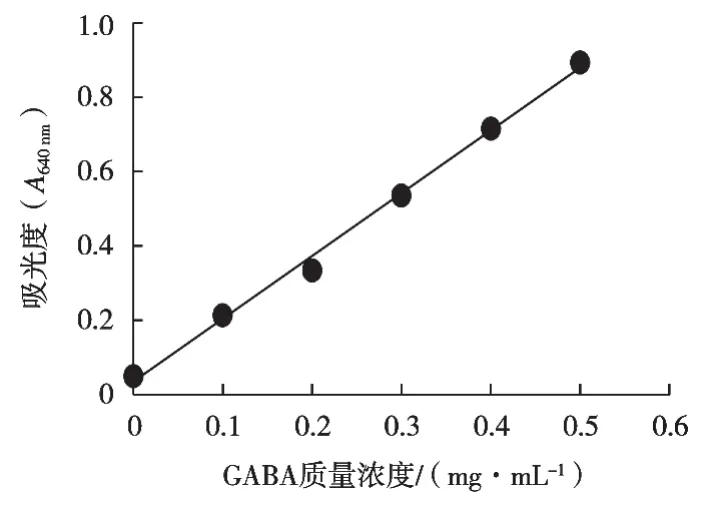
圖2 GABA標準曲線
2.3 植酸酶單因素試驗結果與分析
2.3.1 培養溫度對植酸酶的影響
從25 ℃開始依次選取4個不同培養溫度,在糙米培養基中接種3%酵母菌種,在120 r/min條件下發酵6 h,每個條件做3次平行,分別測定其植酸酶酶活力。
分析圖3可得:植酸酶酶活力在25~35 ℃范圍內逐漸增加,植酸酶酶活力的峰值點是溫度達到35 ℃時,此時的吸光度為0.216,植酸酶酶活力為19.98 U/mL。溫度高于35 ℃,植酸酶酶活力逐漸下降,適宜的溫度是增加營養物質轉化合成的必要條件,太高或者太低的溫度均會使酶活受到影響。所以正交試驗選取培養溫度30,35和40 ℃這3個水平。
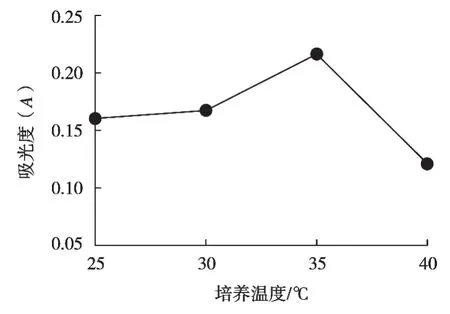
圖3 培養溫度對植酸酶的影響
李海燕等[13]通過黑曲霉植酸酶發酵工藝優化研究發現,黑曲霉發酵產植酸酶的最適發酵溫度為30 ℃,此時植酸酶酶活最高為19.02 U。若培養溫度與菌體的適宜溫度相差較大,都會對菌體的生長代謝產生影響。出現此種情況,主要是因為菌種不同造成的。
楊燕凌等[14]通過對Aspergullus nigerFZ41產植酸酶菌株的篩選及其產酶條件的研究發現,從20 ℃開始,依次遞增5 ℃的5個發酵條件中,植酸酶酶活在30℃時達到峰值,在20 ℃時達到最低,在25 ℃和35 ℃時都有所下降,因此得出最佳發酵溫度為30 ℃。出現此種情況,推測原因可能是所使用菌種有所差異。
2.3.2 培養時間對植酸酶的影響
從6 h開始依次選取5個不同培養時間,在糙米培養基中接種3%酵母菌種,在30 ℃、120 r/min條件下分別發酵不同的時間,每個條件做3次平行,分別測定其植酸酶酶活力。
分析圖4可得:培養時間在6~8 h范圍內,植酸酶酶活力隨著培養時間增加而增加。植酸酶酶活力在培養時間8 h時達到峰值,此時的吸光度為0.393,植酸酶酶活力為34.73 U/mL。培養時間大于8 h,隨著培養時間增加而下降,分析其原因有可能是培養時間越長,培養條件越不適合于菌體生長。另外產物的合成主要在酵母菌生長的穩定期,培養時間越長,酵母菌可能進入衰亡期。因此正交試驗中培養時間選取6,8和10 h這三水平。
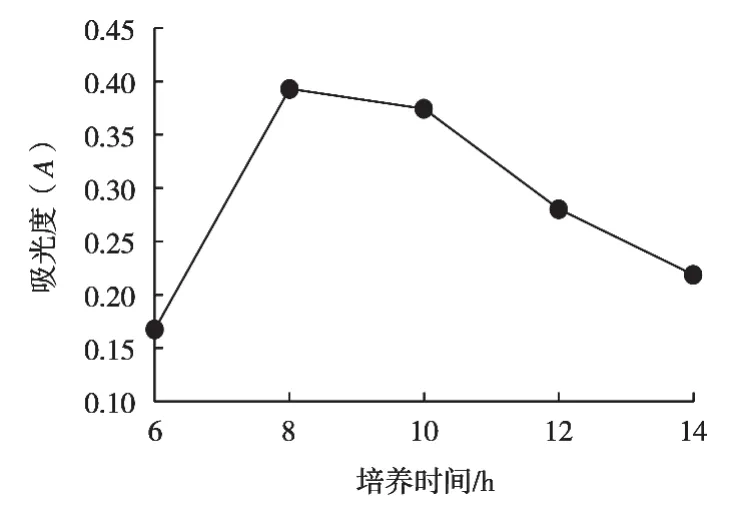
圖4 培養時間對植酸酶的影響
何錫杲[15]研究不同發酵條件對植酸酶基因工程菌E-22產植酸酶的影響,結果發現接種時間12~48 h時,所得植酸酶酶活力雖然有起伏但相差不大,接種時間36 h左右植酸酶酶活力最高。出現這種情況的原因推測是其所用菌種與試驗不同,不同菌種的最適生長條件不同,所以造成試驗結果不同。
田運佳[7]通過對植酸酶生產過程中主要影響因素的研究發現:培養時間16~24 h時,植酸酶酶活力呈現先上升后下降趨勢,培養時間20 h時發酵液植酸酶酶活力達到峰值。
2.3.3 接種量對植酸酶的影響
在糙米培養基中接種5個不同接種量,將未接種菌種的培養基作為空白對照組。在30 ℃、120 r/min條件下發酵6 h,每個條件做3次平行,分別測定其植酸酶酶活力。
分析圖5可得:接種量0~4%范圍內,植酸酶酶活力隨著接種量增加而增加。植酸酶酶活力達到峰值時的酵母菌接種量為4%,此時的吸光度為0.247,植酸酶酶活力為22.50 U/mL。隨著接種量繼續增加,植酸酶酶活力下降,分析其原因可能是隨著接種量增加,酵母菌的菌體密度增大,導致培養基濃度達不到適用于菌體生長的最佳濃度,轉化效率降低,從而導致發酵產物的產量降低。因此在正交試驗中接種量選取3%,4%和5%這三水平。
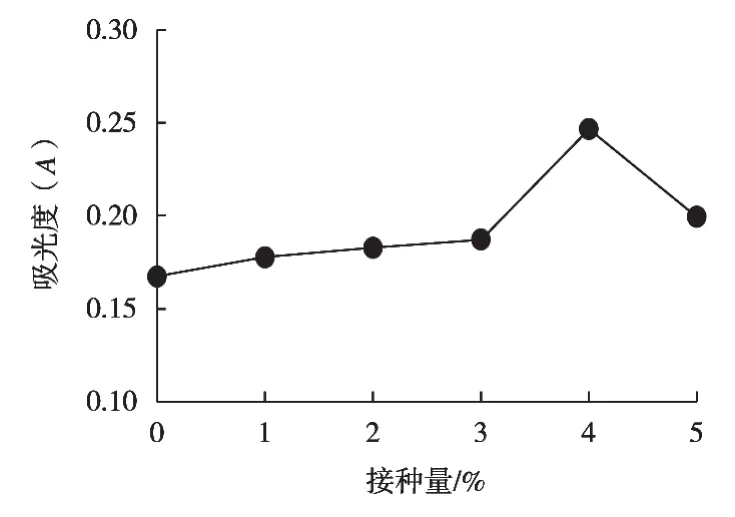
圖5 接種量對植酸酶的影響
趙海霞等[16]通過植酸酶基因工程酵母PP-NP~m-8培養條件研究發現,接種量3%~5%時,酵母不僅生長較好且接種量3%時培養液中酶含量最高,故接種量3%最佳。與試驗結果不同,可能是使用菌種與其不同。
劉雙赫等[17]通過對醋糟固態發酵產植酸酶工藝的研究發現:植酸酶酶活力隨接種量增加而增加,接種量4%時,酶活達到最大值,為2.4 U/mL,接種量大于4%后,酶活隨著接種量增加而降低,因此最佳接種量為4%。
2.4 GABA單因素試驗結果與分析
2.4.1 培養溫度對GABA的影響
從25 ℃開始依次選取4個不同的溫度條件,在糙米培養基中接種3%酵母菌種,在120 r/min條件下發酵6 h,每個條件做3次平行,分別測定其GABA質量濃度。
分析圖6可得:培養溫度25~30 ℃時,GABA質量濃度隨著溫度升高而增加。GABA產量最高時所對應的培養溫度為30 ℃,此時的吸光度為0.611,GABA含量為0.341 mg/mL。之后隨著溫度升高,GABA含量開始逐漸下降,太高或者太低的溫度都會使GABA含量受到影響。所以正交試驗選取培養溫度25,30和35 ℃這3個水平。
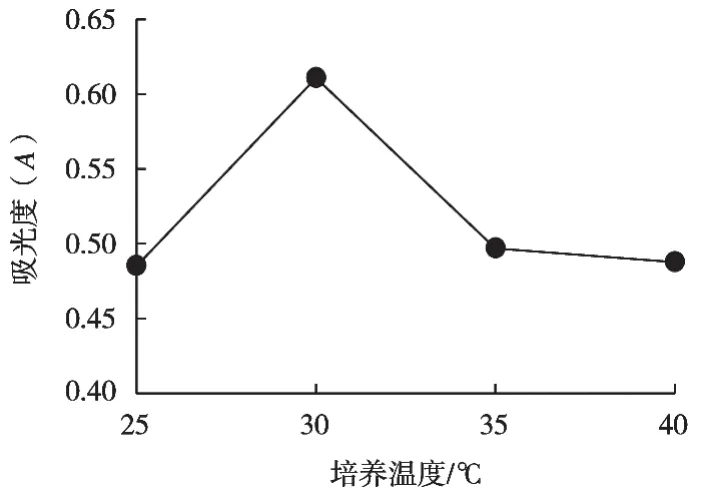
圖6 培養溫度對GABA的影響
雷恒[18]在高產GABA的紅曲菌種選育及發酵工藝優化研究中發現,在固態發酵條件下,GABA含量最高時,培養溫度為30 ℃。之后隨著溫度升高,GABA產量降低,溫度越高GABA產量下降越明顯。可能是高溫對微生物體內生物活性物質產生影響的緣故。
朱曉立等[19]在乳酸乳球菌發酵生產GABA的條件優化的研究中發現,乳酸乳桿菌在26,28,30,32,34和36 ℃培養溫度中,最佳培養溫度為30 ℃,GABA產量可達8.31 g/L。這表示GDA酶的適宜溫度為30℃,若培養溫度與GAD酶的適宜溫度相差較大,會導致GAD酶活力下降。
2.4.2 培養時間對GABA的影響
在糙米培養基中接種3%酵母菌種,在30 ℃、120 r/min條件下發酵6,8,10,12和14 h,每個條件做3次平行,分別測定其GABA質量濃度。
分析圖7可得:在一定范圍內GABA質量濃度隨培養時間增加而增加。培養時間8 h時,GABA質量濃度達到最大值,此時的吸光度為0.494,植酸酶酶活力為0.272 mg/mL。隨著培養時間繼續增加,植酸酶酶活力下降,分析其原因可能是培養時間越長,培養條件越不適合于菌體生長。另外產物的合成主要在酵母菌生長的穩定期,培養時間越長,酵母菌可能進入衰亡期。因此正交試驗中培養時間選取6,8和10 h這三水平。
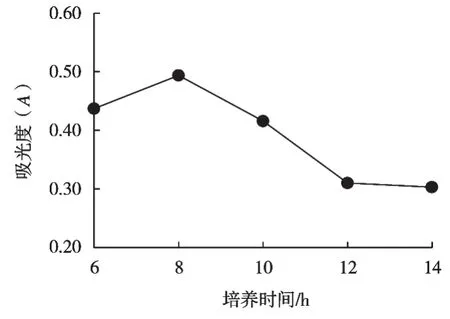
圖7 培養時間對GABA的影響
上官文菲等[20]在響應面法優化發酵乳桿菌產GABA的培養條件研究中發現,乳桿菌菌種SD2112在48,60,72,84和96 h的發酵時間中,最佳發酵時間為72 h,發酵時間>72 h后,GABA產量趨于平緩,可能是由于發酵后期菌體進入穩定生長期,需將培養基中的底物緩慢轉化。與試驗結果不同,可能是因為菌種不同的影響。
2.4.3 接種量對GABA的影響
在糙米培養基中接種5個不同酵母菌種,將未接種菌種的培養基作為空白對照組。在30 ℃、120 r/min條件下發酵6 h,每個條件做3次平行,分別測定其GABA含量。
分析圖8可得:在接種量0~2%范圍內,GABA質量濃度隨著接種量增加而增加。GABA質量濃度達到最大值時,對應的接種量為2%,此時的吸光度為0.574,植酸酶酶活力為0.319 mg/mL。隨著接種量繼續增加,吸光度下降,分析其原因可能是隨著接種量增大,酵母菌大量繁殖,隨著發酵進行,代謝合成受阻,發酵產物生成量逐漸減少。因此在正交試驗中接種量選取1%,2%和3%這三水平。
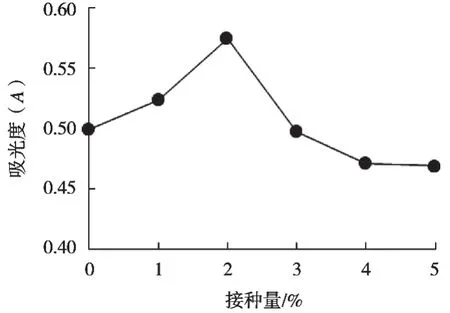
圖8 接種量對GABA的影響
2.5 正交試驗結果與分析
2.5.1 植酸酶正交試驗結果與分析
在單因素試驗的基礎上,進行L9(33)正交試驗,其因素與水平如表3所示。

表3 因素水平表
由正交試驗結果分析,RA>RC>RB,由此可得對植酸酶影響大小依次是:培養溫度>接種量>培養時間。最優方案為A2B3C1,即在糙米培養基中接種3%酵母菌菌種,在35 ℃下培養10 h,此時植酸酶的吸光度為0.424,酶活力為37.28 U/mL。

表4 L9(33)正交試驗結果
2.5.2 GABA正交試驗結果與分析
在單因素試驗基礎上,進行L9(33)正交試驗,其因素水平表如表5所示。

表5 因素水平表
由正交試驗結果分析,RC>RA>RB,由此可得對GABA影響大小依次是:接種量>培養溫度>培養時間。最優方案為A2B2C2,即在糙米培養基中接種2%酵母菌菌種,在30 ℃下培養8 h,GABA質量濃度最高,為0.315 mg/mL,此時的吸光度為0.567。
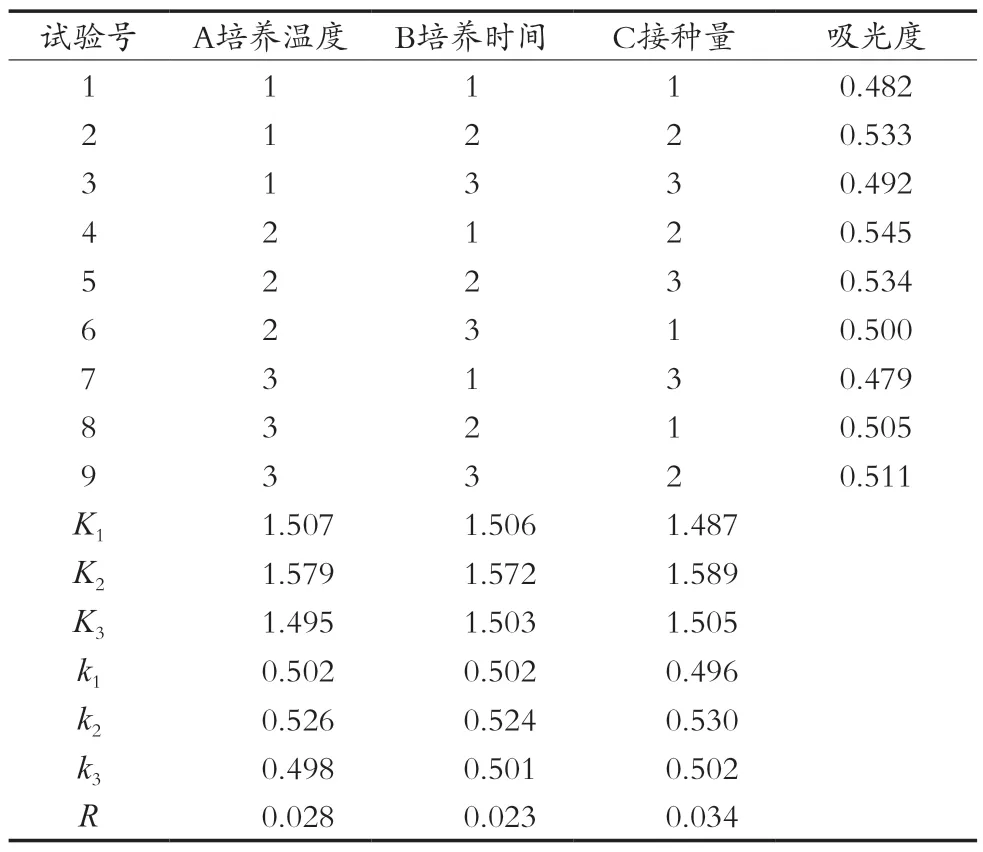
表6 L9(33)正交試驗結果
3 結論
通過浸泡和厭氧處理的方法,促使糙米發芽,以提高糙米中植酸酶酶活力和GABA質量濃度,利用酵母菌發酵制備糙米酵素。在試驗過程中,重點研究不同培養溫度、培養時間和接種量對發酵中植酸酶酶活力和GABA質量濃度的影響。
由正交試驗可得:培養溫度35 ℃、培養時間10 h、接種量3%時,植酸酶活力最高,可達37.28 U/mL。培養溫度30 ℃、培養時間8 h、接種量2%時,GABA質量濃度最高,可達0.315 mg/mL。

