摻雜Ag+的二氧化鈦快速處理低質量濃度氨氮廢水的研究
黃海威,劉世泳,梁斌昊,梁劍清,林潔麗
(佛山科學技術學院 化學工程系,廣東 佛山 528000)
氨氮在水體中以NH3和NH4+兩種形式存在,其含量與水體的溫度和pH等有關。水體呈酸性時,主要以NH4+形式存在,堿性時主要以NH3形式存在[1]。除了自然界的有機物緩慢分解外,氨氮廢水主要源于生活和工業活動。氨氮廢水不僅腐蝕設備、對水體造成嚴重的富營養化影響,還危害人體健康。處理氨氮廢水的方法很多,如生物法、化學法、高級氧化技術等。高級氧化包括光電氧化、臭氧氧化和光催化氧化等,其中,光催化氧化的成本最低[2]。本研究利用光催化氧化技術,探究不同光照時間下摻雜銀離子的二氧化鈦對氨氮廢水的處理效果。
1 實驗
1.1 試劑和儀器
實驗試劑主要有氯化銨(NH4Cl)、二氧化鈦(TiO2)和硝酸銀(AgNO3),均為分析純。實驗儀器主要包括自制的攪拌裝置、紫外線(Ultraviolet,UⅤ)光源(有用功率 7 W,波長265 nm)、離心機、曝氣裝置、循環泵、氨氮檢測儀(5B-3C-Ⅴ8,北京連華永興科技發展有限公司)等。
1.2 實驗方法
在光催化劑TiO2中摻雜Ag+能通過捕捉導帶中的電子催化活性中心[3],更容易產生羥基自由基和活性氧離子,加強催化氧化作用。在攪拌裝置中安裝6支UⅤ燈管,連接曝氣裝置及循環泵。先倒入15 L純凈水,再加入TiO2和AgNO3,打開曝氣裝置和循環泵,曝氣量設置為0.25 m3/h。曝氣使水體與空氣充分接觸,促進空氣中氧在水體中的溶解和快速傳質,增大溶液中的羥基自由基數量,使催化劑、自由基和氨氮充分接觸。循環泵使水體循環流動,形成渦流,有利于氧氣傳質,使催化劑表面的氧氣得到迅速補充。再打開UⅤ燈光照30 min,倒入1.78 g NH4Cl試劑配制成氨氮廢水,未添加任何酸堿,經檢測pH為7.5,計算得到氨氮廢水的初始質量濃度為40.30 mg/L。充分混合后,開始計時取樣。將樣品裝入離心管,放入離心機離心30 s,再倒入比色皿,放入氨氮檢測儀測其反應后的氨氮質量濃度,計算氨氮降解率。通過改變光照時間(0~6.0 h)和光催化劑TiO2與AgNO3的質量,測試氨氮質量濃度的變化。因選擇50∶1的相同質量比效果最佳[4-5],本實驗控制質量比相同,5組不同的質量比分別為TiO2∶AgNO3=100 mg∶2 mg、150 mg∶3 mg、300 mg∶6 mg、1 500 mg∶30 mg、3 000 mg∶60 mg。在每一組實驗的不同光照時間下,均取多個樣品同時測試反應后的氨氮質量濃度,取其平均值作為結果,計算氨氮降解率。
1.3 實驗結果
保持TiO2與AgNO3的質量比不變,選擇不同的具體質量,氨氮質量濃度和降解率隨光照反應時間的變化分別如表1和圖1所示。
從表1數據可知,反應時間在10 min時氨氮的質量濃度下降很明顯,這是因為反應前對摻雜相的TiO2進行紫外照射后,光催化劑處在較活躍的催化活性狀態,表面提前產生光生空穴和與其相匹配的光生電子,進而產生了大量羥基自由基,遇到氨氮廢水能迅速氧化,使其降解率在短時間內升高,高于30%。
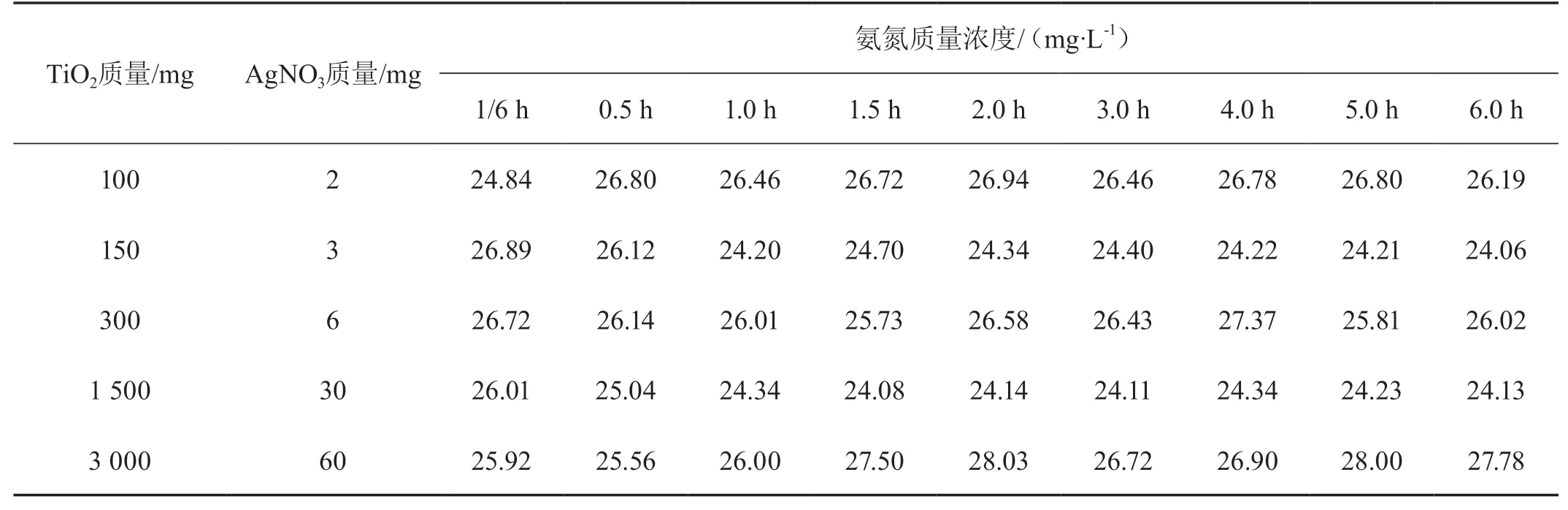
表1 不同TiO2和AgNO3用量下氨氮質量濃度隨光照時間變化的實驗數據
觀察圖1的曲線發現,反應時間持續到1.0 h時,氨氮繼續被降解,但10~30 min的降解速度比30~60 min快。在反應1.0 h之后降解率產生了較大波動,出現沒有升高反倒下降的現象。這說明當反應時間達到1.0 h時,氨氮幾乎已被完全氧化,突出了快速反應的特點。比較不同質量比催化劑下的實驗結果發現,氨氮的降解率受催化劑質量比的影響也是明顯的。當催化劑比較少(TiO2∶AgNO3=100 mg∶2 mg)時,即便在1.0 h前,降解率也在波動,說明催化劑嚴重不足;當增加1.5倍時,相同反應時間對應的降解率明顯提高,但隨時間變化的波動較大;當增加3.0倍時,降解率不如第2種情形,但也是波動的;當增加15.0倍時,降解率不但升高,而且1.0 h后隨時間的變化不大,趨于飽和;再增加時,降解率開始下降,30 min時最大,后面隨時間的變化與催化劑量嚴重不足的第1種情形一樣波動較大。因此,本實驗條件下選擇催化劑質量比為TiO2∶AgNO3=1 500 mg∶30 mg時,相當于投加量為0.1 g/L,氨氮的降解率是最理想的,并且能在 1.0 h時達到最佳值。
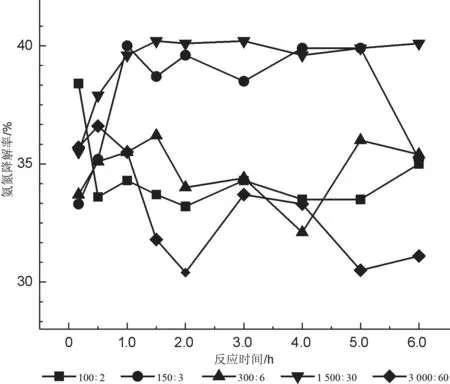
圖1 不同質量比催化劑下氨氮降解率隨光照時間的變化
2 結語
先用紫外光和Ag+激活光催化劑TiO2,再與氨氮廢水混合進行光催化反應降解氨氮,實驗結果發現,當氨氮廢水初始質量濃度為40.30 mg/L、TiO2投加量為0.1 g/L時,在短時間內達到降解效果最大化,雖然降解率低于45%,但相比于需要更多反應時間和更大投加量的研究結果,提供了能節省反應時間、減少光資源和催化劑使用量的實驗方案。

