膿毒癥患兒急性期的靜息能量代謝研究
羅蘭, 劉萍萍, 方思思
危重癥兒童細胞炎癥因子、急性期反應物、器官衰竭和能量消耗之間的關系尚不清楚[1-3]。其中膿毒癥對宿主機體的打擊除了表現為炎癥反應對機體各組織、器官的損害,且出現能量代謝功能和所謂特殊代謝底物的失衡,即能量代謝的紊亂。膿毒癥患者能量代謝嚴重紊亂,主要表現為蛋白質分解、糖原異生和脂肪動員增強,這可能與膿毒癥引起機體產生炎癥介質、激素分泌及泛素-蛋白酶體途徑異常有關。膿毒癥患兒在機體應激狀態下,炎癥介質的大量釋放,同時兒茶酚胺、糖皮質激素及胰高血糖素增加,據報道,白細胞介素-6(interleukin 6,IL-6)與糖皮質激素協同刺激急性期反應物[4]的產生,急性期蛋白如C反應蛋白(C-reactive protein,CRP)、纖維蛋白原等蛋白含量升高,這與血清白蛋白、甲狀腺運轉蛋白和轉鐵蛋白等代謝性指標下降有關。因此炎癥介質變化僅僅是患兒應激反應時紊亂代謝的一部分。本研究的目的是明確膿毒癥患兒代謝特點,并評估膿毒癥患兒的靜息能量消耗(resting energy expenditure,REE)及炎癥介質之間的關系。
1 對象與方法
1.1 研究對象 選擇2017年12月至2019年6月湖南省兒童醫院PICU收治的膿毒癥患兒178例為研究對象,其中男107例,女71例;平均年齡(2.32±2.20)歲;平均身高(84.76±21.24)cm;平均體質量(11.12±4.76)kg。178例膿毒癥患兒中,膿毒癥104例,嚴重膿毒癥53例,膿毒癥休克21例。死亡14例。
1.2 診斷標準 參照膿毒癥相關概念診斷[5]。
1.3 納入標準 (1)符合膿毒癥的診斷標準;(2)年齡28 d至16周歲;(3)研究經本院醫學倫理委員會批準,患兒家長知情同意。
1.4 排除標準 (1)監測時肛溫>38.5 ℃;(2)機械通氣患兒吸入氣中的氧濃度分數(fraction of inspiration oxygen,FiO2)>60%;(3)通過觀察吸氣潮氣量和呼氣潮氣量,呼吸機管道漏氣>10%;(4)腎衰竭需透析者及正在行血液透析者;(5)合并糖尿病、甲狀腺功能亢進、甲狀腺功能減退等代謝性疾病;(6)不足72 h因轉科、出院、放棄治療或死亡患兒;(7)血流動力學不穩定的患兒,在測量前2 h內需要頻繁調整血管活性藥物者;(8)呼吸狀態不穩定,需要頻繁調節FiO2或機械通氣條件者;(9)腦死亡患兒。
1.5 觀察指標 血樣檢測及能量代謝均在入院后72 h內完成。(1)監測患兒機械通氣時間、PICU住院時間、死亡率。(2)監測患兒降鈣素原(procalcitonin,PCT)、CRP、IL-6。(3)REE測定:采用間接測熱法進行REE測定,儀器采用美國Med公司生產的代謝車,測定條件:至少餐后2 h(腸內營養連續輸注、腸外營養者除外)或醫源性操作后2 h進行;代謝車開機預熱30 min后氣體校正至定標通過;連續測定15 min,得出平均每分鐘氧耗量(oxygen consumption,VO2)和二氧化碳呼出量(carbon dioxide production,VCO2),REE取平均值作為此次測定值[6]。利用Schofield-HTWT[7]公式計算REE預測值,通過REE/REE預測值的比值來確定能量消耗模式。>1.1為高代謝模式、0.9~1.1為正常代謝模式、<0.9為低代謝模式。呼吸商是指一定時間內VCO2與VO2的比值。
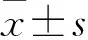
2 結果
2.1 一般情況 機械通氣1~30 d,平均(6.7±1.2)d;PICU住院時間1~41 d,平均(10.0±1.6)d。VO2:86~231 mL/(min·m2),平均(158.5±28.0)mL/(min·m2);VCO2:9.8~201.0 mL/(min·m2),平均(125.4±27.0)mL/(min·m2)。呼吸商為0.63~0.97,平均0.79±0.01。
2.2 實際REE與預測REE比較 178例膿毒癥患兒實際REE值為(640.45±253.49)kcal/d,Schofield-HTWT公式預測REE值為(683.52±228.46)kcal/d,兩者比較差異無統計學意義(t=1.946,P=0.054)。
2.3 不同膿毒癥類型間REE實測值比較 3種不同膿毒癥類型間的實際REE值比較差異無統計學意義(F=1.588,P=0.231),見表1。178例膿毒癥患兒中,低代謝模式88例(49.4%),正常代謝模式71例(39.9%),高代謝模式19例(10.7%),3組比較差異無統計學意義(H=1.212,P=0.545),見表2。
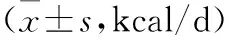
表1 不同膿毒癥類型間REE實測值比較
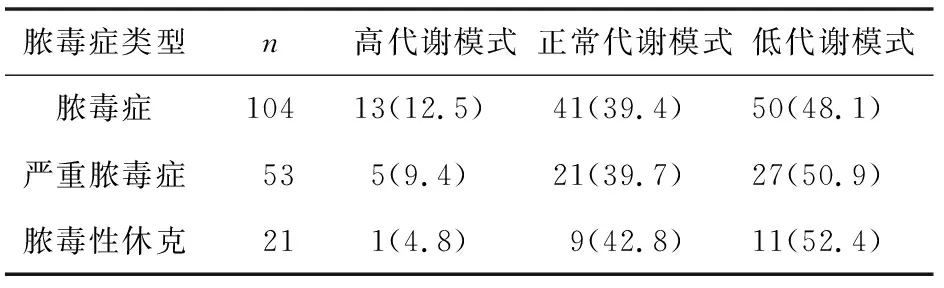
表2 不同類型膿毒癥患兒代謝模式比較[n(%)]
2.4 不同代謝模式患兒炎癥因子、代謝參數、死亡率的比較 見表3。不同代謝模式患兒VCO2、VO2比較差異有統計學意義(P<0.001);不同代謝模式患兒CRP、PCT、IL-6比較差異無統計學意義(P>0.05);不同代謝模式患兒死亡率比較差異無統計學意義(P>0.05)。
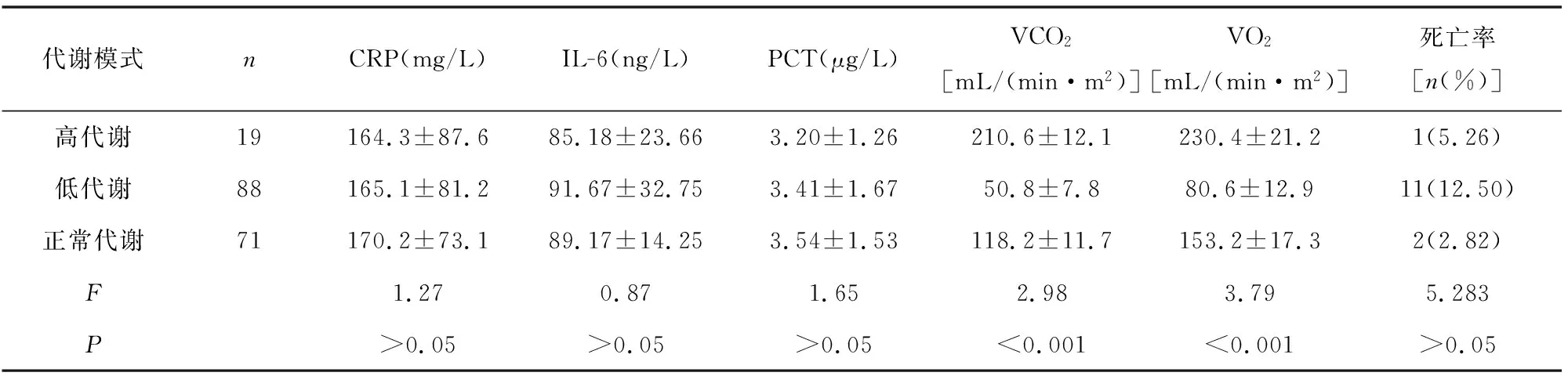
表3 不同代謝模式患兒炎癥因子、代謝參數、死亡率的比較
3 討論
臨床上通常以測定REE評估患者的能量代謝。膿毒癥患兒因處于特殊的病理生理狀態,需要對其REE進行全面準確的評估。目前國內外對兒童,尤其是危重癥患兒能量評估研究較少。以往研究表明,兒童在危重疾病期間不會出現高代謝,能量消耗接近甚至低于預測的基礎代謝率[8]。既往的一些研究表明對危重癥患兒的能量代謝進行臨床研究,結論是這些孩子的熱卡需求是不可預測的,具有個體差異,主要由疾病種類、年齡、以前的營養狀況和營養治療的種類(特別是腸外營養)多因素決定。因此,危重癥患兒熱量的需求需個體化評估和使用相適應的測量技術,美國腸外腸內營養學會建議,應盡可能利用間接測熱法指導患者能量供給[9]。由于其準確性,便攜性,舒適及安全性,即使在危重癥患者同樣適用[10]。
Schofield-HTWT公式作為預測兒童基礎能量代謝率的公式之一,認為其最接近于間接能量實測值。故本研究我們選用此公式預測REE值,與實際測量的REE作比較。發現Schofield-HTWT公式接近實測值,具有較好的相關性。目前不同性別、年齡、體質量對REE是否有影響尚無統一定論,尤其在兒童中研究的相對較少。Buchholz等[11]的研究顯示男性比女性的體質量指數、去脂肪體質量和靜息代謝率更高,但當對去脂肪體質量進行校正之后,不同性別間的靜息代謝率差異消失。李雪華等[12]對ICU重癥患兒進行REE測定,發現REE與年齡變化有關,年齡越大,REE越高。而Góes等[13]研究發現,隨著年齡的增長,危重癥患者REE有下降的趨勢,考慮衰老可能導致某些有助于能量代謝的器官質量下降。體質量與低代謝模式的存在獨立相關。危重癥患者體質量指數越高,其REE是降低的。本研究未進行性別、年齡、身高及體質量相關因素與REE的研究,因為參與研究患兒的年齡、身高及體質量的跨度較大,且未進行相應的校正,有待于今后的進一步研究。
本研究中按照膿毒癥類型(膿毒癥、嚴重膿毒癥、膿毒癥休克)將患兒進行分組比較REE,并沒有統計學差異,但發現急性期的膿毒癥患兒大部分處于低代謝模式,而高代謝模式僅有一小部分。這與既往的一些研究結果相似:紀健等[14]對機械通氣的危重癥患兒代謝狀態進行間接側熱法評估,發現大部分患兒以低代謝為主;Framson等[15]應用代謝車測量44例危重病患兒,發現危重病兒童的高代謝狀態并不明顯;Feferbaum等[16]對于NICU的19例膿毒癥新生兒進行能量監測,發現這些新生兒在病程急性期其REE是下降的。推測膿毒癥急性期的低代謝狀態可能與病情危重時機體出于對臟器的保護,多處于休眠狀態,減少了能量的消耗有關[17],而患兒使用鎮靜藥物,自主活動減少、機械通氣減少呼吸做功,也會導致機體能量消耗下降[18]。
本研究發現影響REE的因素為VCO2與VO2,而呼吸商是一定時間內VCO2與VO2比值。因此低代謝模式和低呼吸商存在關系。研究對象的呼吸商平均值為0.79±0.01,低于正常人呼吸商0.85,說明膿毒癥危重患兒急性期首先優先脂肪和酮體代謝供能。由于膿毒癥的炎癥應激反應導致交感-腎上腺髓質系統、腎上腺皮質系統激活,胰高血糖素及兒茶酚胺分泌增加促進糖異生,脂肪動員增加,脂質分解游離脂肪酸增加,甘油循環增加,導致脂肪分解供能。
本研究發現低代謝模式的死亡率更高,但由于臨床研究例數較少,統計學無明顯差異,后期需要進一步進行研究。許多研究者提出的基礎代謝率可能是影響死亡的預后因素,推測低REE是影響死亡率的獨立因素。Briassoulis等[19]對ICU危重癥患兒研究表明,這些患兒急性期代謝模式大部分為低代謝模式,而低REE是患兒死亡率的獨立相關因素。危重癥患兒代謝低下可能反映了神經體液系統未能有效地調節代謝機制,導致產能失敗,組織底物利用率降低,厭氧代謝和乳酸酸中毒,最終導致器官衰竭。在膿毒癥期間,線粒體抑制在多器官衰竭的發展中起著重要作用。一旦線粒體功能障礙,類似冬眠的低代謝狀態的調節誘導可能會保護細胞功能免受嚴重的生物能量衰竭,雖然這在臨床上表現為器官功能障礙,實際上可能是對長期嚴重炎癥應激的適應性反應。這些變化導致組織氧合減少,底物利用率降低,最終導致多臟器功能衰竭和死亡。
綜上所述,膿毒癥患兒的能量代謝是一復雜的病理生理過程。本研究發現膿毒癥早期大部分患兒的代謝模式為低代謝模式,低代謝模式患兒的死亡發生率更高。經驗性的營養療法有可能增加患兒喂養不足/過量的風險,危重癥患兒的能量供給建議個體化的營養供給,推薦間接測熱法進行指導供給,從而有利于采取合理營養干預及治療,以期改善膿毒癥患者的預后。

