遠端缺血預適應延長經皮冠狀動脈介入治療術中藥物涂層球囊釋放時缺血耐受時間的探討
李牧蔚,郭權,饒立新,彭亮
藥物涂層球囊(DCB)以介入無置入的優點,近年來在經皮冠狀動脈介入治療(PCI)中的應用越發廣泛,其表面覆蓋的抗增殖藥物在釋放時可以均勻涂抹在病變部位,抑制內膜增殖,改善預后[1-2]。在DCB 釋放時,藥物傳遞效率為時間依賴性,短時間的擴張可能會導致藥物作用不充分[3]。而長時間擴張球囊,會導致該病變血管供應的心肌較長時間缺血、缺氧,除患者難以耐受的心絞痛癥狀外,術中也會出現血壓下降、心律失常。在2020 年全球專家共識中,DCB 被推薦應用于原位大血管病變[4],而大血管病變在術中球囊擴張時血流阻斷引起的患者癥狀將更加明顯。既往研究表明遠端缺血預適應(RIPC)可以改善心肌對缺血的耐受性,減少心臟手術引起的肌鈣蛋白升高[5]。本研究旨在探討PCI 過程中應用DCB 前對患者進行RIPC 是否能延長DCB釋放時的耐受時間,減輕患者癥狀,減少心肌損傷。
1 資料與方法
研究人群:選取我院2019 年1 月至2020 年12月間住院的冠心病患者。入選標準:(1)術前造影符合冠狀動脈粥樣硬化性心臟病,并預期使用DCB 治療病變;(2)年齡>18 周歲。排除標準:(1)懷疑/明確的下肢動靜脈血栓,下肢外傷,下肢肢體缺損,嚴重感染;(2)靶血管為閉塞性病變;(3)急性心肌梗死;(4)心肺復蘇后,心原性休克;(5)妊娠;(6)精神異常不能配合;(7)嚴重肝腎功能不全;(8)嚴重高血壓未控制收縮壓≥180 mmHg(1 mmHg=0.133 kPa),舒張壓≥120 mmHg。共納入524 例患者。
分組:術前隨機分組為RIPC 組和對照組,每組262 例患者。RIPC 組在DCB 置入前30 min 左下肢使用袖帶充氣加壓至200 mmHg,且腘動脈、足背動脈均不能觸及搏動,此時遠端血流中斷。持續加壓5 min 后釋放壓力,血流恢復,5 min 后再次充氣加壓,共做三個循環(總時長30 min),之后進行常規DCB 置入操作。對照組在DCB 釋放前也給予下肢袖帶捆綁,但不充氣,30 min后進行DCB置入操作。
術中觀察指標:(1)DCB 釋放時間:從藥物球囊開始給予壓力時計時,當出現:患者癥狀明顯要求停止;心電圖ST 段抬高≥2.0 mV;收縮壓下降大于30 mmHg 或<90 mmHg;嚴重心律失常:心電圖出現室性心動過速、心室顫動、二度2 型以上房室阻滯、心率<50 次/min ;釋放時間達到120 s 的情況時停止計時,緩慢負壓DCB。(2)收縮壓最大下降程度。(3)術前及術后高敏肌鈣蛋白T 的水平變化;(4)觀察各組患者術后30 d 心血管死亡、靶血管血運重建發生率。
手術操作:所有患者均采用紫杉醇DCB(SeQuent Please?,德國)治療,手術由兩名以上經驗豐富的介入醫師完成,患者治療住院期間,均接受常規藥物治療。造影結果使用冠狀動脈造影定量分析(QCA)軟件包進行分析。
統計學方法:采用 SPSS 25.0 統計軟件包進行統計分析。計量資料以表示,組間比較使用t檢驗。計數資料以例數和百分比表示,組間比較用χ2檢驗。P<0.05 為差異有統計學意義。
2 結果
2.1 兩組患者臨床基線資料情況(表1)

表1 兩組患者臨床基線資料情況[例(%)]
RIPC 組年齡 [(59.22±10.93)歲vs.(59.19±11.89)歲]、體重指數[(26.00±2.75)kg/m2vs.(26.07±2.85)kg/m2]、左心室射血分數[(58.22±7.85)% vs.(58.15±8.45)%] 等臨床基線資料與對照組比較,差異均無統計學意義(P均>0.05)。
2.2 兩組患者手術相關指標比較(表2)
表2 兩組患者手術相關指標比較()
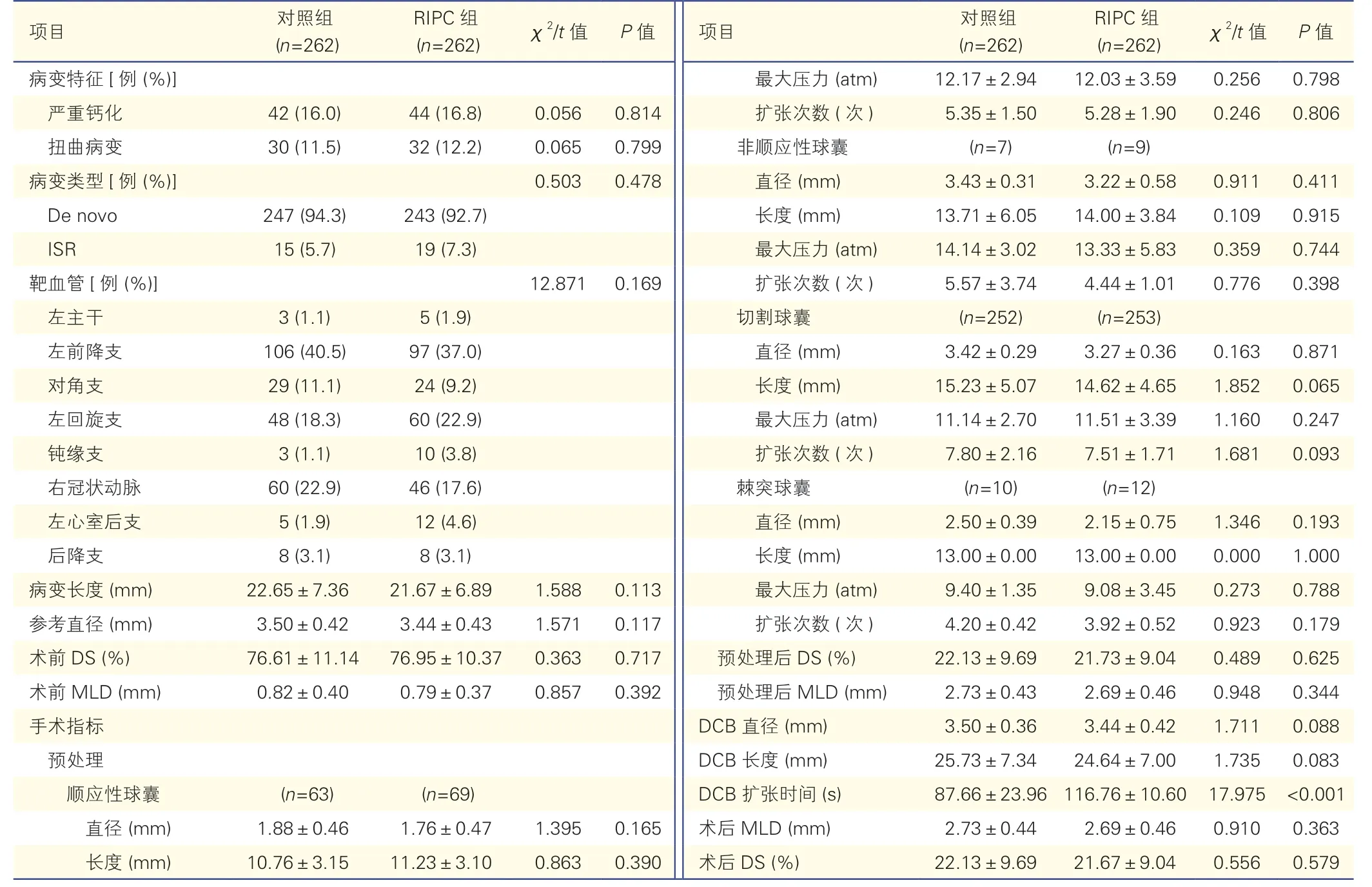
表2 兩組患者手術相關指標比較()
注:RIPC:遠端缺血預適應;De novo:原位新生病變;ISR:支架內再狹窄;DS:直徑狹窄率;MLD:最小管腔直徑;DCB:藥物涂層球囊。1 atm=101.325 kPa
RIPC 組DCB 擴張時間明顯長于對照組[(116.76±10.60)s vs.(87.66±23.96)s],差異有統計學意義(P<0.001)。RIPC 組病變長度[(21.67±6.89)mm vs.(22.65±7.36)mm]、術 前MLD[(0.79±0.37)mm vs.(0.82±0.40)mm]、術 后MLD[(2.69±0.46)mm vs.(2.73±0.44)mm]、術 前DS[(76.95±10.37)%vs.(76.61±11.14)%]、術 后DS[(21.67±9.04)%vs.(22.13±9.69)%]等手術相關指標與對照組間的差異均無統計學意義(P均>0.05)。
2.3 兩組患者血壓、高敏肌鈣蛋白T 水平及圍術期變化比較(表3)
表3 兩組患者血壓、高敏肌鈣蛋白T 水平及圍術期變化比較()
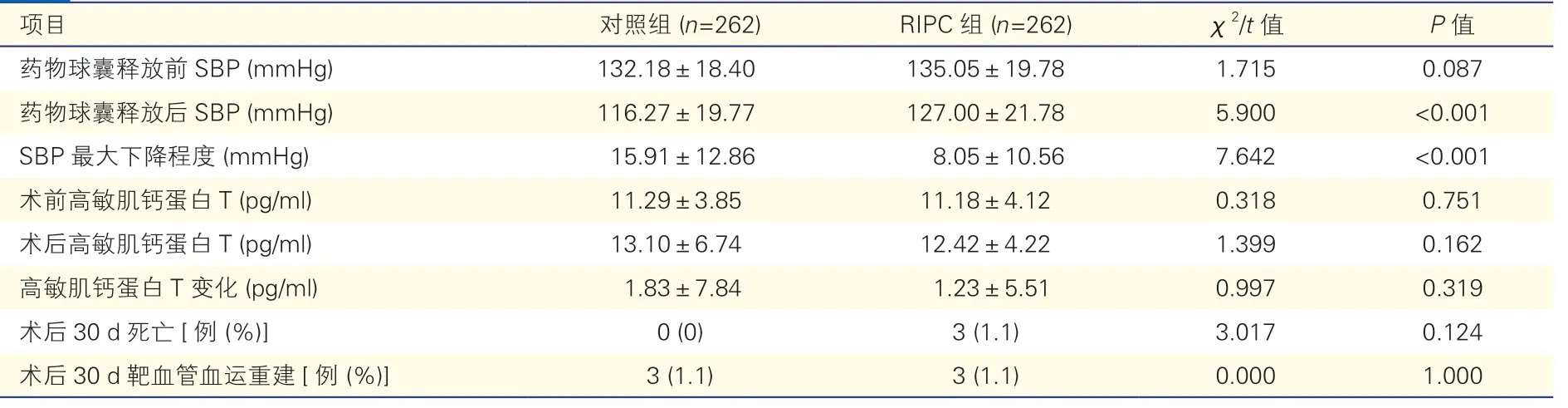
表3 兩組患者血壓、高敏肌鈣蛋白T 水平及圍術期變化比較()
注:RIPC:遠端缺血預適應;SBP:收縮壓。1 mmHg=0.133 kPa
與對照組比較,RIPC 組的患者收縮壓最大下降程度更低[(8.05±10.56)mmHg vs.(15.91±12.86)mmHg],差異有統計學意義(P<0.001);而高敏肌鈣蛋白T 兩組比較差異無統計學意義[(1.23±5.51)pg/ml vs.(1.83±7.84)pg/ml,P=0.319]。
兩組患者術后30 d 的死亡率(0% vs.1.1%,P=0.124)、靶血管血運重建率(1.1% vs.1.1%,P=1.000)差異均無統計學意義。
2.4 兩組患者DCB 結束釋放原因分析(表4)

表4 兩組患者DCB 結束釋放原因分析[例(%)]
RIPC 組有90.1%(236 例)的患者DCB 耐受時間達到了120 s,而對照組只有22.1%(58 例);RIPC 組患者主要是心電圖ST 段抬高≥2 mV,占6.5%,對照組主要是患者癥狀明顯/要求停止,占32.8%,收縮壓下降>30 mmHg 或收縮壓<90 mmHg 占31.7%,兩組比較差異均有統計學意義(P均<0.001)。
3 討論
DCB 以其“無置入”理念近年來被越發重視。與支架相比,DCB 不損害血管原有解剖結構,對邊支影響較小;無異物的持續刺激以減少血栓形成及再狹窄的風險,減少長時間雙聯抗血小板治療引起的出血事件;以及其晚期管腔正性重構作用均表現出獨特優勢[6-8]。
目前臨床應用較多的DCB 有效成分為脂溶性的紫衫醇,球囊擴張時與血管內膜接觸,迅速將藥物傳遞給組織細胞,單次釋放抗增殖作用超過4 周[9]。然而DCB 對于藥物的傳遞效率是時間依賴型的,根據Anderson 等[3]的研究,球囊在與血管壁接觸的前1 min 內只能傳遞15%的有效成分。而1~4 min 內能夠傳遞80%,4 min 后只會增加5%。同樣,紫杉醇對血管壁細胞的抑制也是劑量依賴型的,單位面積內高濃度的紫杉醇對血管內膜增生有更高的抑制率[10]。《美國心臟病學會雜志》心血管介入子刊上發表的臨床研究證實,DCB 擴張時間>60 s 的患者具有更佳的臨床結局。這些證據都表明,DCB 擴張時間越長,長期效果越佳[11]。
但是在DCB 的實際應用中,為了追求更好的貼壁以增加藥物傳送效率,球囊在擴張時遠端血流被阻斷,引發患者的缺血癥狀。因為制作工藝的特殊性,DCB 只能有效擴張一次。故患者對于缺血的耐受程度極大地限制著DCB 的擴張時間。
多項隨機對照試驗證實,術前應用RIPC 可以改善冠狀動脈旁路移植術患者術后的心肌損傷[5,12-13]。也有研究表明,PCI 前給予RIPC 能夠降低冠心病患者的冠狀動脈微循環阻力指數以及提高冠狀動脈血流儲備,改善冠狀動脈微循環功能,改善心肌對缺氧引起的缺血損傷的耐受性,進而起到保護心肌的效應,改善預后[14-17]。也有研究證明,RIPC 還可以減少PCI 圍術期對比劑腎損傷的發生[18]。
本研究顯示,術前應用RIPC 可以增加患者對DCB 擴張的耐受時間,改善患者在球囊擴張時的癥狀,維持血壓的穩定。雖然RIPC 組患者在術中缺血時間更長,但并沒有增加患者圍術期的死亡率與靶血管血運重建率。就RIPC 對心肌的保護作用而言,術前使用有益無害,尤其是針對原位大血管病變、多支病變、心力衰竭患者。
總之,RIPC 是一種無創、簡單易操作的干預措施,可以增加PCI 時DCB 擴張時間,減少心肌損傷,減輕患者術中癥狀,減少低血壓、心律失常等并發癥。
利益沖突:所有作者均聲明不存在利益沖突

