基于改進天線陣列共焦成像算法的腦瘤檢測應用?
周楚霖 陳敬東 王新余 曾 真
(中國船舶集團有限公司第七〇九研究所 武漢 430205)
1 引言
我國腦癌發病率和死亡率位居全國癌癥發病榜前10位。就目前而言,傳統的診療手段對腫瘤針對性不強,放射性高且醫療費用昂貴使很多家庭無法承擔。現在主流的臨床檢測手段有:核磁共振成像核磁共振成像(MIR),腦血管造影,神經核醫學檢查,立體定向活檢術等[1]。但是這些手段都有其局限性,例如MIR由于檢測機理的局限性,不適用于由于手術等原因植入有磁金屬或起搏器的特殊患者。
本文利用正常組織和癌變組織間較大的電磁參數差異檢測腫瘤的存在。通過天線陣列發射和接收脈沖信號,計算散射參數并結合本文目標定位算法確定腦瘤位置。這種方法相對安全,無有害輻射,不進入人體內部,沒有壓迫感,不會傷害正常組織,對小直徑的早期腫瘤有著相當可觀的檢測效果,資源耗費相對較小,更加適合輕量化、可移動化臨床檢測,并且利用電磁學理論進行腫瘤檢測具有重要研究意義,為復雜組織結構的三維立體腫瘤檢測提供了具有參考價值的思路和方法。
2 檢測機理與數學模型
在特定電磁環境下,每種組織材料有其對應的介電常數和電導率,脈沖在穿過不同有耗組織材料時會產生一定的相移量,這一相移量不僅僅體現在脈沖穿過組織內部,也體現在穿過不同組織邊界[2]。并且這個相移不僅與組織材料的電導率和介電常數有關,也與所處的外部輻射源的頻率有關。如表1所示為有、無腫瘤時各頻率下XFDTD計算出的散射參數相位特性[13~14]。
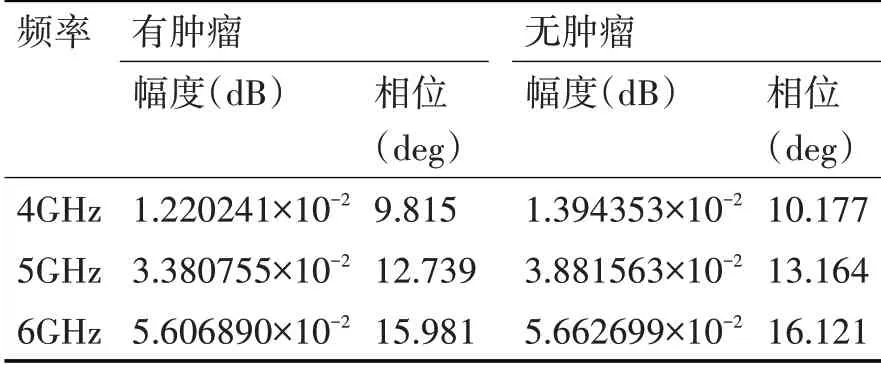
表1 有無腫瘤時各頻率的散射參數相位特性
脈沖在有耗媒質內部的相移β根據式(1)計算得出[3]。
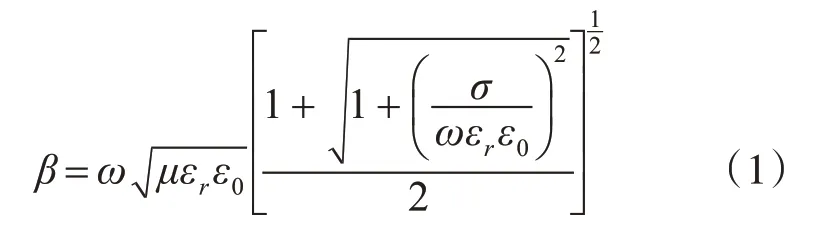
其中,β為脈沖穿過單位長度的相移量,ω為脈沖頻率,μ為磁導率,數值為4π×107,εrε0為實際的介電常數,其中εr為相對介電常數,ε0為真空中的介電常數,數值為8.85×1012,σ為各組織材料的電導率,單位為S/m。
脈沖穿過兩個不同組織材料邊界的相移根據式(2)~(4)計算得出[4]。
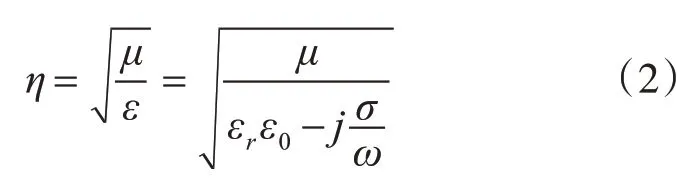
式(2)表示每個有耗媒質組織的波阻抗,μ為磁導率,數值為4π×107,εrε0為實際的介電常數,εr為相對介電常數,ε0為真空中的介電常數,數值為8.85×1012,σ為各組織材料的電導率,單位為S/m,ω為脈沖頻率,j為虛數單位。
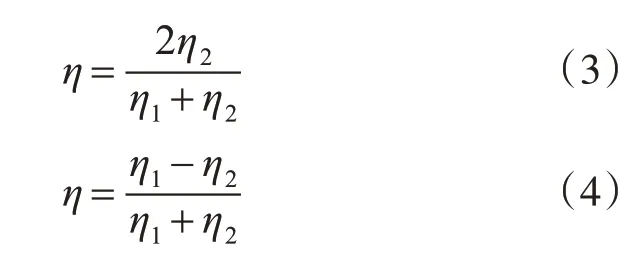
其中,式(3)表示穿過兩個不同組織(非腫瘤組織)的透射系數[5],該復數的幅角即為相移量。若脈沖由一般組織邊界到腫瘤組織邊界或由腫瘤組織反射回一般組織邊界,透射系數根據式(4)計算得出[6~7]。
3 基于改進的天線陣列共焦成像算法的腦瘤檢測應用
3.1 系統流程及方法
本文在共焦成像算法[8]的基礎上,建立人體頭部組織模型,進行腫瘤早期檢測。利用XFDTD和Matlab實現了人腦的建模工作,建模流程大致為:頭部三維模型建立(S1)-網格化處理(S2)-二維組織切面層截取(S3)-添加腫瘤組織(S4)-設置天線陣列和輻射源(S5),建模主要流程如圖1所示。
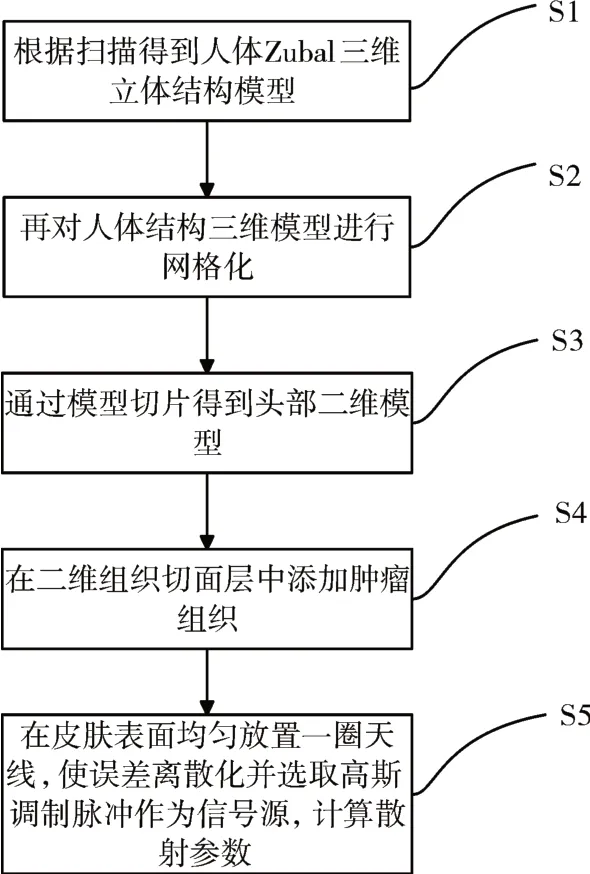
圖1 模型建立流程圖
本文設計了一套合理可行的算法,在二維組織切面上根據收發天線連線上組織的種類和數量,根據相關公式以及各個組織材料在特定頻率下的電磁特性計算出散射參數及其相移。分別按照單發單收,單發多收的方法計算各個天線組,各個頻率下組織材料的散射參數相移,并與由XFDTD計算出的有腫瘤和無腫瘤情況下實際散射參數的相移差作對比,得到置信度矩陣。最后,完成矩陣信息可視化,對各組得到的置信度矩陣疊加取平均,使周圍組織和腫瘤組織的相似度差距增大到0.5以上,在網格圖中顏色差距明顯,可以較容易地找到腫瘤的位置。
3.2 頭部切片模型建立與腫瘤添加
本文從頭部三維立體結構入手,用分層切片的方式提取腦部二維組織切片模型。根據已有技術相對成熟的核磁共振模型[9](The MRI-Head Phan?tom)建立人體頭部三維模型,每種組織有相應的編號,根據編號可以確定不同的組織類型。例如本文所用的MRI頭部影像文件有256*256*128字節的體積。MRI頭部影像材料和標號,如表2所示(篇幅有限,列出主要組織)表中數字為The MRI-Head Phantom所用到的主要的ID標號。所有組織結構均采用了基于結構的三維中值濾波,使每個結構的表面具有更真實的“光滑”曲率。利用Matlab可以對每個組織的編碼和命名寫入,形成人體的三維結構模型。

表2 頭部主要組織的電導率和介電常數
對三維模型進行網格化處理,方便直觀分辨每種組織的結構與特性,使每種組織由類似于“細胞”的小塊構成。實際上,網格化即矩陣特性排列,矩陣中每個元素的數值代表其對應的組織編號,為了兼顧分辨率我們將每個小塊的邊長設置為3.6mm[10]。人體頭部結構復雜,組織眾多,相互干擾較為嚴重,為簡化模型和降低仿真難度、優化數據結構、方便數據處理,我們在二維切片截面上進行仿真計算。
首先選取合適的切片層數,依據腦部主要組織(腦灰質和腦白質)材料較多,腔體較大,便于后期仿真實驗和數據處理工作的特點,在Matlab中進行分層切片,每種組織以不同顏色顯示。此時,最優的人體頭部特定切片的二維模型建立已基本完成。
在上一步的基礎上,我們在XFDTD仿真軟件上加入腫瘤組織,由于正常腦部組織和腫瘤組織的差別較為明顯,故依此設置腫瘤的參數。經測試,在4GHz環境下腫瘤的電導率為4(S/m),相對介電常數為60[11]。腫瘤的大小方面,若設置太大不符合腫瘤生長的實際情況,但設置太小,由于mesh網格分辨率不高,腫瘤組織將不會在網格中清楚顯示其邊界,不易于后續仿真與觀察;經反復測試,決定設置小球的球心在一個網格中心,半徑為1.8mm,使其剛好占據一個小塊大小。如圖2所示為添加了腫瘤組織腦部meshXY視圖。

圖2 添加了腫瘤組織腦部meshXY視圖
3.3 天線陣列建立與激勵源設置
最后加入天線和設置合適的激勵源,由于人腦結構非中心對稱結構,為方便起見,我們建立8根線天線,長度各為5cm,平行于Z軸,均勻排列在腦部一周。采用收發天線分離的配置方式,即一個發射天線一根接收天線,即實現單發單收/自發自收,如此做,只需計算S11參數即可;及一根發射天線(T1)配有多個接收天線(R1-R7),即實現單發多收,計算S21,S31,S41等。這樣可以降低對天線設計的苛刻要求,同時采用共焦成像算法避免了復雜的散射場計算。各個天線的位置如圖3所示,如圖4為三維空間當中的實際效果圖。
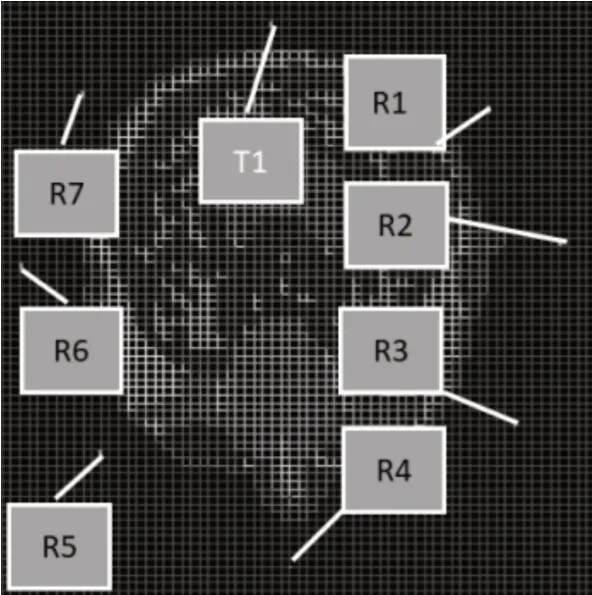
圖3 各收發天線位置圖

圖4 三維空間天線效果圖
激勵源的選擇直接影響著成像的效果,不同的激勵源的回波信號之間存在較大的差異。經測試,我們選取高斯調制脈沖[12](Modulated Guassian)作為信號源較其它信號源能夠更好地得到散射參數和相移信息,高斯調制脈沖的時域表達式根據式(5)計算。
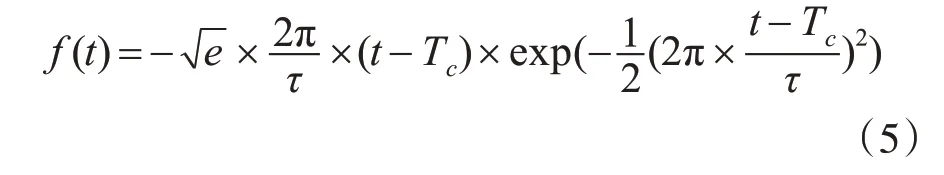
其中Tc為時移單位,τ是脈沖寬度參量。
3.4 改進的共焦成像算法
本文共焦成像算法在不同收發位置、不同輻射環境下、使用單發單收和單發多收策略分別進行腫瘤檢測。
首先假設當前檢測位置(記為aij)為腫瘤位置,將選定的腫瘤假想點aij與發射、接收天線(分別記為T、Rk)連線并找到連線路徑上的組織小塊,統計各類組織小塊的種類(1、2、3、4……)與數量,記為n,用連線上兩兩相鄰組織的種類編號做差(λ)判斷組織小塊間類型是否相同,如式(6)所示。

類似的,根據式(1)~(4)遍歷并計算所有小塊的散射參數總相移β,與電磁數值仿真軟件XFDTD計算出的散射參數β*相移相做差比較,得到該點為實際腫瘤位置的置信度值[13],記為θ;重新選擇不同輻射環境和不同天線收發位置,直到遍歷所有情況,得到該點的置信度平均值,記為θˉ;再對二維組織切面上每一個點做相同的計算,得到整個切面層的置信度矩陣,進行歸一化處理,其中置信度較大的位置即為實際腫瘤位置,算法流程如圖5所示。
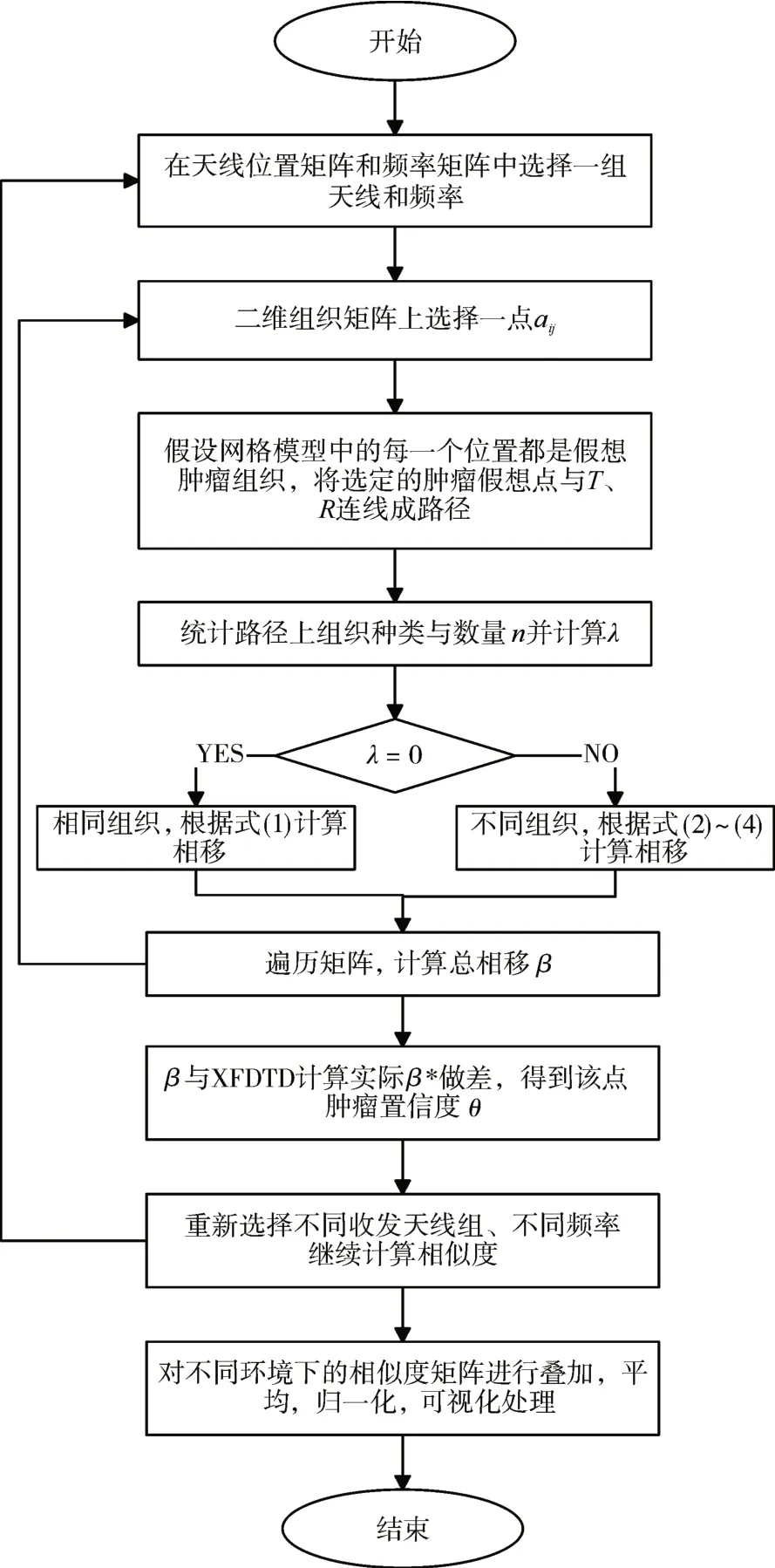
圖5 共焦成像算法流程
為提高計算精度、降低復雜度,我們對算法進行了優化。在散射參數處理方面,我們在有腫瘤和無腫瘤兩種情況下,對XFDTD計算出的對應頻率下的散射參數復數值做差取相移,如此做,可以有效減少其他組織回波干擾和空氣層的散射干擾。在腫瘤假設點選取方面,我們沒有對二維組織切面上的所有位置進行遍歷,而是預先排除了一些不可能的位置,如空氣層、皮膚、頭骨等組織;如此做,將原先需要遍歷的整個二維組織矩陣縮小到了特定的矩陣區域,極大減少了計算量,縮短了檢測時間,提高了檢測效率[14]。
4 實驗結果及分析
經計算,得到二維組織切面的相似度矩陣,利用Matlab繪圖即可較明顯地觀察到腫瘤位置。單發單收模式下,選取一根天線作為發射天線,一根作為接收天線,對4GHz、5GHz、6GHz頻率下計算得到的置信度矩陣疊加,歸一化,可視化。單發多收模式下,采用8根天線陣列進行仿真;其中設定一根作為發射天線(記為T),其余7根作為接收天線(記為R1-R7),每組分別在4GHz、5GHz、6GHz環境下進行,并對所有收發天線組的計算結果結果進行疊加,歸一化,可視化后,得到平均置信度矩陣仿真結果,如圖6(a)、(b)所示分別為單發單收,單發多收模式下仿真結果。

圖6 單發單收,單發多收模式下仿真結果
由以上的仿真結果可以比較直觀地根據顏色分辨出腫瘤的可能位置(置信度越高,顏色越深),腫瘤位置更加清晰可辨,理論上,可以選取任意兩個天線位置為發射天線或者接收天線,不僅僅局限于本例中的發射天線T。對比單發單收模式可見,單發多收模式下仿真結果更加理想[15~16],其主要原因在于往返路徑上所穿過的組織不同,更加適合腦內的復雜環境,利用7組不同位置的天線源作為接收天線,將圍繞腦部360°的組織充分考慮進去,增加數據的多樣和仿真結果的可靠性,并且有效地避免了“偽腫瘤”的出現,大大增加了早期腫瘤檢測的精準度[17~18]。
為驗證優化效果,我們在“單發多收”模式下對未優化的算法在準確度、檢測時間和計算資源消耗方面進行對比,如圖7(a)、(b)分別為采用未優化、優化算法后的仿真結果,如表3所示為檢測時間和資源消耗對比。從中可以看出未優化算法仿真結果并不理想,不但檢測時間長、資源占用大,且一定程度上影響檢測準確率,使可視化程度降低,腫瘤位置難以清楚分辨,甚至造成漏檢、誤檢。
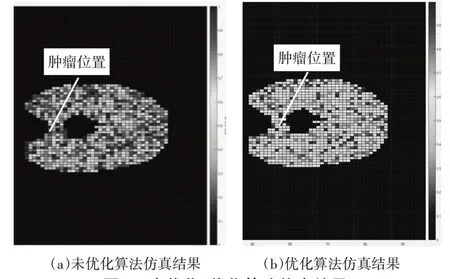
圖7 未優化、優化算法仿真結果

表3 未優化、優化算法檢測時間與資源消耗對比
5 結語
本文按照建模、仿真、數據處理的順序逐步實現了人腦腫瘤的檢測和定位,一定程度上克服了先前利用超寬帶微波成像實現在復雜環境中(如人腦內部)無法成像的缺點[19],并在檢測效率和資源消耗方面有所優化。然而本方法仍有待繼續改進與深化,例如算法環境設置為腫瘤所在的二維平面,而在現代醫學實際檢測中,應面向整個頭部組織,然而三維結構中的組織復雜,計算量大,對天線陣列,所選激勵和算法的要求都更為嚴苛,實現難度更大。
利用電磁學理論進行腫瘤檢測的方法目前仍然處于開發和嘗試階段,而如何突破此方法的局限和難題,使其適用性更廣,可實現性更強,可操作性更佳仍然是未來研究的方向。

